Что попить при фурункулезе
Принципы диагностики и лечения хронического рецидивирующего фурункулеза
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
При ХРФ выявляются нарушения практически всех звеньев иммунной системы. По данным Н. Х. Сетдиковой, 71,1% больных фурункулезом имели нарушения фагоцитарного звена иммунитета, что выражалось в снижении внутриклеточной бактерицидности нейтрофилов, дефектах образования активных форм кислорода. Дефекты, приводящие к нарушению миграции гранулоцитов, могут приводить к хроническим бактериальным инфекциям, что продемонстрировали в своей работе Kalkman и соавторы в 2002 г. Дефекты утилизации патогенов внутри фагоцитов могут быть обусловлены разными причинами и иметь тяжелые последствия (так, например, дефект НАДФН-оксидазы приводит к незавершенному фагоцитозу и развитию соответствующей тяжелой клинической картины). Низкие показатели уровня сывороточного железа, возможно, могут обусловливать снижение эффективности оксидативного киллинга патогенных микроорганизмов нейтрофилами. Рядом авторов выявлено снижение общего количества Т-лимфоцитов периферической крови. Как правило, у больных ХРФ снижено количество CD4-лимфоцитов (у 20–50% пациентов) и повышено количество CD8-лимфоцитов (у 14–60,4% пациентов).
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
В период ремиссии возможно назначение следующих иммуномодуляторов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
В настоящее время продолжается поиск новых иммуномодулирующих препаратов, способных оказывать положительное влияние на течение воспалительного процесса при фурункулезе. Проводятся клинические испытания новых отечественных иммуномодуляторов, таких, как серамил, неоген. Серамил является синтетическим аналогом эндогенного иммунорегуляторного пептида — миелопептида-3 (МП-3). Серамил применялся в составе комплексной терапии больных ХРФ как в стадии обострения, так и в стадии ремиссии по 5 мг № 5 внутримышечно. После лечения препаратом отмечались нормализация уровня В-лимфоцитов, а также снижение уровня СD8-лимфоцитов. Выявлено значительное удлинение сроков ремиссии заболевания (до 12 мес у 30% пациентов).
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор
Лечение фурункулеза: причины и профилактика
Цены носят ознакомительный характер и не являются публичной офертой.
Стоимость
Аллергология-иммунология
| Наименование услуги | Цена |
|---|---|
| Консультация аллерголога-иммунолога, первичная | 3 500 ₽ |
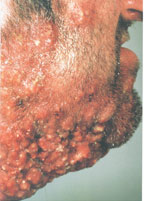
Фурункулез – гнойно-некротическое воспаление волосяного фолликула и окружающей подкожно-жировой клетчатки. Образуется на волосяных частях кожи. Возбудителем инфекции обычно является золотистый стафилококк.
Фурункулез чаще встречается у людей с ослабленной иммунной системой, подростков и взрослых. Фурункулез у детей и пожилых бывает редко. Заболевание поражает мужчин больше, чем женщин. Антисанитарные условия жизни увеличивают риск заражения.
Фурункулы могут исчезнуть без какого-либо лечения. Иногда они лопаются сами по себе и заживают бесследно в течение от 2 дней до 3 недель. Однако после заживления они могут привести к такому осложнению фурункулеза, как рубцы. Если нарыв сопровождается лихорадкой, болью и другие проявлениями, влияющими на самочувствие, человеку следует обратиться за медицинской помощью.
Три или более эпизода в течение 12 месяцев определяется как рецидивирующий фурункулез. В таком случае также нужно обратиться к врачу, даже если фурункулы имеют тенденцию заживать сами по себе.
Симптомы фурункулеза
Фурункулы представляют собой красные, опухшие и болезненные узелки разного размера. Чем больше они становятся, тем болезненнее ощущение. Окружающая кожа обычно красная и воспаленная. Узелки быстро наполняются гноем и на последней стадии фурункулеза могут лопнуть. Если инфицировано несколько соседних фолликулов, они могут срастаться и образовывать более крупный узел, называемый карбункулом. Карбункул – это совокупность фурункулов.
Лихорадка и увеличение лимфатических узлов при заболевании фурункулезом возникают редко, однако возможны.
Фурункулы и карбункулы обычно поражают бедра, подмышки, ягодицы, лицо и шею. Они возникают в местах, подверженных образованию волос, поту и трению.
Причины фурункулеза
Бактерии стафилококка, вызывающие инфекцию, обитают на коже, концентрируясь в частях тела, где присутствуют складки (фурункулез на лице, в частности фурункулез носа и фурункулез губы – самые распространенные места проявления болезни). Обычно иммунная система держит их под контролем, однако при ослабленном иммунитете они попадают в кожу через волосяной фолликул, порез или царапину на коже. Спровоцировать фурункулез может обычная травма кожных покровов или их расчесывание. Фурункулы часто являются результатом несоблюдения элементарных норм личной гигиены. Когда кожа заражается, иммунная система реагирует, посылая лейкоциты в пораженный участок, чтобы уничтожить бактерии. Гной – это скопление мертвых бактерий, мертвых лейкоцитов и мертвой кожи.
Следующие условия повышают риск развития фурункулеза кожи:
Сам по себе при контакте фурункулез не заразен, однако при ослабленном иммунитете иногда инфекция может распространяться, когда люди используют одно пространство или материалы, например, одежду и гидромассажные ванны для ног.
Как лечить фурункулез?
Отметим сразу, что лечение фурункулеза должно происходить только у врача, имеющего соответствующую подготовку и оборудование. Только он может подобрать схему лечения фурункулеза в каждом индивидуальном случае.
Не пытайтесь лопнуть или сдавить фурункулы или карбункулы самостоятельно! Если поражение очень болезненное, если оно длится более 2 дней или есть жар, вам следует обратиться к врачу с запросом, как вылечить фурункулез в конкретно вашем случае.
Фурункулез: лечение профессиональное
Врач назначает анализы при фурункулезе – мазки посевов с области поражений (из фурункулов, полученных путем разреза), а также с участков носителей на коже.
Иногда проводится полный анализ крови, чтобы определить причины кожной инфекции и подобрать более эффективное лечение фурункулеза, а также исключить другое внутреннее заболевание. Иммунологическая оценка может быть рассмотрена при рецидиве заболевания или признаках другого заболевания.
Врач может использовать стерилизованную иглу, чтобы проколоть абсцесс при фурункулезе и вывести гной. Прокалывания может быть достаточно для устранения фурункулеза, но если инфекция распространяется на более глубокий слой под кожей, лечащий врач может назначить антибиотики.
В «Клинике уха, горла и носа» мы занимаемся лечением различных кожных болезней, в том числе фурункулеза, по приемлемым ценам – с выявлением первопричины появления и назначением действенной медикаментозной и физиотерапии.
Профилактика фурункулеза
Способы предотвращения заболевания включают:
Соблюдение здоровой, сбалансированной диеты и регулярные физические упражнения улучшат общее состояние здоровья и иммунную систему, снизив риск развития не только фурункулеза, но и всех болезней в целом.
Своевременное обращение к врачу поможет сохранить Ваше здоровье.
Не откладывайте лечение, звоните прямо сейчас. Мы работаем круглосуточно.
Отечественные иммунотропные лекарственные средства последнего поколения и стратегия их применения
Введение Современная патология характеризуется ростом заболеваний, связанных с вторичной иммунологической недостаточностью. Она проявляется в частых, вялотекущих, рецидивирующих инфекционно-воспалительных заболеваниях дыхательного, желудочно
Современная патология характеризуется ростом заболеваний, связанных с вторичной иммунологической недостаточностью. Она проявляется в частых, вялотекущих, рецидивирующих инфекционно-воспалительных заболеваниях дыхательного, желудочно-кишечного и урогенитального трактов, кожи и мягких тканей. Применение антибактериальных лекарственных средств нередко бывает малоэффективным или вообще неэффективным. Становится очевидным, что без повышения иммунологической реактивности трудно (или невозможно) добиться хорошего клинического эффекта при различных хронических инфекционно-воспалительных процессах. Одним из главных методов коррекции иммунитета является применение иммунотропных лекарственных средств (ИТЛС). В настоящее время врач-иммунолог располагает достаточно большим набором таких препаратов. По происхождению их можно разделить на три группы: полимерные, экзогенные и эндогенные [20]. В данном обзоре представлены только те ИТЛС, которые разработаны и внедрены в клиническую практику за последнее десятилетие и являются новейшими достижениями отечественной науки.
К полимерным ИТЛС, полученным с помощью направленного химического синтеза, относится препарат полиоксидоний (выпускается в виде ампул по 3 мг). Он представляет собой N-оксидированное производное полиэтиленпиперозина с высоким молекулярным весом [13,15]. Препарат обладает широким спектром иммунофармакологического воздействия. Он стимулирует функциональную активность трех важнейших субпопуляций фагоцитов: подвижных макрофагов тканей, циркулирующих фагоцитов крови и оседлых фагоцитов ретикуло-эндотелиальной ткани. Это проявляется в повышенной способности фагоцитов поглощать и переваривать микробы, в образовании активных форм кислорода, повышении миграционной активности нейтрофилов. Результатом активации оседлых макрофагов ретикуло-эндотелиальной системы под влиянием полиоксидония является более эффективная элиминация из организма чужеродных частиц. Суммарным следствием активации факторов естественного иммунитета является повышение устойчивости животных к экспериментальным бактериальным и вирусным инфекциям. Полиоксидоний повышает также функциональную активность Т- и В-лимфоцитов, усиливая кооперативное взаимодействие между этими двумя важнейшими клеточными популяциями. При введении экспериментальным животным полиоксидония совместно с каким-либо антигеном наблюдается более чем десятикратное усиление антителообразования к этому антигену. Этот эффект отмечается к Т-зависимым и Т-независимым антигенам как животного, так и микробного происхождения. Полиоксидоний способен активировать иммунные реакции у животных с тяжелыми формами иммунодефицитов, в частности усиливать антителообразование у:
Кроме того, для полиоксидония характерно еще одно важное качество, не связанное с активацией иммунной системы: он обладает детоксицирующими свойствами. В силу своего молекулярного веса и наличия на поверхности молекулы большого количества различных активных групп он активно адсорбирует как растворимые токсические субстанции, так и микрочастицы, циркулирующие в крови. Полиоксидоний также обладает способностью снижать токсичность ряда лекарственных средств.
Препарат рекомендуется в качестве иммуномодулятора в комплексной терапии заболеваний или состояний, сопровождающихся угнетением иммунитета, так как при этих патологических процессах показал высокую клиническую эффективность. Он назначается внутримышечно, 5-7 инъекций на курс. ХНЗЛ были использованы две схемы лечения с разовыми дозами 6 мг (1-я) и 12 мг (2-я). При лечении полиоксидонием больных хроническим бронхитом в фазе ремиссии было отмечено удлинение сроков ремиссии и исчезновение астенического синдрома. Хороший эффект (быстрое купирование симптомов заболевания, сокращение сроков нетрудоспособности, достижение стойкой ремиссии, нормализация лабораторных показателей и др.) дали 1-я и 2-я схемы лечения в 63,6 и 77,8% случаев соответственно. Назначение в качестве препарата сравнения иммуномодулятора нуклеината натрия дает положительные результаты у 51,4% больных. Лечение полиоксидонием больных хроническим бронхитом в период обострения в комплексе с антибиотиками способствовало значительному улучшению их общего состояния, при этом уменьшались слабость, потливость, кашель и количество выделяемой мокроты, нормализовалась температура, исчезали хрипы в легких. Применение 1-й и 2-й схем лечения привело к хорошему эффекту у 66,6 и 87,5% больных соответственно. При лечении нуклеинатом натрия хороший эффект был только у 54,5%. При применении плацебо как в стадии ремиссии, так и в период обострения наблюдался только удовлетворительный эффект: купирование симптомов заболевания и положительная динамика в лабораторно-инструментальных данных.
У больных под воздействием полиоксидония происходила нормализация иммунонологических показателей: увеличение CD3 T-лимфоцитов, увеличение NK-активности, нормализация функциональной активности фагоцитарных клеток.
У пациентов с хроническим рецидивирующим фурункулезом в стадии ремиссии наблюдалось значительное удлинение ремиссии и снижение симптомов интоксикации. Хорошие результаты получены при применении 1-й и 2-й схем лечения у 60 и 81,8% больных соответственно. У больных, получавших нуклеинат натрия, наблюдался только удовлетворительный эффект (33,3%). У больных, получавших плацебо, положительной динамики клинической картины не выявлено. При применении полиоксидония в комплексе с антибиотиками у больных фурункулезом в стадии обострения происходила быстрая регрессия фурункулов, уменьшение их количества, уменьшение симптомов интоксикации. Хороший эффект при применении 1-й и 2-й схем лечения был у 80 и 90,9% больных соответственно. Положительная клиническая картина сопровождалась нормализацией иммунологических показателей.
Ярким примером клинической эффективности препарата являются результаты, полученные при лечении хирургических инфекций: сепсиса, перитонита, абсцессов и инфильтратов брюшной полости, гнойно-воспалительных процессов в малом тазу [11,18]. В группе, получавшей полиоксидоний, хорошие и отличные показатели наблюдались у 75 и 80% больных соответственно. В контрольной группе хороший и отличный результат был получен у 42% больных.
Хороший клинический эффект полиоксидония при хирургических инфекциях в значительной степени связан с его способностью усиливать процессы регенерации. Это проявлялось в быстром очищении раны от гнойно-некротических масс, ее эпителизации и сокращении сроков заживления (на 21%). Включение полиоксидония в комплексное лечение гнойно-раневых инфекций способствовало быстрому очищению раны от микроорганизмов.
У всех больных, имеющих в послеоперационный период гнойно-септические осложнения, наблюдались нарушения иммунного статуса, степень выраженности которых зависела от тяжести этого осложнения: снижалась функциональная активность фагоцитарных клеток, уменьшался уровень CD3 и CD4 T-лимфоцитов и IgG. Применение поолиоксидония существенно улучшало ряд биохимических и иммунологических параметров у хирургических больных. Во всех группах, получавших этот препарат, в отличие от контрольной группы снижалась активность печеночных ферментов (АСТ и АЛТ), уровень билирубина, креатинина и мочевины сыворотки крови, что, вероятно, связано с антиоксидантными и детоксицирующими свойствами полиоксидония.
К ИТЛС экзогенного происхождения относятся препараты бактериального и грибкового происхождения. К медицинскому применению разрешены такие средства микробного происхождения, как БЦЖ, пирогенал, продигиозан, нуклеинат натрия, рибомунил, бронхомунал и др. Все они обладают способностью усиливать функциональную активность нейтрофилов и макрофагов [7]. Как известно, микобактерии туберкулеза, входящие в состав полного адьюванта Фрейнда, обладают выраженной способностью стимулировать неспецифическую резистентность, клеточный и гуморальный иммунитет. Анализ компонентов микобактерий, ответственных за этот стимулирующий эффект, привел к открытию в составе пептидогликана клеточной стенки этих и практически всех других бактерий нового мощного иммуностимулятора — мурамилдипептида [22, 23]. Российские специалисты почти одновременно с французскими исследователями выделили из противоопухолевого препарата бластолизина — гидролизата клеточной стенки L.bulgaricus вещество, сходное по химической структуре, которое в дальнейшем было получено синтетическим путем [1]. Оно успешно прошло клинические испытания и получило фармакопейное название ликопид. Он выпускается в таблетированной форме по 10 мг и 1 мг. Препарат показал полную безвредность и высокую эффективность при ряде вторичных иммунодефицитных состояний [6]. Главной мишенью ликопида в организме являются клетки моноцитарно- макрофагального ряда. Он усиливает практически все функции клеток этой системы, в частности обеспечивает следующие процессы:
В ряде случаев ликопид эффективен и в виде монотерапии. Так, его своевременное применение по 1 мг. 3 раза в день в течение 10 дней в профилактических целях позволило существенно снизить (в 2,5 раза) сезонные острые респираторные заболевания. В самом начале развития патологического процесса ликопид оказывается эффективным (по 10 мг 1 раз в сутки в течение 10 дней) при папилломатозе шейки матки.
Применение его по той же схеме после хирургического лечения позволило свести практически к нулю рецидив папилломатоза. При использовании в качестве препарата сравнения нуклеината натрия эффективность лечения составила около 60%. Ликопид оказался также высокоэффективным при комплексной терапии острых и хронических герпетических инфекций всех локализаций. Схема лечения зависит от тяжести патологического процесса При легких и средней тяжести формах заболевания ликопид целесообразно принимать по 2 мг 3 раза в день, при тяжелых — по 10 мг 2-3 раза в день в течение 10 дней. Его комбинация с противовирусными средствами позволяет быстро купировать патологический процесс и вызвать стойкую ремиссию в течение года и более. Препарат хорошо взаимодействует не только с противовирусными средствами, но и с препаратами интерферона и их индукторами.
Высока клиническая эффективность ликопида и в комплексном лечении такого тяжелого заболевания, как туберкулез легких. Его назначение тремя курсами по 6-7 дней с интервалами в две недели с разовой дозой 10 мг ведет к более быстрому закрытию каверн и прекращению бациллоносительства.
Применение ликопида с целью профилактики хирургических инфекций позволило в несколько раз сократить частоту их развития. При наличии развившегося осложнения ликопид препятствует прогрессированию патологического процесса, возникновению новых осложнений, развитию пневмоний. Кроме того, он показал высокую клиническую эффективность практически при всех видах долго не заживающих ран, а также при трофических язвах.
Клинический эффект, как правило, сопровождается и выраженным улучшением иммунологических показателей. Наиболее четко это показано на примере хирургических инфекций [5,19,21]. Как при профилактике, так и при лечении этих инфекций ликопид оказывал положительное воздействие на гематологические, биохимические и иммунологические параметры. У больных, принимавших по 3 мг ликопида в течение 10 дней, по сравнению с больными, получавшими плацебо, были отмечены следующие статистически значимые положительные изменения:
В настоящее время в качестве ИТЛС эндогенного происхождения для профилактики и лечения вторичных иммунодефицитов применяются иммунорегуляторные пептиды, полученные из центральных органов иммунитета: тимуса и костного мозга и цитокины.
Из ИТЛС, полученных из костного мозга, достаточно широко распространен миелопид (выпускается в ампулах по 3 мг, разработка которого началась в начале 70-х годов, после того как было обнаружено, что костный мозг продуцирует группу биорегуляторных пептидных медиаторов, названных миелопептидами [14]. Эти биологически активные медиаторы обладают способностью стимулировать различные звенья иммунного ответа, особенно гуморальный иммунитет [10]. В состав миелопида входят шесть низкомолекулярных миелопептидов (МП) с молекулярной массой 500-3000 D, выделенных из супернатанта культуры клеток костного мозга свиньи методом твердофазной экстракции. Каждый миелопептид обладает определенным биологическим действием, совокупность которых и обусловливает его клинический эффект. МП-1 восстанавливает нормальный баланс активности Т-хелперов и Т-супрессоров. МП-2 подавляет пролиферацию злокачественных клеток и существенно снижает способность опухолевых клеток продуцировать токсические субстанции, подавляющие функциональную активность Т-лимфоцитов. МП-3 стимулирует активность фагоцитарного звена иммунитета и, следовательно, повышает антиинфекционный иммунитет. МП-4 оказывает влияние на дифференцировку гемопоэтических клеток, способствуя их более быстрому созреванию, т. е. обладает лейкопоэтическим эффектом.
Миелопид нашел применение в клинике для восстановления нормального функционирования иммунной системы при различных патологических состояниях.
Включение миелопида в комплексную терапию хронических неспецифических заболеваний легких существенно улучшает клиническое состояние больных и значительно увеличивает продолжительность ремиссии ( до одного года и более у 78%). Применение миелопида в комплексной терапии гнойно-воспалительных процессов позволяет добиться быстрой и полной санации очага инфекции и увеличивает эффективность действия антибиотиков. Так, у больных, перенесших различные операции на сердце, пневмония и нагноение раны с медиастинитом возникли в 15,5 и 18,9% случаев в контрольной группе, в опытной группе эти осложнения наблюдались у 6,7 и 10,8% соответственно. Следует отметить, что осложнения, развившиеся у больных, получавших миелопид, протекали на фоне менее выраженной интоксикации и лихорадки, умеренного лейкоцитоза и сопровождались незначительным гнойным отделяемым из раны. Клиническое улучшение у больных, получавших миелопид, наступало на 12-14-й день, у больных контрольной группы — на 17-21-й день после операции. Миелопид оказался также эффективным в комплексном лечении переломов нижней челюсти [17].
Иммунологическое исследование показало, что уже на первые-вторые сутки после операции у больных развивается выраженный иммунодефицит, при котором страдают практически все звенья иммунной системы. Проведение сразу после операции иммунотерапии с помощью миелопида приводило к значительному ускорению восстановления всех показателей иммунитета. Количество Т- и В-лимфоцитов и Т-хелперов у таких больных достигало нормальных значений уже на седьмые-восьмые сутки. Также происходило восстановление функциональной активности Т- и В-лимфоцитов, определяемое по способности синтезировать ИЛ-2 и иммуноглобулины соответственно [3].
Патологические состояния, при которых рекомендовано применение полиоксидония:
Патологические состояния, при которых рекомендуется применение ликопида:
Патологические состояния, при которых рекомендовано применение миелопида:
Патологические состояния, при которых применяется иммунофан:
Травма, так же как и оперативное вмешательство, ведет к развитию иммунодефицита, которое прежде всего проявляется в понижении уровня Т-клеток уже на следующие сутки. Без иммуностимуляции это иммунодефицитное состояние сохранялось в течение трех недель. Применение миелопида вело к существенному улучшению иммунологических показателей: количество Т-лимфоцитов возвращалось к норме на седьмой день. Восстановление иммунологических показателей четко коррелировало с улучшением клинической картины заболевания [17].
Из ИТЛС, полученных из тимуса, в клинической практике нашел применение целый ряд препаратов нескольких поколений. Толчком к их созданию стало открытие нового класса биологически активных соединений — пептидных гормонов тимуса [24]. К ним относится семейство тимозинов, тимопоэтинов и сывороточный тимический фактор — тимулин. Эти тимические пептиды при поступлении в кровь оказывают влияние на всю периферическую иммунную систему, стимулируя рост и пролиферацию лимфоидных клеток. Установление этого факта явилось мощным толчком к созданию ИТЛС тимического происхождения.
К ИТЛС первого поколения относятся препараты, полученные на основе экстрактов ткани тимуса: тактивин, тималин, тимоптин, тимактид и др. Из этих препаратов в хирургической практике наиболее часто используют тактивин, представляющий собой комплекс пептидов, экстрагированных из тимуса крупного рогатого скота [2]. Он является эффективным иммунокорригирующим средством, увеличиваеит число Т-лимфоцитов, которое, как правило, понижается при вторичных иммунодефицитных состояниях, усиливает их функциональную активность, определяемую по способности продуцировать цитокины, стимулирует активность естественных киллеров, стволовых гемопоэтических клеток и нормализует ряд других показателей, характеризующих напряженность Т-клеточного иммунитета [16].
Клиническая эффективность тимических препаратов первого поколения не вызывает сомнения. Но у них есть один недостаток: они представляют собой неразделенную смесь биологически активных пептидов и их достаточно трудно стандартизовать. Прогресс в области ИТЛС тимического происхождения шел по линии создания препаратов 2-го и 3-го поколения, представляющих собой синтетические аналоги естественных гормонов тимуса: альфа-один-тимозина и тимопоэтина или фрагментов этих гормонов, обладающих биологической активностью. Последнее направление оказалось наиболее продуктивным, особенно в отношении тимопоэтина. На основе одного из активных фрагментов, включающего аминокислотные остатки 32-36-тимопоэтина, создан препарат тимопентин, получивший на Западе разрешение на медицинское применение [25], и иммунофан [8], получивший разрешение на медицинское применение в России и представляющий собой синтетический гексапептид, аналог участка 32-36-тимопоэтина. Иммунофан выпускают в ампулах в виде 0,005% по 1 мл.
Изучение механизма действия показало [8], что иммунофан:
При проведении клинических испытаний иммунофан показал себя высоко эффективным средством в плане восстановления нарушенной иммунологической реактивности при хронических бактериальных и вирусных инфекциях, хирургических инфекциях, онкологических заболеваниях [8].
Его применение в комплексном лечении особенно тяжелых послеоперационных осложнений позволило существенно снизить летальность. Так, летальность у больных с нагноившейся гематомой печени, септической пневмонией и перитонитом, не получавших иммунофан, составила 100, 80 и 78%, при применении же в комплексном лечении этих больных иммунофана летальность составила 33, 33 и 50% соответственно. Как правило, у этих пациентов наблюдаются явления дезинтеграции всей иммунной системы. Она проявляется в понижении клеточного иммунитета (снижение всех популяций Т-лимфоцитов и их функциональной активности) и активации гуморального иммунитета (увеличение уровня IgG, IgM и циркулирующих иммунных комплексов) [9]. Применение иммунофана позволило быстро и эффективно нормализовать измененные параметры иммунологической реактивности.
Помимо стимуляции иммунологической реактивности иммунофан обладает выраженной способностью активировать антиоксидантную систему организма. Это проявляется в усилении активности каталазы и синтеза антиоксидантных белков — церулоплазмина и лактоферина. Эти два свойства имунофана позволили рекомендовать его в комплексной терапии онкологических больных не только для повышения иммунитета, но и для элиминации токсических свободнорадикальных и перекисных соединений. Его применение позволило существенно сократить лучевые реакции со стороны клеток белой крови и повысить их функциональную активность.
Как известно, ИТЛС редко используются в виде монотерапии. Основной их сферой применения являются вторичные иммунодефициты, при которых инфекционные агенты играют существенную роль в развитии заболевания. Поэтому в большинстве случаев для лечения этих иммунодефицитов применяются антибактериальные, противогрибковые и противовирусные препараты. Возникает вопрос, как и какие ИТЛС наиболее целесообразно применять в этих случаях? Здесь уместно напомнить, что в конечном итоге гибель большинства как внеклеточных, так и внутриклеточных микробов происходит в фагоцитарных клетках: нейтрофилах или макрофагах. Поэтому при лечении инфекционного компонента иммунодефицита целесообразно использовать те ИТЛС, которые усиливают функциональную активность фагоцитов. К ним относятся практически все основные современные препараты: ликопид, миелопид, полиоксидоний и др. Наиболее целесообразно при лечении инфекционного компонента иммунодефицита назначать ИТЛС одновременно с антибиотиками. При комплексном применении антибиотика и ИТЛС по возбудителю наносится двойной удар: антибиотик существенно подавляет функциональную активность возбудителя и делает его более чувствительным к киллерному эффекту фагоцита, а ИТЛС существенно стимулирует функциональную активность фагоцита, повышая его способность поглощать и убивать возбудителя. Аналогичная ситуация имеет место и при вирусной инфекции: ИТЛС (например, ликопид), повышая цитотоксические свойство макрофагов и NK- клеток, существенно усиливает их способность убивать вирусинфицированные клетки — главный путь диссеминации возбудителя в организме. Здесь также уместно сказать, что, помимо антибиотиков, ликопид хорошо взаимодействует и с препаратами интерферонового ряда и их индукторами. Нанесение тройного удара по возбудителю: противовирусное средство, ликопид и индуктор интерферона, по нашим наблюдениям, является исключительно эффективным при ряде хронических герпетических и цитомегаловирусных инфекциях.
Таким образом, главным принципом применения ИТЛС при лечении инфекционного компонента иммунодефицита является его одновременное назначение с антибактериальными средствами, что значительно повышает клинический эффект.
Суммируя представленный материал, следует отметить, что практически все ИТЛС, применявшиеся в лечебной практике, показали неплохой эффект в плане лечения и профилактики вторичных иммунодефицитов. Эра иммунокорригирующей терапии с помощью ИТЛС только началась, и широкое клиническое внедрение препаратов этого профиля в будущем позволит уточнить, дополнить и, может быть, значительно расширить (или ограничить) спектр их применения, схемы и дозировки. Как известно, практика — лучший критерий истины.
При применении ИТЛС с лечебной целью следует всегда помнить о двух правилах иммунокорригирующей терапии: она, как правило, входит в состав комплексного лечения и обязательным условием ее проведения является оценка иммунного статуса до и после лечения.
Наличие довольно большого числа ИТЛС не должно пугать практических врачей. Иммунная система состоит из ряда тесно связанных в функциональном плане компонентов, задача которых заключается в элиминации из организма чужеродных веществ антигенной природы. У каждого из компонентов этой системы могут быть свои относительно специфические агенты, модулирующие уровень их активности. В то же время следует помнить, что иммунная система работает по принципу системы мобилей [12]: активация одного из ее компонентов с помощью ИТЛС ведет к активации других участников системы, вследствие чего и получается положительный клинический эффект при использовании практически всех ИТЛС.