Что появилось раньше днк или рнк ответ поясните
Какая нуклеиновая кислота появилась раньше ДНК или РНК. Ответ поясните.
Считается, что РНК.
Концепция «Мир РНК»
Мир РНК — гипотетический этап возникновения жизни на Земле, когда как функцию хранения генетической информации, так и катализ химических реакций выполняли ансамбли молекул рибонуклеиновых кислот. Впоследствии из их ассоциаций возникла современная ДНК-РНК-белковая жизнь, обособленная мембраной от внешней среды. Идея мира РНК была впервые высказана Карлом Вёзе в 1968 году, позже развита Лесли Оргелом (en:Leslie Orgel) и окончательно сформулирована Уолтером Гильбертом в 1986 году.
В живых организмах практически все процессы происходят в основном благодаря ферментам белковой природы. Белки, однако, не могут самореплицироваться и синтезируются в клетке de novo на основании информации, заложенной в ДНК. Но и удвоение ДНК происходит только благодаря участию белков и РНК. Образуется замкнутый круг, из-за которого, в рамках теории самозарождения жизни приходилось признать необходимость не только абиогенного синтеза обоих классов молекул, но и спонтанного возникновения сложной системы их взаимосвязи, вероятность чего крайне низка.
В начале 1980-х годов в лаборатории Т. Чека и С. Олтмана в США была открыта каталитическая способность РНК. По аналогии с ферментами (англ. enzyme) РНК-катализаторы были названы рибозимами, за их открытие Томасу Чеку в 1989 году была присуждена Нобелевская премия по химии. Более того, оказалось, что активный центр рибосом содержит большое количество рРНК. Также РНК способны создавать двойную цепочку и самореплицироваться.
Таким образом, РНК могли существовать полностью автономно, катализируя «метаболические» реакции, например, синтеза новых рибонуклеотидов и самовоспроизводясь, сохраняя из «поколения» в «поколение» каталитические свойства. Накопление случайных мутаций привело к появлению РНК, катализирующих синтез определённых белков, являющихся более эффективным катализатором, в связи с чем эти мутации закреплялись в ходе естественного отбора. С другой стороны возникли специализированные хранилища генетической информации — ДНК. РНК сохранилось между ними как посредник.
Жизнь начиналась с РНК
Исследования нуклеиновых кислот являются одной из самых «горячих точек» в биологии. Благодаря уникальным свойствам РНК находят все более широкое применение в медицине и технике. Но знает об этом пока лишь узкий круг специалистов.
Рибонуклеиновой кислоте, иначе – РНК – не повезло. Она не пользуется такой широкой известностью, как ее близкий «родственник» – ДНК, несмотря на большое химическое сходство. Однако открытия последних двадцати лет радикально поменяли наши взгляды на роль и функции этих, как выяснилось, очень «умелых» молекул. Плодом этих открытий стала принципиально новая идея о том, что современной жизни предшествовал совершенно самодостаточный древний «мир РНК».
Как это обычно бывает, новое знание, расширяя горизонт, породило и массу новых вопросов. Каковы были механизмы «эволюции» в мире РНК? Зачем, откуда и как появились ДНК и белки? Как произошел переход от «мира РНК» к современному миру? О поисках, которые ведутся в этом направлении, читателям рассказывают академик Валентин Викторович Власов и его сын, кандидат химических наук, Александр Власов.
Почему в цикле статей, посвященных проблеме возникновения жизни, появляется статья об РНК, а не о других, более известных органических молекулах — ДНК или белках? Возможно, наши читатели слышали и об РНК, но вот что? Уверены, ничего примечательного — по одной простой причине: пока лишь специалисты-биологи знают, что именно РНК являются «волшебными» молекулами, давшими начало жизни. Что когда-то в древности, на только что остывшей Земле, возник и существовал загадочный «мир РНК»…
Прежде чем отправиться к «началу начал», давайте запасемся необходимыми знаниями о строении нуклеи-новых кислот — ДНК (дезоксирибонуклеиновой) и РНК (рибонуклеиновой). По своему химическому составу РНК является двойняшкой, хотя и не полным близнецом, ДНК, основного хранителя генетической информации в живой клетке. Нуклеиновые кислоты представляют собой полимерные макромолекулы, состоящие из отдельных звеньев — нуклеотидов. Скелетом макромолекулы являются молекулы пятиуглеродного сахара, соединенные остатками фосфорной кислоты. К каждой молекуле сахара присоединяется одно азотистое основание. Нуклеотиды, которые различаются между собою только разными азотистыми основаниями, обозначаются буквами A, U, G, C (в РНК) и A, T, G, C (в ДНК).
Честно говоря, насчет РНК никто не задумывался долгие годы. Существовала догма, что вот есть клетка, есть хромосомы, в которых есть ДНК — хранитель генетической информации.
В конце концов, на рибосомах синтезируются белки. А РНК — она где-то в промежутке, переносчик информации от ДНК — и только. А потом посыпались открытия, которые заставили совершенно по-другому взглянуть на РНК Главное отличие нуклеиновых кислот заключается в их углеводной компоненте. В РНК сахар — рибоза, а в ДНК — дезоксирибоза: там, где у ДНК имеется атом водорода (Н), у РНК стоит оксигруппа (ОН). Результаты таких незначительных, на неискушенный взгляд, различий поражают. Так, ДНК существуют в основном в форме всем известных жестких спиралей, в которых две цепи ДНК удерживаются вместе за счет образования водородных связей между комплементарными нуклеотидами.
РНК также могут формировать спирали из двух цепочек, похожие на спирали ДНК, однако в большинстве случаев РНК существуют в виде сложных структур-клубков. Структуры эти формируются не только за счет образования упомянутых водородных связей между разными участками РНК, но и благодаря оксигруппе рибозы, которая может образовывать дополнительные водородные связи и взаимодействовать с фосфорной кислотой и ионами металлов. Глобулярные структуры РНК не только внешне напоминают белковые структуры, но и приближаются к ним по свойствам: они могут взаимодействовать с самыми разными молекулами, как маленькими, так и полимерными.
Кого Считать «Живым»?
Почему же именно РНК мы называем праматерью ныне существующей жизни? Чтобы ответить на этот вопрос, давайте разберемся, где проходит граница между живым и неживым.
Поскольку над проблемой происхождения жизни работают ученые из разных областей, каждый оперирует терминами близкой ему науки. Химики обязательно вспомнят слово «катализатор», математики — «информация». Биологи будут считать живой систему, содержащую вещество (генетическую программу), которое может копироваться (или, по-простому, размножаться). При этом необходимо, чтобы в ходе такого копирования могли происходить некоторые изменения наследственной информации и возникать новые варианты систем, т. е. должна существовать возможность эволюции. Еще биологи обязательно заметят, что такие системы должны быть пространственно обособлены. Иначе возникшие более прогрессивные системы не смогут воспользоваться своими преимуществами, поскольку их более эффективные катализаторы и другие продукты будут беспрепятственно «уплывать» в окружающую среду.
Каким же образом первые молекулярные системы были обособлены от окружающей среды? Колонии молекул могли, например, удерживаться вместе за счет адсорбции на какой-нибудь минеральной поверхности или пылевых частицах. Однако возможно, что уже самые примитивные системы располагали, подобно современным живым клеткам, настоящей мембранной оболочкой. Дело в том, что такая «протоклетка» с липидной мембраной может образоваться очень просто. Многие молекулы с заряженными группами (например, жирные кислоты) в водной среде образуют микроскопические пузырьки — липосомы. Это слово должно быть хорошо известно прекрасной половине наших читателей: липосомы широко используются в косметических кремах — крохотные жировые капсулы начиняются витаминами и другими биологически активными веществами. А вот чем были наполнены древние «протоклетки»? Оказалось, что на роль «начинки» претендуют именно РНК.
РНК умеет все?
Жизнь, без сомнения, должна была начаться с образования «умелых» молекул, которые могли бы сами себя размножать и выполнять все другие «хозяйственные работы», необходимые для существования клетки. Однако на роль таких умельцев не подходит ни ДНК, ни белок. ДНК — отличный хранитель генетической информации, но сама себя размножать не умеет. Белки — непревзойденные катализаторы, но не могут работать в качестве «генетических программ». Возникает парадокс курицы и яйца: ДНК не может образоваться без белка, а белок — без ДНК. И только РНК, как выяснилось, может ВСЕ. Но не будем забегать вперед.
Рассмотрим давно известные функции РНК, связанные с работой (экспрессией) гена в клетке. При включении гена сначала происходит локальное расплетение ДНК и синтезируется РНК-копия генетической программы. В результате сложных обработок ее специальными белками получается матричная РНК (мРНК), которая и явля-ется программой для синтеза белка. Эта РНК переносится из ядра в цитоплазму клетки, где она связывается со специальными клеточными структурами — рибосомами, настоящими молекулярными «машинами» для синтеза белка. Белок синтезируется из активированных аминокислот, присоединенных к особым транспортным РНК (тРНК), причем каждая из аминокислот присоединена к своей специфической тРНК. Благодаря тРНК аминокислота фиксируется в каталитическом центре рибосомы, где она «пришивается» к синтезируемой белковой цепи. Из рассмотренной последовательности событий видно, что молекулы РНК играют ключевую роль в декодировании генетической информации и биосинтезе белка.
Чем больше углублялись в изучение различных биосинтетических процессов, тем чаще обнаруживали ранее неизвестные функции РНК. Оказалось, что кроме процесса транскрипции (синтеза РНК путем копирования участка ДНК) в ряде случаев, наоборот, может происходить синтез ДНК на РНК-матрицах. Этот процесс, названный обратной транскрипцией, используют в ходе своего развития многие вирусы, в том числе печально известные онкогенные вирусы и ВИЧ-1, вызывающий СПИД.
Таким образом, выяснилось, что поток генетической информации не является, как первоначально считалось, однонаправленным — от ДНК к РНК. Роль ДНК как изначально главного носителя генетической информации стала подвергаться сомнению. Тем более что многие вирусы (гриппа, клещевого энцефалита и другие) вообще не используют ДНК в качестве генетического материала, их геном построен исключительно из РНК. А далее посыпались одно за другим открытия, которые заставили совершенно по-другому взглянуть на РНК.
На Все «Молекулы» Мастер
Наиболее удивительным было открытие каталитической способности РНК. Прежде считалось, что катализировать реакции умеют только белки, ферменты. Ученые, например, никак не могли выделить ферменты, осуществляющие разрезание и сшивание некоторых РНК. После длительных исследований выяснилось, что РНК прекрасно справляются с этим сами. Структуры РНК, действующие подобно ферментам, назвали рибозимами (по аналогии с энзимами, белками-катализаторами). Вскоре было обнаружено множество разнообразных рибозимов. Особенно широко их используют для манипулирования своими РНК вирусы и другие простые инфекционные агенты. Таким образом, РНК оказались мастерами на все руки: они могут выступать в роли носителей наследственной информации, могут служить катализаторами, транспортными средствами для аминокислот, образовывать высокоспецифичные комплексы с белками.
Окончательная уверенность в том, что «мир РНК» действительно существовал, наступила после выявления деталей строения кристаллов рибосом методом рентгеноструктурного анализа. Ученые рассчитывали обнаружить там белок, катализирующий сшивание аминокислот в белковую последовательность. Каково же было их удивление, когда выяснилось, что в каталитическом центре рибосом белковых структур нет совсем, что он полностью построен из РНК! Оказалось, что все ключевые стадии биосинтеза белка осуществляются молекулами РНК. Точка в дискуссии о возможности существования «мира РНК» как особой стадии биологической эволюции была поставлена.
Конечно, полную картину еще предстоит реконструировать — осталось много нерешенных вопросов. Например, в современной клетке активацию аминокислот и их присоединение к соответствующим тРНК осуществляют специфичные белки-ферменты. Возникают вопросы: могла ли эта реакция осуществляться без участия белков, только с помощью РНК? Могли ли сами РНК катализировать синтез РНК из нуклеотидов или присоединение азотистых оснований к сахару? В общем-то, после открытия рибозимов такие потенциальные способности РНК уже не вызывали особых сомнений. Но наука требует, чтобы гипотезы экспериментально подтверждались.
Дарвиновская Эволюция в Пробирке
Хороший метод зачастую позволяет осуществить революцию в науке. Именно так можно сказать о методе полимеразной цепной реакции (ПЦР), который позволяет размножать нуклеиновые кислоты в неограниченных количествах. Кратко опишем суть метода. Для размножения ДНК в методе ПЦР используются ферменты ДНК- полимеразы, т. е. те самые ферменты, которые при размножении клеток синтезируют из активированных мономеров-нуклеотидов комплементарные цепочки ДНК.
При методе ПЦР в пробирку с ДНК вносят смесь активированных нуклеотидов, фермент ДНК-полимеразу и так называемые праймеры — олигонуклеотиды, комплементарные концам размножаемой ДНК. При нагревании раствора цепи ДНК расходятся. Затем, при охлаждении, с ними связываются праймеры, образуя короткие фрагменты спиральных структур. Фермент присоединяет к праймерам нуклеотиды и собирает цепочку, комплементарную цепочке исходной ДНК. В результате реакции из одной двуцепочечной ДНК получается две. Если повторить процесс, получится четыре цепочки, а после n повторений — 2 n молекул ДНК. Все очень просто.
Изобретение ПЦР и разработка методов химического синтеза ДНК позволили создать потрясающую технологию молекулярной селекции. Принцип молекулярной селекции тоже прост: сначала синтезируется множество молекул, обладающих разными свойствами (так называемая молекулярная библиотека), а затем из этой смеси отбираются молекулы с желаемым свойством.
Библиотеки нуклеиновых кислот — это смеси молекул, имеющих одинаковую длину, но отличающихся последовательностью нуклеотидов. Получить их можно в том случае, если при химическом синтезе на авто-матическом синтезаторе добавлять на каждой стадии удлинения нуклеотидной последовательности одно-временно все четыре нуклеотида. Каждый из них будет включаться в растущую нуклеиновую кислоту с равной вероятностью, в результате чего на каждом этапе присоединения будет получаться 4 варианта последовательностей. Если таким образом синтезировать нуклеиновую кислоту длиной в n звеньев, то разнообразие полученных молекул составит 4 в степени n. Поскольку обычно используются участки длиной 30—60 мономеров, то в результате синтеза получается от 4 30 до 4 60 разных молекул! Цифры, привычные разве что для астрономов.
Так как в зависимости от состава нуклеиновые кислоты сворачиваются в разные пространственные структуры, синтез статистических последовательностей дает огромное множество молекул, различающихся по свойствам. С образовавшихся ДНК — с помощью фермента РНК-полимеразы — считывается РНК. В результате получается библиотека уже одноцепочечных РНК. Далее производится процедура отбора: раствор РНК пропускается через колонку, в которой находится нерастворимый носитель с химически присоединенными молекулами-мишенями, чтобы «выловить» так называемый будущий аптамер, т. е. РНК, способную связывать определенные молекулы. Затем колонку промывают для удаления несвязавшихся РНК, а затем смывают РНК, задержавшиеся на колонке за счет связывания с целевыми молекулами (это можно сделать, например, нагревая колонку).
С выделенных РНК с помощью обратной транскрипции делают ДНК-копии и получают из них обычные двуцепочечные молекулы ДНК. С последних же можно считывать искомые РНК-аптамеры, а затем — размножать их методом ПЦР в неограниченных количествах. Конечно, так происходит в идеальном случае, на практике все получается сложнее. Обычно исходный препарат РНК содержит огромный избыток «по-сторонних» молекул, избавиться от которого трудно. Поэтому полученную РНК вновь и вновь пропускают через колонку, чтобы выделить РНК, образующие самые прочные комплексы с целевыми молекулами.
С помощью такого метода были получены тысячи разных РНК-аптамеров, которые образуют специфические комплексы с различными органическими соединениями и молекулами.
Рассмотренная схема молекулярной селекции может быть применена для получения молекул с любыми свойствами. Например, были получены РНК, способные катализировать реакции синтеза РНК и белков: присоединение азотистых оснований к рибозе, полимеризацию активированных нуклеотидов на цепочках РНК, присоединение аминокислот к РНК. Эти исследования еще раз подтвердили, что в условиях предбиологической эволюции из случайных полимеров могли возникать молекулы РНК
со специфическими структурами и функциями.
Делайте Ваш Заказ!
Метод молекулярной селекции обладает очень большими возможностями. С его помощью можно решать задачи поиска нужных молекул даже в том случае, если исходно нет идеи, как такие молекулы должны быть устроены. Однако, если придумать процедуру отбора, их можно выделить по принципу требуемых свойств, а затем уже заняться и вопросом, как эти свойства достигаются. Продемонстрируем это на примере выделения РНК, способных связываться с клеточными мембранами и модулировать их проницаемость.
Древние рибоциты должны были поглощать «питательные» вещества из окружающей среды, удалять продукты метаболизма и делиться в ходе размножения.
И все эти процессы требуют управления проницаемостью мембран. Поскольку мы полагаем, что никаких других функциональных молекул, кроме РНК, в рибоцитах не было, какие-то РНК обязательно должны были взаимодействовать с мембранами. Однако с химической точки зрения они совершенно не подходят для роли регуляторов проницаемости мембран.
Мембраны современных клеток и липосом, построенные из жирных кислот, несут отрицательный заряд. Поскольку РНК также заряжены отрицательно, то по закону Кулона они должны отталкиваться от липидной поверхности и тем более не могут проникать в глубь липидного слоя. Единственный известный способ взаимодействия нуклеиновых кислот с поверхностью мембран — через двухзарядные ионы металлов. Эти положительно заряженные ионы могут играть роль мостиков, располагаясь между отрицательно заряженными группами на поверхности мембраны и фосфатными группами нуклеиновой кислоты. Поскольку такие мостиковые взаимодействия достаточно слабые, с мембраной может связаться только очень большая нуклеиновая кислота благодаря множеству слабых связей с поверхностью мембраны. Так маленькие враги привязали Гулливера к земле множеством тоненьких веревок.
Тут и помог исследователям метод молекулярной селекции. Из библиотеки РНК удалось выделить не-сколько молекул, которые очень успешно связывались с мембранами, а при достаточно высокой концентрации — даже разрывали их! Эти РНК обладали необычными свойствами. Они как бы помогали друг другу: смесь молекул разных сортов связывалась с мембранами гораздо лучше, чем молекулы одного сорта. Все стало ясным после изучения вторичных структур этих РНК. Оказалось, что в них имеются петли с комплементарными участками. За счет этих участков «мембранные» РНК могут формировать комплексы-сообщества, которые способны образовывать множественные контакты с мембраной и делать то, что одной молекуле РНК не под силу.
Этот селекционный эксперимент подсказал, что у РНК есть дополнительный способ приобретения новых свойств путем образования сложных надмолекулярных комплексов. Этот механизм мог использоваться и для удерживания эволюционирующих систем РНК в виде колоний на поверхностях еще до того, как эти системы обзавелись изолирующей мембраной.
«Мир РНК»: Был, Есть и Будет!
Множество данных свидетельствует о том, что «мир РНК» действительно существовал. Правда, не совсем ясно — где. Некоторые специалисты полагают, что начальные этапы эволюции происходили не на Земле, что на Землю были занесены уже функционально активные системы, которые приспособились к местным условиям. Однако с химической
и биологической точки зрения это не меняет сути дела. В любом случае остается загадкой — в результате каких процессов в окружающей среде рибоциты образовались и за счет каких компонентов существовали. Ведь требуемые для жизни рибоцитов нуклеотиды — сложные молекулы. Трудно представить, что эти вещества могли образовываться в условиях пребиотического синтеза.
Вполне возможно, что древние РНК значительно отличались от современных. К сожалению, следов этих древних РНК экспериментально обнаружить нельзя, речь идет о временах, удаленных от нас на миллиарды лет. Даже скалы тех времен давно «рассыпались в песок». Поэтому речь может идти только об экспериментальном моделировании процессов, которые могли протекать на самых ранних стадиях молекулярной эволюции.
Почему произошел переход от «мира РНК» к современному миру? Белки, располагающие гораздо большим набором химических групп, чем РНК, являются лучшими катализаторами и структурными элементами. По-видимому, некоторые древние РНК стали использовать белковые молекулы в качестве «орудий труда». Такие РНК, способные к тому же синтезировать для своих целей полезные молекулы из окружающей среды, получали преимущества в размножении. Естественным путем отбирались соответствующие аптамеры и рибозимы.
А затем эволюция сделала свое дело: возник аппарат трансляции, и постепенно ответственность за катализ перешла к белкам. Орудия оказались столь удобными, что вытеснили своих «хозяев» из многих сфер деятельности.
Читатель вправе спросить: а зачем вообще нужно исследовать эволюцию РНК, ведь древний «мир РНК» исчез? Неужели только ради «чистого искусства», удовлетворения интересов фанатичных исследователей? Однако, не зная прошлого, нельзя понять настоящее. Изучение эволюции и возможностей РНК может подсказать новые направления поиска процессов, протекающих в современных живых клетках. Например, совсем недавно были обнаружены мощные системы регуляции активности генов с участием двуцепочечных РНК, с помощью которых клетка защищает себя от вирусных инфекций. Эта древняя система клеточной защиты, вероятно, скоро найдет применение в терапии.
Поэтому неудивительно, что в наше время исследования нуклеиновых кислот продолжают оставаться одной из самых «горячих точек» в молекулярной биологии. Благодаря уникальным свойствам РНК находят все более широкое применение в медицине и технике. Возникший в незапамятные времена «мир РНК» будет не только продолжать незримо существовать
в наших клетках, но и возрождаться в виде новых биотехнологий.
Редакция благодарит сотрудников Института химической биологии и фундаментальной медицины
СО РАН к. х. н. В. В. Коваля, к. х. н. С. Д. Мызину и к. х. н. А. А. Бондаря за помощь в подготовке статьи
РНК у истоков жизни?
РНК у истоков жизни?
Сторонники теории мира РНК утверждают, что жизнь на нашей планете началась с рибозимов — молекул РНК, способных к катализу без участия белковых ферментов. На рисунке — один из таких рибозимов, обладающих рибонуклеазной активностью.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Идея того, что жизнь могла возникнуть на основе самореплицирующихся молекул РНК, уже не нова. В самом деле, РНК совмещает в себе как функцию хранения наследственной информации, так и способность к биохимическому катализу. Сейчас гипотеза РНК-мира из чисто умозрительной теории превратилась в теоретическую модель, имеющую хорошую доказательную и экспериментальную базу. Безусловно, эта теория вызывает много вопросов, но, тем не менее, она по полному праву может быть названа одной из наиболее обоснованных гипотез возникновения жизни на Земле.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Противоречия гипотезы мира РНК
Идея мира РНК была высказана в 1968 году Карлом Вёзе [1], а окончательно сформулирована в 1986 году нобелевским лауреатом Уолтером Гильбертом. То, что РНК способна как хранить наследственную информацию, так и выполнять работу (например, при биосинтезе белка), было известно и ранее. Но окончательно гипотеза мира РНК смогла сформироваться лишь после открытия в 1981 году рибосомальной РНК из ресничного простейшего Tetrahymena, которая способна к автосплайсингу. Осуществляется это следующим образом: к интронной последовательности РНК прикрепляется нуклеотид G, далее цепь разрезается в месте присоединения нуклеотида. После этого происходит окончательное вырезание интрона и сшивание экзонов. Более того, эта интронная последовательность обладает рибонуклеазной активностью, т.е. она способна связываться с субстратной РНК и специфично разрезать её. Такие свойства рибонуклеиновому интрону придаёт его способность к образованию сложных трёхмерных структур.
Однако платой за высокую лабильность РНК служит её склонность к быстрой деградации. Здесь мы и сталкиваемся с первой трудностью концепции РНК-мира. Как молекула может служить надёжным хранилищем генетической информации, если время её жизни мало?
У млекопитающих время жизни мРНК в клетках составляет от нескольких минут до нескольких часов, максимум дней. У бактерий и вовсе, мРНК «живёт» от нескольких секунд до часа с небольшим. Согласитесь, недолго для надёжного хранилища информации! Тем более, в пребиотических условиях, агрессивная среда которых мало способствовала стабильности молекул.
Это противоречие способны разрешить некоторые предположения. Считается, что первые РНК могли размножаться в микрополостях во льду. В подтверждение этому, по данным ряда экспериментов, максимальная рибозимная активность РНК наблюдается при температуре около −8 °С. Возможно, это связано с тем, что при подобных температурах увеличивается концентрация РНК и понижается активность воды. Однако вероятная сложность здесь заключается в том, что РНК при низких температурах обретают повышенную склонность к образованию водородных связей между комплементарным нуклеотидами, что ведёт к образованию межмолекулярных комплексов и снижению каталитической активности [2].
Следующей большой трудностью является склонность РНК к гидролизу при pH>6. Фосфодиэфирные связи между нуклеотидами наиболее стабильны при рН, лежащих в пределах 4–5.
Также двоякую роль играют и ионы Mg 2+ : с одной стороны, они стабилизируют вторичную и третичную структуры РНК (что критично для способности к катализу), с другой же, их высокая концентрация способствует деградации молекул. Выше упоминалось, что молекулы РНК наиболее стабильны в кислой среде. В этих условиях цитозин и аденозин протонируются, тем самым обретая дополнительный положительный заряд, что снижает потребность в катионах. К примеру, при рН=4 некоторые рибозимы сохраняют свою активность даже в отсутствие ионов [2].
РНК является весьма сложной молекулой, и вероятность её внезапного возникновения из отдельных атомов или фрагментов крайне низка. Действительно, сложно себе представить, как могли соединиться вместе азотистое основание, рибоза и фосфат, образовав нуклеотид. Однако Санчез, Оргел, Паунер и Сазердэнд показали возможность синтеза пиримидинов из молекул, вероятно, имевшихся в пребиотических условиях Земли [3].
Также важно понять, каким образом осуществлялась полимеризация первых нуклеотидов в полимерные цепочки. Относительна недавно была обнаружена важная роль различных минералов и ионов металлов в катализе при образовании биополимеров [4]. К примеру, монтмориллонит катализирует полимеризацию нуклеотидов, 5′-фосфат которых ранее был активирован имидазолом. Более того, монтмориллонит способен образовывать везикулы из простых жирных кислот [4]. Таким образом, этот минерал, с одной стороны, способствует полимеризации нуклеотидов, а с другой — образованию мембранных структур.
Гипотетически, существует множество вариантов соединения рибонуклеотидов друг с другом через различные атомы рибозы. Однако в живых организмах нуклеотиды соединены друг с другом через 3′,5′-фосфодиэфирную связь (за некоторыми исключения: например, кэп в мРНК эукариот присоединяется через 5′,5′-связь). Недавние исследования Шостака показали, что рибозимы, имеющие в своём составе нуклеотиды, соединённые как через 3′,5′-связь, так и через 2’,5′-связь, частично сохраняли каталитические свойства [5]. Вероятно, в первых рибонуклеиновых полимерах могли реализовываться различные варианты фосфодиэфирной связи, однако эволюцией была отобрана именно 3′,5′-связь.
Зачастую каталитической активностью обладают лишь длинные цепочки РНК. Это один из основных объектов критики теории РНК-мира, ибо случайное возникновение длинных последовательностей, способных выполнять биохимическую работу, весьма маловероятно. Одна из лучших рибозимных репликаз, созданных на сегодня, способна реплицировать до 95 нуклеотидов [6], однако сама она при этом имеет длину в 190 нуклеотидов (см. врезку). Длина этой последовательности слишком велика для спонтанного возникновения в пребиотических условиях. Исследования in vitro показывают, что для выделения молекул, способных к катализу, требуется около 10 13 —10 14 молекул РНК [2] — довольно много для того, чтобы столь длинный рибозим мог появиться в готовом виде. Однако открытие коротких рибозимов ставит под сомнение идею того, что для появления РНК-катлизаторов требуются астрономические количества молекул. В самом деле, получены полирибонуклеотиды c активными дуплексами, способными к самовырезанию, имеющие длину лишь 7 остатков [2]. Более того, были получены данные, что даже рибозим, урезанный всего лишь до пяти нуклеотидов, сохранял свои ферментативные способности [2]. Но каталитическая активность у минирибозимов значительно ниже, чем у их более длинных «собратьев». Из этого следует, что короткие рибозимы могли быть эволюционными предшественниками длинных. Со временем они приобрели бóльшую длину, которая способствовала обретению более правильной структуры и, как следствие, улучшению каталитических свойств.
Рибозимные репликазы
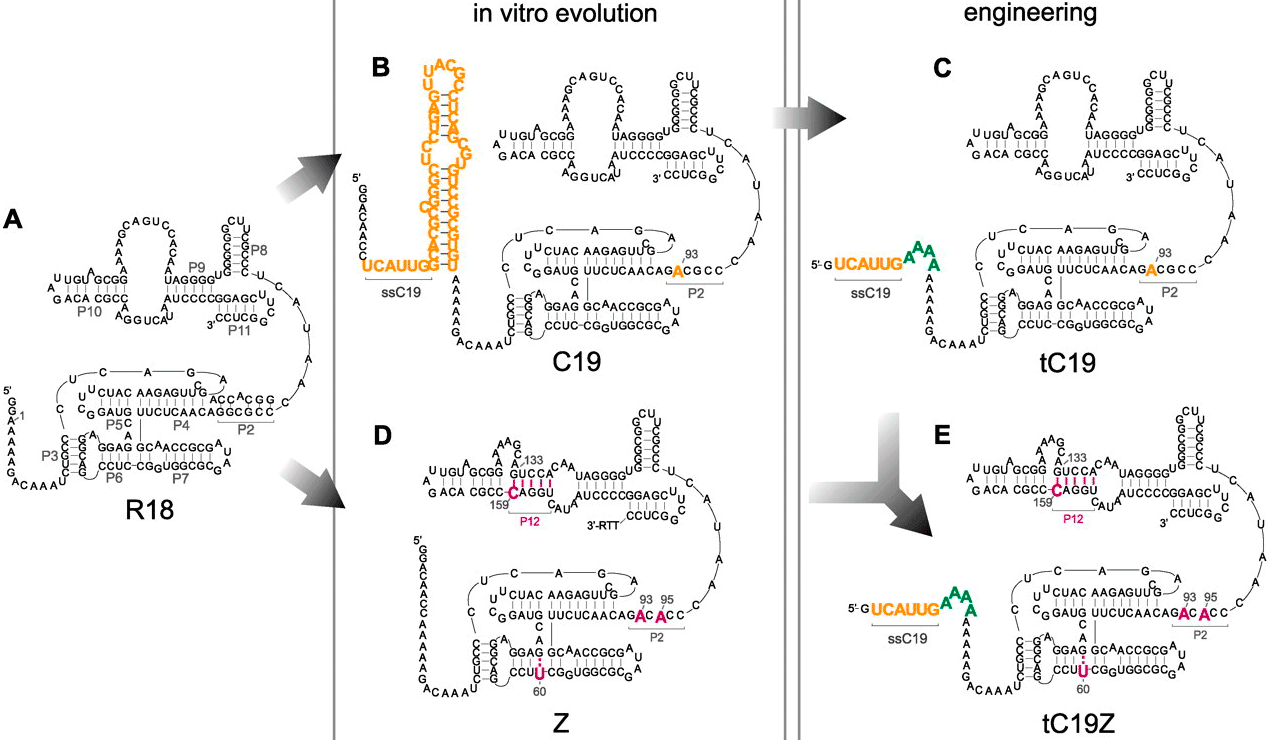
Для того, чтобы в мире РНК полирибонуклеотиды могли размножаться, должны были существовать рибозимные аналоги белковых полимераз. В современных живых организмах рибозимы с таким видом активности не обнаружены, однако подобные молекулы были созданы искусственно. Молекулярные биологи из Великобритании обратили внимание на ранее известный рибозим R18, обладающий полимеразной активностью [6]. Он и стал объектом эксперимента: путём искусственной эволюции и разумного планирования из исходного рибозима были получены четыре новые молекулы с улучшенными каталитическими свойствами [7]. Дело в том, что исходный рибозим R18 (обозначен на картинке буквой А) был способен реплицировать лишь фрагменты РНК длиной до 20 нуклеотидов. Также им могла быть реплицирована далеко не каждая последовательность РНК, а лишь узкий круг определённых матриц [7]. Учёные пошли двумя путями:
В результате, полезные свойства рибозимов tC19 и Z удалось объединить в одном, названном tC19Z. Данный рибозим способен копировать как довольно широкий круг матриц, так и достаточно длинные последовательности [7].
Интроны, способные вырезаться самостоятельно, были обнаружены в тирозиновой тРНК таких сложных организмов, как человек и цветковое двудольное растение Arabidopsis thaliana. Эти 12-ти и 20-ти нуклеотидные участки в клетке вырезаются путём сплайсинга с участием белков, однако этот интрон показал способность вырезать самого себя и без участия ферментов.
РНК-переключатели
Ограниченная каталитическая способность рибозимов часто становится ещё одним хлипким краеугольным камнем теории мира РНК. Критики теории считают, что тот минимум химических реакций, который необходим для осуществления метаболизма в мире РНК, не может быть обеспечен одними лишь рибозимами. Подавляющее большинство РНК-катализаторов катализируют лишь разрыв и создание фософодиэфирных связей между нуклеотидами. Кажется, что молекулы РНК со своими четырьмя весьма схожими мономерами безнадёжно проигрывают в химическом разнообразии белкам, которые имеют в своём составе 20 аминокислот, весьма различных по свойствам. Однако не стоит забывать, что многие белковые ферменты для выполнения активной работы должны присоединить лиганды — кофакторы, — без которых ферментативная активность попросту исчезает.
И здесь стоит вспомнить об РНК-перключателях или рибопереключателях (англ. riboswitches). Что же это такое? Как известно, информация об аминокислотной последовательности белка передаётся в рибосому через мРНК. Матричная РНК транскрибируется с ДНК посредством фермента ДНК-полимераза II. В данном случае, помимо самого гена, транскрибируется участок впереди него, на котором и расположен рибоперключатель [8]. РНК-переключатель представляет собой участок мРНК, способный связывать молекулу строго определённого вещества. После связывания переключатель меняет свою пространственную конфигурацию, что делает невозможной дальнейшую транскрипцию [8].
Важно понимать принцип работы РНК-переключателей, поэтому скажем пару слов об их устройстве. Состоит он из двух частей: из аптамера и «экспрессионной платформы». Аптамер, по сути, является рецептором, который с очень высокой селективностью связывается с определённой молекулой. Эффекторной молекулой для аптамера является молекула, производимая белком, ген которого и регулируется переключателем. «Экспрессионная платформа» и есть сам РНК-переключатель, который после связывания рецептора с лигандом меняют конфигурацию и препятствует дальнейшей транскрипции.
Однако существуют и РНК-переключатели, действующие по более сложному механизму. Например, рибопереключатель, контролирующий транскрипцию гена metE бактерии Bacillus clausii, является двойным, т.е. имеет два рецепторных участка, связывающих две разных молекулы [9]. Разберём данный механизм подробнее.
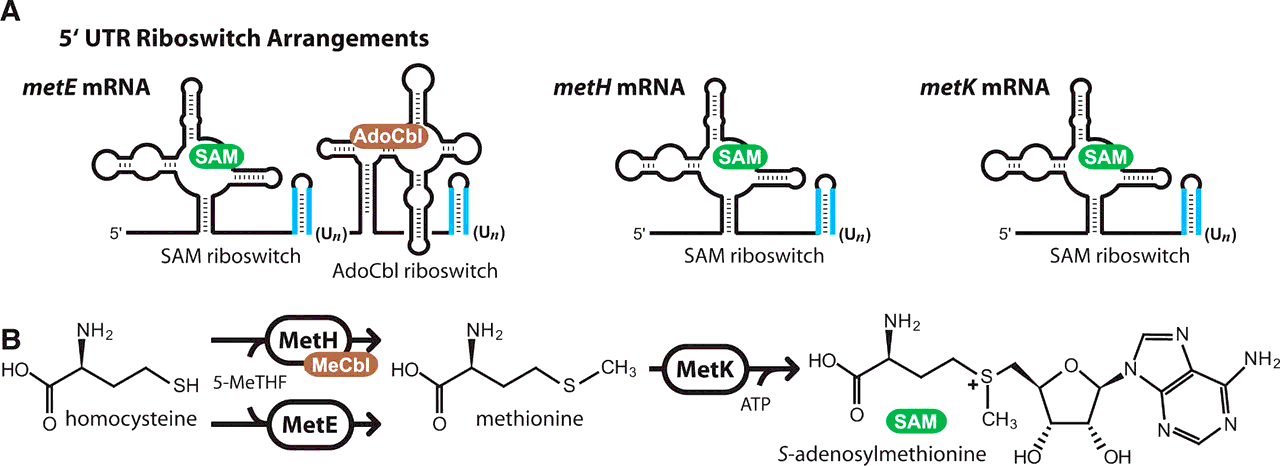
Ген metE кодирует фермент, превращающий гомоцистеин в аминокислоту метионин. Затем метионин используется (уже другим ферментом) для синтеза S-аденозилметионина (или проще — SAM). Помимо гена metE, существует и другой ген — metН. Белок гена metН катализирует ту же реакцию, но с большей эффективностью, чем metE. Однако metН для своей работы требует кофермент — метилкобаламин (или MeCbl), синтезируемый из аденозилкобаламина (или AdoCbl). Так вот, транскрипт metE имеет РНК-переключатель, который содержит два связывающих участка: один для SAM, другой — для AdoCbl. Данный переключатель способен действовать как логический элемент NOR (и/или) [9]. То есть, для выключения metE достаточно связывания с рецепторами рибопереключателя либо одной из эффекторных молекул, либо сразу обеих. Сам механизм прерывания трансляции основан на образовании шпильки путём удаления шести нуклеотидов из рибопереключателя (рис. 1А). Логику действий такого элемента NOR можно описать так: «Я подавляю транскрипцию, если в среде присутствует либо вещество А, либо вещество В, либо оба вещества сразу». Остаётся только удивляться, сколь красивы и элегантны решения Природы!
Рисунок 1. Работа рибопереключателей. А — Рибопереключатели на транскриптах генов metE, metH и metK. Голубым обозначены шпилечные структуры, образуемые в результате вырезания шести или более уридиновых нуклеотидов. Видно, что у metE имеется два акцепторных и два шпилечных участка. В — Путь биосинтеза S-аденозилметионина. На первом этапе гомоцистеин преобразуется в амикислоту метионин. Это превращение может быть катализировано одним из двух ферментов: metE или metH. metH проводит эту реакцию с большей эффективностью, однако требует для своей работы дополнительного вещества (кофактора). На втором этапе фермент metK превращает метионин в S-аденозилметионин.
Между тем, РНК-переключатели способны связывать значительное число белковых кофакторов, таких как флавинмононуклеотид, тиаминпирофосфат, тетрагидрофолат, S-аденозилметионин, аденозилкобаламин [8]. Изначально считалось, что РНК-переключатели способны лишь подавлять экспрессию генов [8], но позже были получены данные, свидетельствующие о том, что некоторые переключатели, напротив, ее усиливают. Сами по себе РНК-переключатели представляют весьма интересное явление, так как они демонстрируют возможность регуляции работы генов без прямого участия белков — иными словами, демонстрирует самодостаточность и универсальность РНК. Судя по всему, РНК-переключатели являются очень древним механизмом: так, они обнаружены во всех доменах живой природы: у бактерий, архей и эукариот [8]. Похоже, что, по меньшей мере, некоторые из современных кофакторов белков были прямиком заимствованы из мира РНК. Можно нарисовать примерно такую картину: рибозимы изначально использовали многие из современных кофаторов для своих целей, однако с появлением более эффективных белковых ферментов эти кофакторы были заимствованы последними.
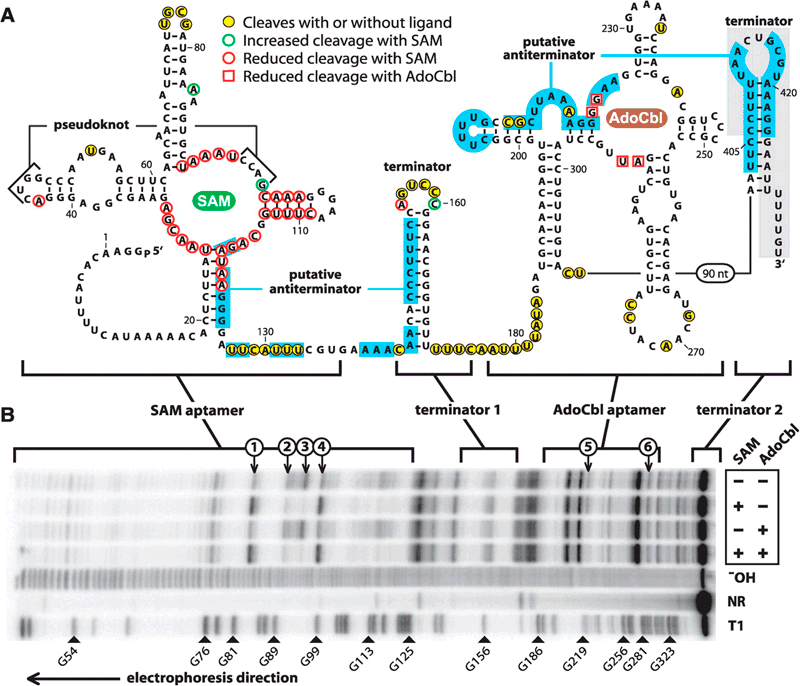
Рисунок 2. Вторичная структура РНК-переключателя гена metE. Выделены акцепторы — сайты связывания с молекулами SAM и AdoCbl, а также шпилечные терминирующие структуры.
Геномные тэги и тРНК
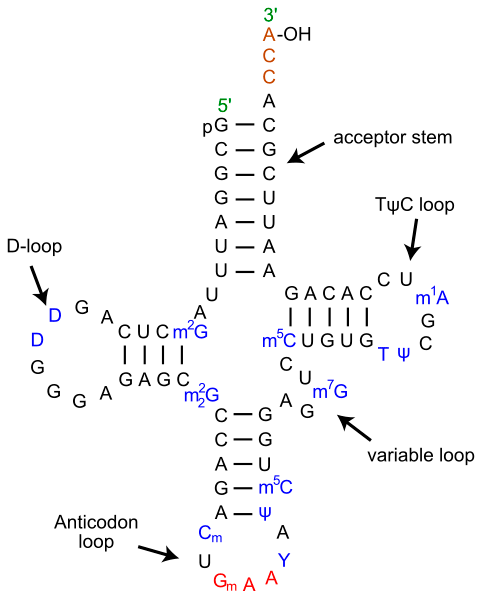
Рисунок 3. Вторичная структура тРНК. На рисунке отчётливо видна характерная для тРНК вторичная структура в виде «клеверного листа». В верхней половине молекулы на 3′-конце расположена CCA-область и акцепторная петля, связывающая аминокислоту. В нижней части молекулы находится антикодоновая петля, ответственная за комплементарное связывание с кодоном мРНК. Согласно гипотезе геномного тэга, верхняя и нижняя половины тРНК эволюционировали по отдельности, причём верхняя половина древнее нижней.
Всем хорошо известна важная роль тРНК в биосинтезе белка. Однако у тРНК и подобных ей молекул есть другая, менее известная, но не менее важная функция: в различных репликативных процессах они исполняют роль праймеров и шаблонов. Это могут быть процессы репликации одноцепочечной вирусной РНК, репликация митохондриальной ДНК у грибов, репликации теломер [10].
Обратимся к вирусной РНК. 3′-конец многих бактериальных вирусов и вирусов растений структурно очень похож на «верхнюю половину» современной тРНК (та часть молекулы, которая связывается с аминокислотой; рис. 3). Подобные участки, расположенные на 3′-концах, названы «геномными тэгами» [10]. Тэг играет роль шаблона при инициации репликации вирусной РНК. Более того, эти участки бывают настолько похожи на «настоящие» тРНК [10], что могут быть аминоацилированы (т.е. к ним может быть присоединена аминокислота) при помощи фермента аминоацил-тРНК-синтетазы.
Также репликация многих РНК у ретровирусов начинается с того, что к сайту связывания праймера на вирусной РНК присоединяется тРНК хозяйского организма [9]. Тем самым видно, что тРНК современных организмов способны также служить и праймерами. Затем, используя тРНК как праймер, обратная транскриптаза копирует вирусный РНК-геном в ДНК.
Возможно ли, что тРНК сегодняшних организмов произошли от древних геномных тэгов? Алан Вейнер и Нэнси Мэйцелс [10] отвечают на этот вопрос утвердительно. Согласно их теории, верхняя и нижняя половинки тРНК эволюционировали по-отдельности, причём верхняя часть тРНК появилась раньше нижней и является потомком геномных тэгов [10].
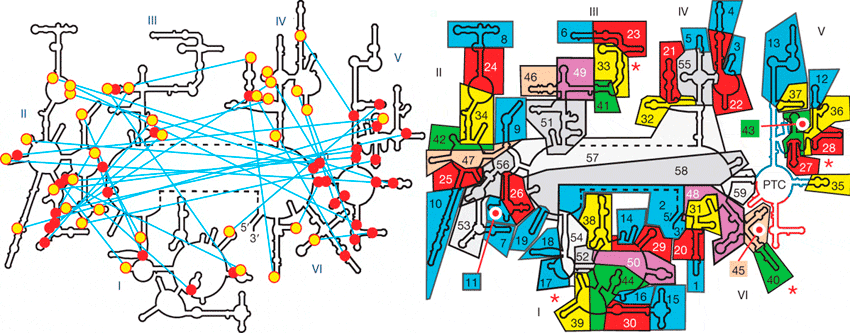
Происхождение рибосом
При построении гипотезы мира РНК много внимания уделяется и происхождению рибосом, потому что их образование фактически можно приравнять к переходу от РНК-катализа к белковому процессу. Как известно, рибосома состоит из двух субъединиц: малой и большой. Ключевую роль в синтезе белковой цепи играет большая субъединица рибосомы, в то время как маленькая считывает мРНК. Модель происхождения одной из молекул большой субъединицы была предложена канадскими биохимиками Константином Боковым и Сергеем Штейнбергом [11].
Они сосредоточили внимание на 23s-рРНК (состоящей из шести доменов, I–VI), так как именно в этой молекуле находится функциональный центр, ответственный за реакцию транспептидации (присоединение новой аминокислоты к растущей полипептидной цепи). Данная молекула содержит около трёх тысяч нуклеотидов и способна образовывать сложные трёхмерные структуры. Важную роль в поддержании трёхмерной структуры молекулы играют так называемые А-минорные связи [11]. Они представляют собой связи между «стопками» нуклеотидов (как правило, аденозинов [11]) с участками, образующими двойные спирали. Связи формируются между спиралями и стопками, расположенными в разных областях молекулы.
23s-рРНК слишком сложна, чтобы она могла появиться сразу в готовом виде [12]. Соответственно, в молекуле должна присутствовать некая более простая структура, с которой и началась её эволюция. Особое внимание исследователей привлёк домен V [11]. Интересным в нём было то, что он содержит большое количество двойных спиралей при фактически полном отсутствии аденозиновых стопок. Вот что пишут по этому поводу авторы исследования: «Чтобы объяснить аномалию, имеющую место в домене V, мы предположили, что это отражает порядок, в котором различные части присоединялись к 23s-рРНК по мере её эволюции. В А-минорных мотивах конформационная стабильность аденозиновых стопок зависит от присутствия двойных спиралей, в то время как двойные спирали способны сохранять стабильную структуру сами по себе» [11]. Из этого следует, что домен V является наиболее древней частью молекулы: его спиральные участки, что придают стабильность всей молекуле, должны были появиться раньше других частей, содержащих аденозиновые стопки. Более того, именно в пятом домене находится функциональный центр, ответственный за формирование пептидной связи в процессе биосинтеза белка.
Выходит, что пятый домен является и функциональным центром молекулы, и её структурным остовом. Это говорит о том, что эволюция 23s-рРНК началась именно с него. Далее авторы попытались реконструировать эволюцию 23s-рРНК. Для этого они разбили молекулу на 60 относительно небольших участков и попытались «разобрать» её так, чтобы, убирая части поэтапно, не повредить структуру оставшейся молекулы. Опустив детали, укажем, что вывод был именно такой: эволюция этой молекулы началась именно с пептидил-трансферазного центра пятого домена, так как при разборке он оставался последним неповреждённым участком (см. рис. 4). Исследователи считают, что именно эта структура и является древней «проторибосомой». Способна ли эта маленькая часть огромной молекулы выполнять свою работу самостоятельно? Исследования дают положительный ответ. В ходе экспериментов были получены искусственно выведенные рибозимы, способные осуществлять реакцию транспептидации [12].
Рисунок 4. Эволюция «проторибосомы». Слева — Вторичная структура 23s-рРНК. Красные кружочки изображают спиральные участки, жёлтые — аденозиновые «стопки». Голубые линии показывают А-минорные связи. Римские цифры обозначают домены молекулы. Отчётливо видно, что наибольшее количество спиральных участков находится в домене V. Справа — Для того чтобы выяснить процесс эволюции 23s-рРНК, авторы разбили молекулу на 60 структурных блоков. Далее они попытались «разобрать» молекулу так, чтобы при последовательном удалении этих блоков молекула продолжала работать [12]. Сначала они отделили 19 блоков, не повредив при этом оставшиеся. После удалось отделить ещё 11 блоков, а затем ещё последовательно 9, 5, 3, 3, 2, 2, 2. Затем ещё три блока оказалось возможным отделить по одному [12].
По всей видимости, именно пятый домен послужил «стартовой точкой» в эволюции 23s-рРНК. Позже к нему начали добавляться различные блоки, улучшающие работы молекулы. Изначально к проторибосоме присоединилось восемь блоков, образовавших «основание», что повлекло за собой увеличение стабильности всей молекулы. Затем добавились следующие 12 блоков, которые образовали структуры, позволяющие соединяться большой и малой субъединицам друг с другом. Последними добавились блоки, образующие т.н. «протуберанцы» — выросты на поверхности большой субъединицы [12]. Функция этих выростов в том, чтобы помочь рибосоме выбрать нужную аминоацил-тРНК, а также «выпустить на волю» ту тРНК, которая уже отдала свою аминокислоту растущей белковой молекуле.
Следы мира РНК
Наследие мира РНК можно обнаружить в любом живом организме. Вспомним рибосомы, которые, по всей видимости, являются реликтами очень давней эпохи, ведь структурно и функционально рибосомы крайне схожи и у человека, и у дождевого червя, и у кишечной палочки. Главный переносчик энергии в клетке — молекула аденозинтрифосфата — представляет собой не что иное, как аденозин с двумя дополнительными фосфатами. Такие важнейшие молекулы, как переносчики электронов ФАД и НАД также являются модифицированными нуклеотидами. Конечно, гипотеза мира РНК ещё не доказана, да и нет гарантий, что когда-нибудь это случится. Но факт того, что важнейшие процессы в клетке протекают при активном участии РНК и рибонуклеотидов, может служить веским доводом в пользу истинности этой теории.