Что преобладает в мочевом синдроме у больных огней
Что преобладает в мочевом синдроме у больных огней
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Министерства здравоохранения России, Москва
Московский областной НИИ акушерства и гинекологии
ГБУЗ МО «Московский областной НИИ акушерства и гинекологии»
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
Генитоуринарный менопаузальный синдром: диагностика и принципы лечения (краткие клинические рекомендации)
Журнал: Российский вестник акушера-гинеколога. 2017;17(6): 89-95
Ермакова Е. И., Балан В. Е., Тихомирова Е. В., Лазарева И. Н., Лапина А. В., Панина Е. М. Генитоуринарный менопаузальный синдром: диагностика и принципы лечения (краткие клинические рекомендации). Российский вестник акушера-гинеколога. 2017;17(6):89-95.
Ermakova E I, Balan V E, Tikhomirova E V, Lazareva I N, Lapina A V, Panina E M. Genitourinary syndrome of menopause: diagnosis and principles of treatment (brief clinical recommendations). Russian Bulletin of Obstetrician-Gynecologist. 2017;17(6):89-95.
https://doi.org/10.17116/rosakush201717689-95
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Министерства здравоохранения России, Москва
Цель исследования — представление базовых клинических научных данных, основанных на современных доказательствах анатомо-физиологических изменений в урогенитальном тракте у женщин в пери- и постменопаузе, и принципов ведения пациенток с генитоуринарным менопаузальным синдромом. На основании анализа опубликованных работ отечественных и зарубежных авторов в настоящих клинических рекомендациях приведены современная терминология урогенитальных нарушений у женщин пери- и постменопаузального возраста, данные об этиопатогенезе, клинических проявлениях, диагностике и методах лечения пациенток с генитоуринарным менопаузальным синдромом — вульво-вагинальной атрофией и нарушениями мочеиспускания. Предложены меры профилактики данного заболевания.
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Министерства здравоохранения России, Москва
Московский областной НИИ акушерства и гинекологии
ГБУЗ МО «Московский областной НИИ акушерства и гинекологии»
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
Одной из актуальных проблем в гинекологии, резко снижающей качество жизни у женщин в климактерии, является синдром вульвовагинальной атрофии (ВВА).
В отличие от вазомоторных симптомов, которые проходят со временем, симптомы ВВА, как правило, возникают в перименопаузе и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям [1].
У 15% женщин в перименопаузе и 40—57% женщин в постменопаузе отмечаются симптомы ВВА, такие как сухость влагалища (27—55%), жжение и зуд (18%), диспареуния (33—41%), а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза 6—8%, что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [1—3]. У 41% женщин в возрасте 50—79 лет есть хотя бы один из симптомов ВВА [4].
Слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базального, парабазального (или митотически активного), промежуточного гликогенсодержащего и поверхностного (слущивающегося) [5]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [6]. Митотическая активность базального и парабазального слоев эпителия влагалищной стенки блокируется при дефиците половых стероидов. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена, являющегося питательной средой для лактобактерий. Это ведет к полной элиминации из влагалищного биотопа его основного компонента — лактобацилл [7, 8].
Перекись-продуцирующие лактобациллы, преобладающие в микробиоценозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется и в последующем инфицируется не только патогенными, но и условно-патогенными микроорганизмами [9, 10].
Физические признаки атрофии слизистой оболочки вульвы и влагалища включают истончение эпителия, уменьшение складчатости влагалища, побледнение, наличие петехиальных кровоизлияний, признаков воспаления. Происходят потеря упругости тканей, подкожной жировой клетчатки и выпадение лобковых волос, снижается секреторная активность бартолиниевых желез [11—13].
Ввиду единого эмбрионального происхождения структур мочевой и половой систем, а также наличия рецепторов к половым стероидам во всех структурах урогенитального тракта патологические изменения в пери- и постменопаузе развиваются в уретре, мочевом пузыре, мышцах и связках малого таза, что выражается в возникновении недержания мочи в покое и при напряжении, частых, болезненных мочеиспусканий и рецидивирующих инфекций мочевыводящих путей [14, 15]. Однако термин «вульвовагинальная атрофия» не охватывает данные изменения. Тем не менее распространенность нарушений мочеиспускания у женщин в пери- и постменопаузе достаточна высока. C. Hampel и соавт. [16], изучив данные 21 эпидемиологического исследования, проведенного в разных странах мира, сообщили, что в группе женщин в возрасте от 30 до 60 лет распространенность недержания мочи составила 21,5%, а в группе женщин старше 60 лет — 44%. Большинство женщин с нарушениями мочеиспускания старше 45 лет указывают на совпадение начала заболевания с наступлением менопаузы. Прослеживается возрастание распространенности симптомокомплекса с увеличением длительности постменопаузы с 15,5% при продолжительности постменопаузы до 5 лет до 71,4% при длительности постменопаузы более 20 лет.
Вызывает споры, что термин «атрофический вагинит» подразумевает наличие воспаления. Однако в работах, посвященных проблеме ВВА, не выявлено массивной колонизации влагалища условно-патогенными микроорганизмами (УПМ), в частности энтерококками, стрептококками, кишечными палочками, и количество лейкоцитов не превышало 10 в поле зрения, что может свидетельствовать об отсутствии воспалительной реакции во влагалище. К тому же термин «атрофия» вызывает негативное отношение у женщин старшего возраста [17]. Учитывая изложенное, в ходе специальной консенсусной конференции еще в 2012 г. эксперты Международного общества по изучению женского сексуального здоровья (International (Society for the Study of Women’s Sexual Health (ISSWSH)) и Североамериканское сообщество по менопаузе (North American Menopause Society — NAMS) предложили заменить используемый в настоящее время термин «вульвовагинальная атрофия» на термин «genitourinary syndrome of menopause» (GSM) — «генитоуринарный менопаузальный синдром» (ГУМС). По их мнению, он является с медицинской точки зрения более точным, всеобъемлющим и приемлемым для клиницистов, исследователей, преподавателей, пациенток и СМИ. Комиссии NAMS и ISSWSH формально уже утвердили новую терминологию в 2014 г. Термин GSM будет представлен и обсужден на годовых собраниях обществ, посвященных здоровью женщин [14].
Генитоуринарный менопаузальный синдром (ГУМС) — симптомокомплекс, ассоциированный со снижением содержания эстрогенов и других половых стероидов, включающий изменения, возникающие в наружных половых органах, промежности, влагалище, уретре и мочевом пузыре. Урогенитальные симптомы, обусловленные дефицитом эстрогенов, характеризуются физиологическими и анатомическими изменениями.
Симптомы ГУМС
— повышенная чувствительность к химическим и физическим раздражителям, механическим повреждениям и инфекциям;
— отек и болезненные ощущение (вульводиния).
Что преобладает в мочевом синдроме у больных огней
У здорового человека основная масса белка задерживается гломерулярным фильтром (мембранами клубочка нефрона). Белки, пропущенные в клубочковый фильтрат, почти полностью реабсорбируются канальцевым эпителием. Выделение белка с мочой в небольших количествах является физиологическим процессом (физиологическая протеинурия), при этом протеинурия не превышает 100-150мг/сут, а уровень альбуминурии не должен превышать 10-30 мг. В структуре физиологической протеинурии примерно 20% составляют белки с низкой молекулярной массой (до 20 кДа), такие как иммуноглобулины (Ig), 40% – белки с высокой молекулярной массой (65 кДа) и 40% – уромодулин (мукопротеин Tamm-Horsfall). При проведении общего анализа мочи в норме белок не определяется или выявляется в небольшом количестве (следы или 0,033 г/л). Это преимущественно альбумины и гликопротеиды. Обычными лабораторными методами такое количество белка не выявляется или определяются его следы («следовая» протеинурия).
Концентрация белка в моче при общем анализе выше 0,033 г/л в большинстве случаев является патологической. Выделение белка свыше 150-200 мг/сутки оценивается как протеинурия. Протеинурия является одним из наиболее изученных факторов риска прогрессирования почечной патологии. По мере повышения уровня протеинурии возрастает риск развития и скорость прогрессирования почечной недостаточности.
Протеинурия по происхождению бывает: 1) внепочечной / экстраренальной (обычно не более 1 г/л): а) преренальная/надпочечная протеинурия может быть следствием увеличения концентрации белка в плазме крови в результате его чрезмерной продукции или избыточного потребления (например, белковые коктейли), при усиленном распаде белка в тканях и гемолизе; б) постренальная протеинурия — связанна с патологией мочевыводящей системы (белок попадает в мочу из мочевых и половых путей как примесь воспалительного экссудата) и 2) почечной/ренальной (белок попадает в мочу из нефронов): а) селективной (потеря низкомолекулярных белков) – при минимальном (чаще обратимом) повреждении гломерулярного фильтра и представлена белками с молекулярной массой не более 6800: альбумином, церулоплазмином, трансферрином; б) неселективной (потеря низко- и крупно- молекулярных белков) – при тяжелом повреждении гломерулярного фильтра, отличается выходом высокомолекулярных белков (γ-глобулинов, α2-глобулинов, β- липопротеинов) [2].
Ренальная протеинурия может быть клубочковой или канальцевой. В зависимости от длительности воздействия на клубочковые капилляры факторов, повышающих их проницаемость, различают постоянную и транзиторную протеинурию.
Транзиторная (преходящая) почечная протеинурия представляет собой достаточно обширную группу самостоятельно проходящих почечных протеинурий, которые вызываются разнообразными факторами, приводящими к временному повышению проницаемости клубочковых капилляров. Все они немассивные и селективные. Выделяют 2 группы транзиторной почечной протеинурии: функциональная (у здоровых людей, под влиянием ряда агентов, временно повышающих проницаемости клубочковых капилляров) и органическую (при патологических состояниях) [3].
Органическая транзиторная протеинурия: 1) при острых инфекционных заболеваниях (лихорадочная). Ведущая причина – повышение проницаемости клубочковых капилляров под влиянием циркулирующих в крови токсинов, а также возможные незначительные расстройства клубочкового кровообращения; 2) при патологии ЖКТ (при некоторых заболеваниях печени, энтеритах, колитах) транзиторная протеинурия связана с токсическим воздействием на капилляры клубочков продуктов кишечного гниения, чаще при синдроме гнилостной кишечной диспепсии [5]; 3) лекарственная транзиторная протеинурия развивается при воздействии некоторых лекарственных средств, действующих токсично на клубочковые капилляры (висмут, ртуть, и др.); 4) при тяжелой анемии возможно повышение проницаемости клубочковых капилляров в результате гипоксемии; 5) транзиторная протеинурия после ожогов/травм/операций – обусловлена токсическим влиянием циркулирующих в крови продуктов белкового распада на капилляры клубочков; 6) транзиторная протеинурия после транзиторной ишемической атаки/мозгового инсульта, приступа эпилепсии – возникает в результате центрально обусловленных нарушений клубочкового кровообращения; 7) ортостатическая протеинурия – появляется в вертикальном положении тела и исчезает в горизонтальном, чаще наблюдается у лиц в возрасте 13-20 лет. Наиболее вероятной причиной ортостатической протеинурии считают лордоз нижней части грудного и верхней части поясничного отдела позвоночника. При такой деформации в вертикальном положении усиливается давление позвонков на почечные вены, возникает местный венозный застой в почках, что приводит к нарушению кровообращения в клубочках и фильтрации в них белка [6].
Особенностями транзиторной протеинурии является ее эпизодичность, минимальная выраженность (значения – 0,066–0,099 г/л, не более 300 мг/сут) и связь с причинным фактором. При подозрении на транзиторную протеинурию необходимо осуществить мониторинг протеинурии и детальный анализ анамнеза.
Выделяют 3 степени протеинурии: 1) слабо выраженная протеинурия 150—500 мг\сутки (острый постстрептококковый гломерулонефрит, гематурическая форма хронического гломерулонефрита; наследственный нефрит; тубулопатии; интерстициальный нефрит; обструктивная уропатия); 2) умеренно выраженная протеинурия 500—2000 мг\сут. (острый постстрептококовый гломерулонефрит; наследственный нефрит; хронический гломерулонефрит); 3) выраженная протеинурия более 2000 мг\сутки (нефротический синдром, амилоидоз).
Рассмотрим основные заболевания и состояния, при которых может встречаться протеинурия.
Полиморфизм синдрома гиперактивного мочевого пузыря у пациентов с острыми и хроническими сосудистыми заболеваниями головного мозга
1 ФГБНУ «Научный центр неврологии», лаборатория нейроурологии и уродинамики, Москва
2 ГБУЗ МО Московский Областной Научно-исследовательский Клинический Институт им.Владимирского М.Ф., кафедра урологии, Москва 125367, г.Москва, Волоколамское шоссе, д. 80, тел. (495)4902009
Эл.почта: uropavel@mail.ru, hammerwise@gmale.com
Введение. Нейрогенные нарушения акта мочеиспускания являются одним из серьезных осложнений острых и хронических сосудистых заболеваний головного мозга. В значительной степени снижая качество жизни и социальную адаптацию неврологических больных, они способствует увеличению сроков пребывания в стационаре, а также достоверно ассоциируется с повышенной частотой повторных ишемических атак (Devroey D., et al., 2003) и в 10% случаев рассматриваются как одна из причин гибели пациентов, в том числе от уросепсиса и самоубийств [1, 2, 3].
По современным представлениям развитие нейрогенных нарушений акта мочеиспускания обусловлены как повреждением участков серого вещества головного мозга, отвечающих за реализацию функций мочевого пузыря и уретры (постинсультные нарушения мочеиспускания), так десинхронизацией работы этих центров вследствие хронической сосудистой демиелинизации, наблюдаемой при дисциркуляторной энцефалопатии [4, 5, 6]. До настоящего времени остаются малоизученными роль ишемического повреждения центров мочеиспускания, расположенных в лобных и височных долях и паравентрикулярно, в возникновении различных форм нарушения акта мочеиспускания у больных, перенесших инсульт. Единичные публикации посвящены роли симметричности поражения центров головного мозга в развитии отдельных уродинамических форм. Наиболее изученными являются стволовые центры: ядро Баррингтона и сторожевой центр мочеиспускания, ишемическое поражение которых приводит к развитию императивного недержания мочи [7, 8].
Частота встречаемости урологических осложнений острых и хронических сосудистых заболеваний головного мозга варьирует в зависимости от фазы заболевания, пола и возраста больных, характера поражения головного мозга (ишемия, кровоизлияние), локализации инсульта и длительности заболевания в случае дисциркуляторной энцефалопатии [9, 10].
Прогрессирование неврологических, психических и нейроурологических нарушений может быть обусловлено устойчивой и длительной недостаточностью мозгового кровообращения и/или повторными эпизодами дисциркуляции, протекающими как с острой клинической симптоматикой (острое нарушение мозгового кровообращения по типу лакунарного инфаркта), так и субклинически. К числу инвалидизирующих проявлений ДЭ наряду с когнитивными нарушениями, расстройствами функции ходьбы, относят функциональные (нейрогенные) нарушения мочеиспускания, которые вызывают резкое снижение качества жизни больных [11].
Изучение вопросов этиологии и патогенеза нейрогенных нарушений мочеиспускания при ХСЗГМ имеет полувековую историю – от установления корреляции между возникновением когнитивных нарушений, расстройствами ходьбы и «урологической» симптоматикой до выявления определенных участков головного мозга, хроническая ишемия которых вызывает дисфункцию мочевого пузыря: в 1955 г. M. Roth [12] выделил «эмоциональное недержание мочи» как один из маркеров «атеросклеротического психоза»; в 1969 г. W. MayerGross и соавт. [10] объединили недержание мочи и другие симптомы в понятие «мультиинфарктная деменция»; в 1974 г. V. Hachinski и соавт. [13] включили «эмоциональное недержание мочи» в шкалу Хачинского; в 1996 г. K. Amar и соавт. указали на то, что недержание мочи можно использовать для дифференциальной диагностики сосудистой и альцгеймеровской деменции. В первом случае недержание возникает на первых стадиях заболевания, в то время как во втором случае – на последних (при разрушении ядра личности), в 2006 г. S. Choi-Kwon [цит. по 15] выявил положительное влияние флуоксетином на «эмоциональное недержание мочи»; в 2009 г. Ш.А. Минатуллаев и соавт. [6] описали особенности клинического течения нейрогенных нарушений мочеиспускания при различных формах ДЭ; в 2009 г. G. Kuchel и соавт. [14] выделили особую зону белого вещества, расположенную интимно с поясной извилиной, поражение которой (передний лейкоареоз) наиболее часто сопровождается развитием ирритативных расстройств мочеиспускания.
Из вышеизложенного видно, что первоначально недержание мочи рассматривалось как проявление нарушений в эмоциональном фоне больного и лишь полвека спустя, благодаря совершенствованию уродинамической и нейровизуализационной техники, а также привлечению к первичному обследованию больных специалистов урологов и нейроурологов, было установлено влияние хронического ишемического поражения зон и центров головного мозга, отвечающих за реализацию акта мочеиспускания на развитие расстройств мочеиспускания.
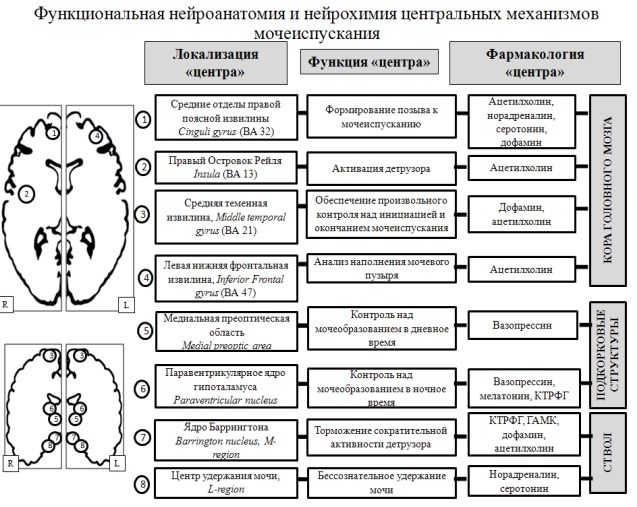
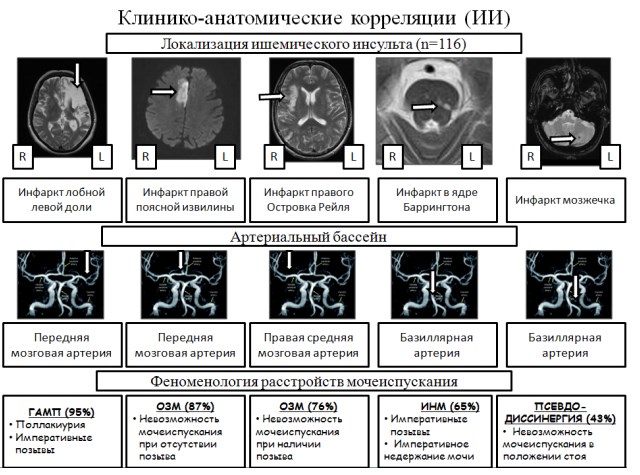
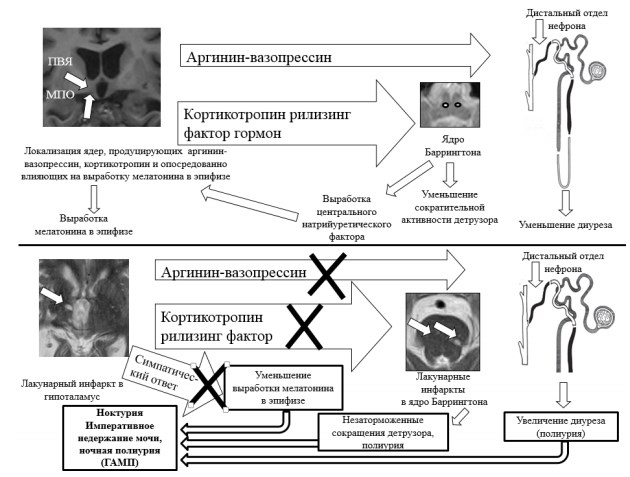
Шварц П.Г.(2013) [15] в своем исследовании, включавшем 374 пациентов с нейрогенными расстройствами мочеиспускания на фоне ишемического инсульта (n=116), различных клинических форм дисциркуляторной энцефалопатии (n=147) и сочетании острой и хронической ишемии (n=111), пришел к выводу, что развитие ишемического повреждения центров мочеиспускания и ассоциированных с ними зон коры головного мозга приводит не только к нарушению сократительной активности нижних мочевых путей (НМП), но затрагивают ряд эндокринных звеньев регуляции мочеиспускания. Автором было высказано предположение, основанное на примененных методах фармакологического и феноменологического анализа и последующего синтетического подхода, что неэффективность «классической» антихолинергической терапии синдрома гиперактивного мочевого пузыря (ГАМП) в 45% случаях связано с нейроэндокринными расстройствами, возникшими вследствие повреждения ядер гипоталамуса, а не с прямым действием парасимпатикотонии, как считалось ранее [15, 16]. На рисунке 1 представлены основные ядра и зоны коры полушарий головного мозга, регулирующие мочеиспускание их функциональные (в том числе асимметрия) и нейрохимические особенности, выявленные в ходе работы Шварца П.Г. (2013) [15, 17].
Как видно из рис 1, для корковых «центров мочеиспускания» головного мозга характерна асимметрия, различие в нейромедиаторных системах и функциональной значимости. Особое место среди подкорковых центров мочеиспускания занимают медиальная преоптическая область (МПО) и паравентрикулярное ядро гипоталамуса (ПВЯ), участвующие в регуляции мочеобразования (система аргинин-вазопрессина), суточных ритмов (система мелатонина) и эмоциональных реакциях, в том числе связанных с мочеиспусканием (система кортикотропин рилизинг фактор гормона). Многообразие функций различных отделов головного мозга, участвующих в реализации мочеиспускания и мочеобразования нашло свое применение в феноменологической картине расстройств мочеиспускания при ишемическом инсульте, представленной на рис 2.
Рис. 1. Центральная регуляция мочеобразования и мочевыделения
Рис. 2. Клинико-анатомические корреляции различных видов нарушений мочеиспускания при ишемическом инсульте
Как видно из рис. 2, многообразие клинических форм расстройств мочеиспускания при ишемическом инсульте заметно не только в частоте встречаемости и характере синдромов, но и внутри каждого из них. Это наблюдение вошло в основу предположения, что синдром ГАМП не является чем-то однородным и постоянным, а имеет значительную вариабельность.
Ряд авторов единодушны во мнении, что недержание мочи, сильный маркер инсульта, предупреждающий на ранних этапах о надвигающейся гибели больного [1, 18-22].
Другая группа авторов указывает, что инсульт является самой частой причиной недержания мочи у мужчин [23, 24, 25, цит. по 15].
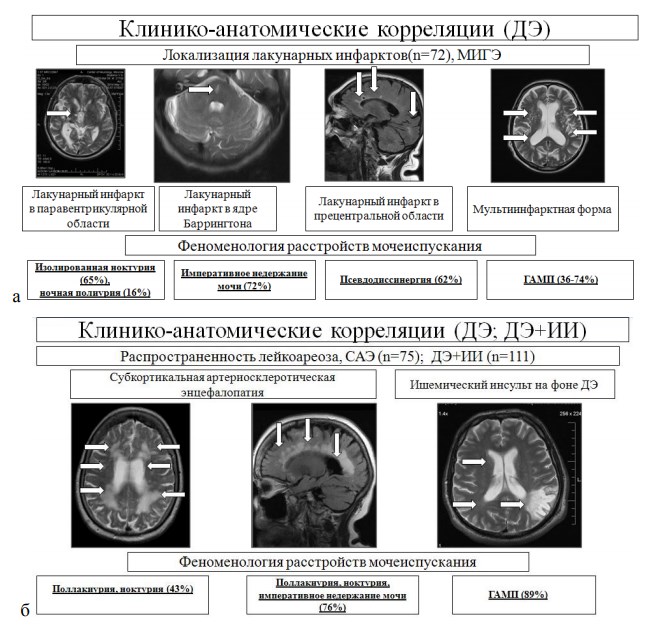
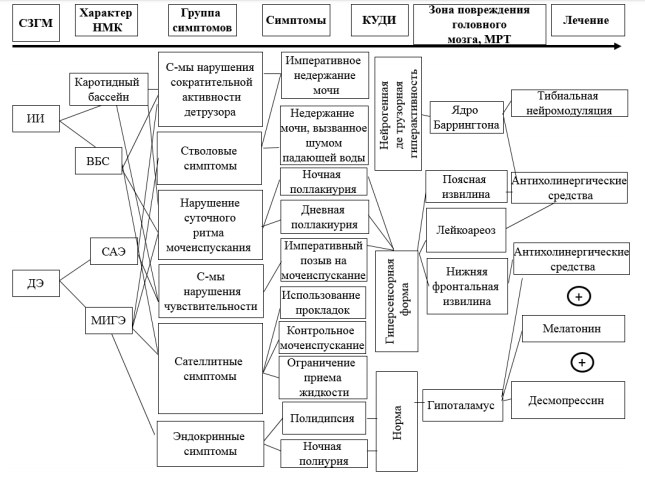
Кроме того, была выявлена достоверная корреляция симптомов, сопровождавших различные варианты клинической картины ГАМП, названных нами сопутствующими симптомами, или «сателлитными симптомами». Особенно ярко эта взаимосвязь прослеживается при наблюдении за пациентами, страдающими дисциркуляторной энцефалопатией (МИГЭ, САЭ). Билатеральное ишемическое поражение белого вещества головного мозга (САЭ) и подкорковых ганглиев (МИГЭ) значительно снижает компенсаторные адаптационные возможности центров мочеиспускания и мочеобразования. На рис. 3 представлены основные синдромы нарушенного мочеиспускания, сопровождающие различные варианты ДЭ.
Как видно из Рис.3., нарушения мочеиспускания у пациентов с МИГЭ (n=75) проявлялись преимущественно ирритативными симптомами. Была отмечена закономерность развития отдельных симптомов, составляющих синдром ГАМП:
(1) Ноктурия → (2) Императивные позывы на мочеиспускание → (3) Ночная полиурия → (4) ИНМ → (5) Поллакиурия.
Рис. 3. Основные синдромы нарушенного мочеиспускания и последовательности возникновения отдельных симптомов, сопровождающие различные варианты ДЭ а – САЭ, б – МИГЭ
Описанная последовательность повторялась у 64 (85%) больных, у 11 больных (15%) симптомы возникали в другой последовательности, что объяснялось, вероятно, асимметрией поражения головного мозга лакунарными инфарктами.
Анализ зон локализации ишемического повреждения головного мозга у пациентов 2А п/группы позволил связать последовательность развития симптомов с конкретными центрами мочеиспускания: Паравентрикулярное ядро гипоталамуса → Поясная извилина → Медиальная преоптическая область → Ядро Баррингтона → Нижняя фронтальная извилина.
Характерной особенностью возникновения СНМП при МИГЭ является внезапное их появление на фоне нормального мочеиспускания. В частности, ноктурия при паравентрикулярной локализации очага лакунарного инфаркта в виде 2 или 3-х мочеиспусканий за ночь появляется неожиданно для больного и в дальнейшем отмечается каждую ночь в строгом количественном эквиваленте. Это относится и к другим проявлениям синдрома ГАМП. Из поведенческих симптомов преобладает использование гигиенических прокладок и контрольное мочеиспускание «на дорожку». Преобладание поведенческих и моторных симптомов указывало на повреждение преимущественно серого вещества коры больших полушарий и подкорковых ганглиев и ядра Баррингтона.
Напротив, при САЭ (n=72) СНМП появляются постепенно и неуклонно прогрессируют. Преобладают чувствительные расстройства, больные (чаще чем пациенты с МИГЭ) ограничивают питьевой режим.
Была отмечена закономерность развития отдельных симптомов, составляющих синдром ГАМП: (1) → Поллакиурия → (2) Императивные позывы на мочеиспускание → (3) Ноктурия → (4) Императивное недержание мочи.
Ночная полиурия при САЭ практически не отмечалась, что можно связать с интактностью медиальной преоптической области к сосудистой демиелинизации (лейкоареозу), а также отсутствию прямой физиологической связи между мочеобразованием и функционированием мочевого пузыря.
Описанная последовательность повторялась у 69 (96%) больных, у 3 больных (4%) симптомы возникали в другой последовательности.
Анализ зон локализации лейкоареоза у пациентов 2Б п/группы позволил связать последовательность развития симптомов с десинхронизацией корковых, подкорковых и стволовых центров мочеиспускания:
Нижняя фронтальная извилина → Поясная извилина → Паравентрикулярное ядро гипоталамуса → Ядро Баррингтона.
Характерной особенностью возникновения СНМП при САЭ является Постепенное их появление на фоне нарастающей ирритативной симптоматики. В частности, поллакиурия, наблюдаемая в начальных проявлениях заболеваниях (передний лейкоареоз) дополняется ноктурией при паравентрикулярной локализации сосудистой демиелинизации в виде 1-2-3-х мочеиспусканий за ночь, которые присоединяются последовательно и прогрессивно. Преобладание поведенческих и сенсорных симптомов также указывает на повреждение преимущественно белого вещества больших полушарий и приводит к функциональной изоляции подкорковых ганглиев и ядра Баррингтона [цит. по 15, 29].
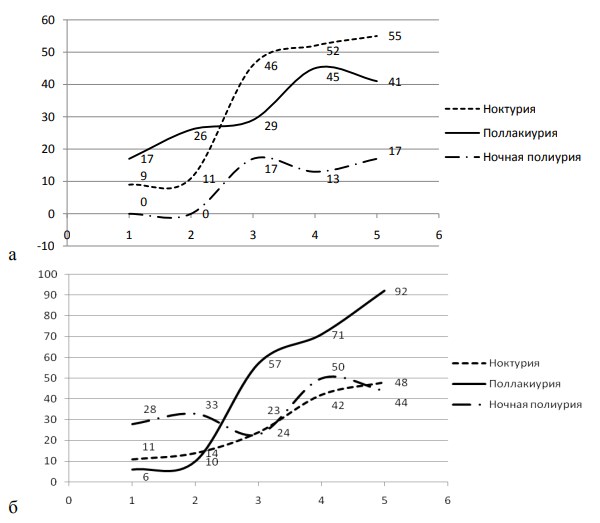
Динамика развития указанной симптоматики у пациентов, перенесших ишемический инсульт и ДЭ в сочетании с ишемическим инсультом, представлено на рис. 4.
Рис. 4. Соотношение между длительностью заболевания и динамикой клинических признаков дизритмии акта мочеиспускания (ноктурия, поллакиурия, ночная полиурия) при ишемическом инсульте (а) и ДЭ с развитием инсульта (б). 1-5 – пять периодов ИИ, что соответствовало 1, 3, 6, 12, и далее месяцам. Данные приведены в % [15].
Анализ развития тех или иных симптомов во времени позволяет взглянуть на болезнь в формате 4D. Болезнь перестает представляться нам как набор результатов анализов, она «живет», осуществляя превращение здорового целостного организма в больной организм, лишенный определенных внутренних связей, но сохраняющий при этом своеобразную форму жизнедеятельности. Анализируя таким образом динамику симптомов, врач видит болезнь одновременно в прошлом, настоящем и может заглянуть в еѐ будущее. Описанные выше работы, преимущественно зарубежных авторов рассматривали синдром ГАМП в плоскости листа бумажной анкеты. В этой связи из их внимания ускользнул факт наличия у значительной категории больных СЗГМ (>16%) расстройств мочеобразования в виде ночной полиурии. Проведенные исследования позволили составить клинико-анатомо-функциональную классификацию нарушений акта мочеиспускания (и мочеобразования) при СЗГМ, представленную в нашей статье 2016 [15]. Ниже, в таблице 1 представлены результаты анализа встречаемости ночной полиурии и других (классических и сателлитных симптомов ГАМП) при различных клинических вариантах СЗГМ. Вариабельность симптомов ГАМП позволяет предположить, что этот синдром нельзя рассматривать как самостоятельный или целостный, по крайней мере, когда речь идет о пациентах с СЗГМ. По-видимому, целесообразнее будет рассматривать симптомы поражения отдельных функциональных систем (например, гипоталамогипофизарной или лимбической стресс-системы).
Таблица 1. Встречаемость классических и сотеллитных симптомов ГАМП при различных клинических вариантах СЗГМ
| Симптоматика ГАМП | Ишемический инсульт* | Дисциркуляторная энцефалопатия | Ишемический инсульт на фоне дисциркуляторной энцефалопатии | ||
| МИГЭ | САЭ | ||||
| «Классические симптомы» | Императивное недержание мочи | ++ | ++ | ± | ++ |
| Дневная поллакиурия | ++ | + | ++ | ++ | |
| Императивный характер позыва на мочеиспускание | ++ | + | + | ++ | |
| «Сателлитные симптомы» | Ограничение питьевого режима | ± | ++ | ++ | + |
| Ношение прокладок | + | ++ | ± | ++ | |
| Контрольные мочеиспускания | ± | + | ++ | ++ | |
| Ночная полиурия | + | + | + | + | |
| Неудержание мочи при стимуляции шумом падающей воды | + | ++ | — | + | |
Анализируя вышеописанные патологические механизмы, приводящие к развитию синдрома ГАМП при СЗГМ можно с высокой степенью вероятности утверждать, что в основе развития этого состояния лежат три составляющих (рис. 5):
Рис. 5. Три механизма развития синдрома ГАМП, связанные с ишемическим повреждением ПВЯ при инсульте и ДЭ (верхняя часть рисунка – норма, нижняя – в условиях ишемии)
Если представить себе распространенность ночной полиурии, возникшей вследствие СЗГМ, среди населения России, то это 16-20% (около 72 000-90000) от 450000 новых случаев ежегодно регистрирующихся новых случаев инсульта, и 10-15% от 700 на 100 000 населения, страдающих ДЭ.
Высокая частота нейрогенных расстройств мочеиспускания и мочеобразования при СЗГМ, требует своевременного и дифференцированного подхода к ранней диагностике этих состояний. Диагностические мероприятия, связанные с ранним выявлением нейрогенных нарушений мочеиспускания, сводятся к следующим:
Данные наблюдения, косвенно, подтверждаются в ряде исследований. В частности, развитие центрального несахарного диабета подтверждено в клинических работах R. Sakakibara et al. (2005), M. Jayaraman et al. (2013), T. Tanaka et al. (2014), A.M. Naiech et al. (2014), J.-M.Kim et al. (2014), Choi-Kowon S. (2007), Cannon A. et al., (1999) [28, 31-35]. Также роль дефицита вазопрессина в развитии постинсультной полиурии и центрального несахарного диабета подтверждена экспериментально в исследованиях A. Shuaib et al. (2002), Liu X., et al. (2010), Heeta I., (1999) 38.
Результаты этих исследований подтвердили, что использование аналога аргинин-вазопрессина – десмопрессина у пациентов с симптомами полиурии и ГАМП значительно снижают потерю жидкости [39, 40], урежают мочеиспускание, улучшают результаты восстановления памяти, терапии постинсультной депрессии и речи (Белокоскова С.Г. и соавт. 2012а, 2012 б, Дорофеева С.А. и соавт. 1998, Кискаева Т.П., 2009) 42.
Резюмируя вышесказанное, хочется подчеркнуть, что успех терапии расстройств мочеиспускания и мочеобразования у пациентов с СЗГМ возможен лишь при индивидуальном подходе к диагностике у каждого пациента, а также при комбинированной терапии синдрома ГАМП с использованием помимо антихолинергических средств, аналога аргинин-вазопрессина – десмопрессина и препаратов мелатонина в зависимости от качественной оценки классических и сателлитных симптомов нарушенного мочеиспускания. Для облегчения этой клинической задачи предлагаем алгоритм диагностики и лечения пациентов с синдромом нейрогенного ГАМП (рис.6).
Рис. 6. Алгоритм диагностики и лечения пациентов с синдромом нейрогенного ГАМП
Таким образом, клинические проявления нарушения акта мочеиспускания в виде СНМП являются одними из первых и постоянных симптомов СЗГМ. В позднем восстановительном и резидуальном периодах встречается ирритативная симптоматика как в виде синдрома ГАМП, так и в виде моносимптомов (ноктурия, императивное недержание мочи, ночная полиурия), происхождение которых имеет сложный генез.
Выявляется корреляция между формой ДЭ и последовательностью формирования симптомов, составляющих синдром ГАМП. С одной стороны, это отражает ступенчатость (МИГЭ) или плавность (САЭ) ишемических процессов, происходящих при ДЭ, с другой стороны указывает на различия в характере поражения (ишемия преимущественно серого вещества при МИГЭ, включая ПВЯ и ядро Баррингтона и белого при САЭ).
Наиболее часто нарушения акта мочеиспускания проявляются в период со 2-го до 5-го года заболевания. Наличие СНМП у больных ДЭ коррелирует с нарушениями походки и когнитивным дефицитом (который может быть связан с дефицитом выработки вазопрессина, отвечающего за формирование и поддержания памяти). СНМП у больных ДЭ обладают полиморфизмом за счет обилия структур, вовлеченных в процесс ишемии.
В тоже время медленно прогрессирующий характер поражения головного мозга позволяет адаптироваться центрам, отвечающим за мочеиспускание, в то время как зоны, отвечающие за накопление мочи в мочевом пузыре, подвергаются необратимым процессам дегенерации. В клинике нарушений акта мочеиспускания у больных СЗГМ преобладает ирритативная симптоматика, что соответствует данным литературы. Наиболее точной и чувствительной шкалой для количественной оценки нарушений акта мочеиспускания у больных ИИ и ДЭ является опросник ФГБУ НЦН РАМН, в котором произведено разделение СНМП на дизритмические, чувствительные, двигательные, поведенческие, эндокринные, что позволяет рассматривать расстройство мочеиспускание как проявление неврологического заболевания.
Литература
1. Brittain K.R. et al. Stroke and incontinence. //Stroke. 1998. V. 29. P 524-28.
2. Brittain K.R., Castleden C.M. Suicide in patients with stroke. Depression may be caused by symptoms affecting lower urinary tract. //Br Med. J. 1998. V. 317. № 7164. – P. 1016-19.
3. Devroey D. et al. Registration of stroke through the Belgian sentinel network and factors influencing stroke mortality. //Cerebrovasc. Dis. 2003. V. 16. – P. 272-77.
4. Langhorne A. et al. Association between physiological homeostasis and early recovery after stroke. //Stroke. 2000. V. 31. – P. 1223.
5. Sakakibara R., Hattori T., Yasuda K., Yamanishi T., Tojo M., Mori M. Micturitional disturbance in Wernicke’s encephalopathy. //Neurourol Urodyn. – 1997. 16(2). P.111-5.
8. Holstege G., Kerstens L., Moes M.C., Vanderhorst V.G. Evidence for a periaqueductal gray-nucleus retroambiguus-spinal cord pathway in the rat. //Neuroscience. – 1997. Sep. 80(2). – P. 587-98.
9. Doshi V.S, Say J.H. et al., Complications in stroke patients: a stady carried out at the rehabilitation medicine service. // Singapore Med. J. — 2003. — Vol. 44 — P. 643652.
10. Mayer-Gross W. et al., The chronic mental patient in India and in England.//Lancet. – 1958. Jun 14;1(7033). – P. 1265-7.
11. Sakakibara R., Hattori T., Uchiyama T., et al. Urinary function in elderly people with and without leukoaraiosis: relation to cognitive and gait function. // J. Neurol. Neurosurg. Psychiiatry — 1999. — Vol.67 — P. 658-660.
12. Roth M. The natural history of mental disorder in old age. //J Ment Sci. – 1955. Apr; 101(423). – P. 281-301.
13. Hachinski V.C., Lassen N.A., Marshall J. Multi-infarct dementia. A cause of mental deterioration in the elderly. //Lancet. – 1974. – Jul. – 27. 2(7874). – P. 207-10.
14. Kuchel G.A., Moscufo N., Guttmann C.R., et al. Localization of brain white matter hyperintensities and urinary incontinence in community-dwelling older adults. //J Gerontol A Biol Sci Med Sci. – 2009. Aug. 64(8). – P. 902-9.
15. Шварц П.Г. Нейрогенные нарушения мочеиспускания у больных с острыми и хроническими сосудистыми заболеваниями головного мозга (клиника, диагностика и лечение). Дисс. … докт. мед. наук; Москва, 2013.
16. Шварц Г.Я., Шварц П.Г., Плотников А.Н., Савин Д.Ю. Лекарственные средства для лечения синдрома гиперактивного мочевого пузыря: настоящее и будущее. //Хим-фарм журн. – 2012. – 46 – 2. – c. 95—102.
17. Шварц П.Г., Попов С.В. Нейрогенная задержка мочи. М: Пресс Бюро 2011. – 224 c.
18. Khan Z., Starer P., Yang W.C., Bhola A. Analysis of voiding disorders in patients with cerebrovascular accidents. //Urology. – 1990. – Mar. 35(3). – P. 265-70.
19. Wade D.T. Hewer R.L. Outlook after an acute stroke: urinary incontinence and loss of consciousness compared in 532 patients. //Q J Med. 1985 Sep; 56 (221). P. 6018.
20. Ween J.E., Alexander M.P., D’Esposito M., Roberts M.: Factors predictive of stroke outcome in a rehabilitation setting. //Neurology. – 1996. – 47 – P.388-392.
21. Walker R.W., Rolfe M., Kelly P.J, George M.O., James O.F.Mortality and recovery after stroke in the Gambia. //Stroke. – 2003. Jul; 34 (7):1604-9. Epub 2003 Jun 19. 22. Wang Y. et al. A prediction model of 1-year mortality for acute ischemic stroke patients. //Arch. Phys. Med. Rehabil. 2003. v. 84. /P 1006-11.
23. Finkelstein M.M. Medical conditions, medications, and urinary incontinence. Analysis of a population-based survey. //Can Fam Physician. – 2002. – Jan. – 48. P. 96101.
24. Landi F., Cesari M., Russo A., Onder G., Lattanzio F., Bernabei R.; Silvernet-HC Study Group Potentially reversible risk factors and urinary incontinence in frail older people living in community. //Age Ageing. – 2003. Mar. 32(2). – P.194-9.
25. Jorgensen L. et al. Self-reported urinary incontinence in noninstitutionalized long-term stroke survivors: A population-base study. //Arch. Phys. Med. Rehabil. 2005. V. 86. P. 416-19.
26. Gelber D.A., Good D.C., Laven L.J., Verhulst S.J. Causes of urinary incontinence after acute hemispheric stroke. //Stroke. – 1993. – Mar. 24(3). – P. 378-82.
27. Borrie MJ, Campbell AJ, Caradoc-Davies TH, Spears GF. Urinary incontinence after stroke: a prospective study. //Age Ageing. – 1986. – May. 15(3). – P. 177-81.
29. Nakamura S, Kobayashi Y, Tozuka K, et al. Circadian changes in urine volume and frequency in elderly men. J Urol 156: 1275–1279, 1996.
30. Шварц П.Г. Феноменология нейрогенных нарушений мочеиспускания. //Рус мед журн. – 2012. – 18. – c. 912—916.
31. Jayaraman M. et al., Transient central diabetes insipidus following ischemic stroke // Indian Journal of Endocrinology and Metabolism. —2013 —Vol.17 (7) — P. 152-154.
32. Tanaka T. Cerebral salt-wasting syndrome due to hemorrhagic brain infarction: a case report. // Journal of Medical Case Reports. – 2014. – 8. – P. 259.
33. Jeong-Min KimSymptomatic hyponatremia following lateral medullary infarction: a case report BMC Neurology 2014, 14:111.
34. Naidech AM1, Desmopressin improves platelet activity in acute intracerebral hemorrhage. Stroke. 2014 Aug;45(8):2451-3.
35. Choi-Kwon S, Choi J, Kwon SU, Kang DW, Kim JS. Fluoxetine is not effective in the treatment of post-stroke fatigue: a double-blind, placebo-controlled study. //Cerebrovasc Dis. 2007. 23(2-3). – P. 103-8.
36. Shuaib A, Xu Wang C, Yang T, Noor R. Effects of nonpeptide V(1) vasopressin receptor antagonist SR-49059 on infarction volume and recovery of function in a focal embolic stroke model. //Stroke. 2002 Dec;33(12):3033-7.
37. Liu X., et al., Arginine-Vasopressin V1 but not V2 Receptor Antagonism Modulates Infarct Volume, Brain Water Content, and Aquaporin-4 Expression Following Experimental Stroke Neurocritical Care February 2010, Volume 12, Issue 1, pp 124-131.
38. Hetta I. The impact of sleep deprivation caused by nocturia. BJU Int 84 (Suppl 1): 27–28, 1999.
39. Бирюкова Е.В. Центральный несахарный диабет. //Вопросы диагностики и терапии —М. —2012 —19 с. М.
40. Shulman LH, Miller JL, Rose LI, et al. Desmopressin for diabetes insipidus, hemostatic disorders and enuresis. // Am Fam Physician. 1990 – 42. P. 1051–1057.
41. Белокоскова С.Г., Цикунов С.Г. Влияние селективного агониста V2рецепторов вазопрессина на мозговой кровоток у больных в отдаленном периоде инсульта. // Медицинский академический журнал, 2012.-N 1.-С.73-79.
43. Дорофеева С.А. Клиническая оценка применения вазопрессина в лечении афазий. // Журнал неврологии и психиатрии им. С.С. Корсакова 1998 4с. N 7. С.2528.
44. Киспаева Т.П. Современные аспекты гормонального профиля при когнитивных расстройствах различной этиологии. //Лечащий врач. – 2009. №9. с 54-58.
Статья опубликована в журнале «Вестник урологии» №3 2016, стр. 41-60