Что принимается за скорость химических реакций как влияет концентрация веществ на скорость
Скорость реакции, ее зависимость от различных факторов
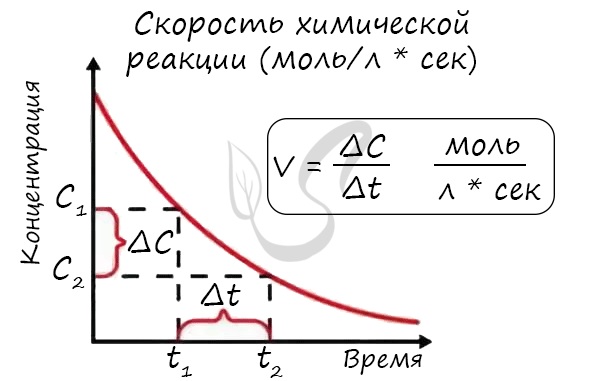
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.

Теория активных столкновений позволяет объяснить влияние некоторых факторов на скорость химической реакции. Основные положения этой теории:
Влияние концентрации реагирующих веществ на скорость реакции
При повышении концентрации реагирующих веществ скорость реакции возрастает. Для того чтобы вступить в реакцию, две химические частицы должны сблизиться, поэтому скорость реакции зависит от числа столкновений между ними. Увеличение числа частиц в данном объеме приводит к более частым столкновениям и к возрастанию скорости реакции.
К увеличению скорости реакции протекающей в газовой фазе приведет повышение давления или уменьшение объема, занимаемого смесью.
На основе экспериментальных данных в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ-
Закон действующих масс (ЗДМ) : 
аА + bВ = cС +dD, где k – константа скорости реакции
ЗДМ выполняется только для элементарных химических реакций, протекающих в одну стадию. Если реакция протекает последовательно через несколько стадий, то суммарная скорость всего процесса определяется самой медленной его частью.
Выражения для скоростей различных типов реакций
ЗДМ относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Скорость гетерогенных реакций
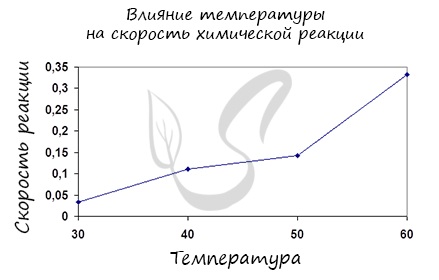
Влияние температуры на скорость реакции
В XIX веке голландский ученый Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 о С скорости многих реакций возрастают в 2-4 раза.
Правило Вант-Гоффа
При повышении температуры на каждые 10 ◦ С скорость реакции увеличивается в 2-4 раза.
Здесь γ (греческая буква «гамма») — так называемый температурный коэффициент или коэффициент Вант-Гоффа, принимает значения от 2 до 4.
Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
Чем больше Ea конкретной реакции, тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Повышение Т приводит к увеличению константы скорости, это объясняется тем, что повышение температуры приводит к быстрому увеличению числа «энергичных» молекул, способных преодолевать активационный барьер Ea.
Влияние катализатора на скорость реакции
Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации.
Катализаторы – это вещества, участвующие в химической реакции и увеличивающие ее скорость, но по окончании реакции остающиеся неизменными качественно и количественно.
Ингибиторы – вещества, замедляющие химические реакции.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом.
Скорость химической реакции
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
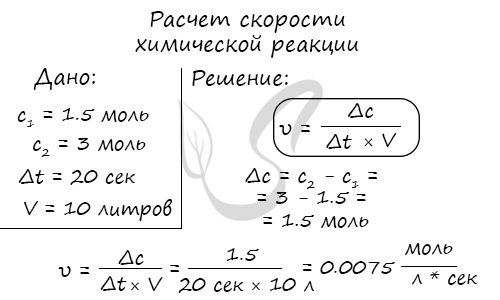
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
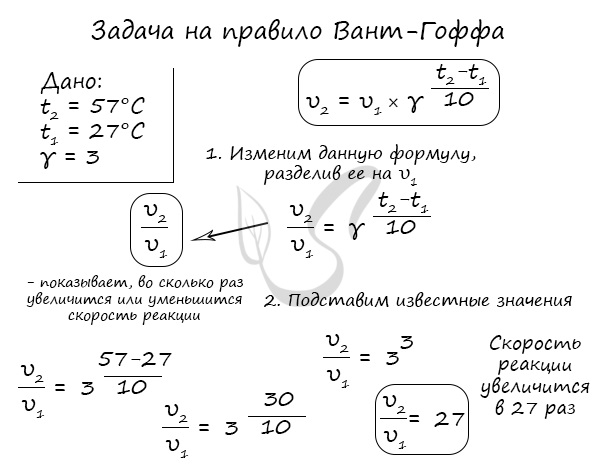
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.
Что принимается за скорость химических реакций как влияет концентрация веществ на скорость
Ключевые слова конспекта: Скорость химической реакции. Факторы, влияющие на скорость реакции: природа реагирующих веществ, площадь их соприкосновения, температура, концентрация, катализатор. Катализ. Ферменты. Ингибиторы.
Скорость — это отношение изменения какой-либо величины к промежутку времени, за которое это изменение произошло. Химические реакции протекают с разными скоростями. Одни практически мгновенно, например смесь водорода с кислородом (гремучая смесь) взрывается за доли секунды. Быстро протекает реакция нейтрализации, т. е. взаимодействие растворов кислоты со щёлочью (основанием):
Другие реакции протекают значительно медленнее, например брожение глюкозы или коррозия металлов:
Что же понимается под скоростью химической реакции? Предположим, некоторое взаимодействие протекает по схеме А + В = АВ. В ходе реакции вещества А и В расходуются, превращаясь в новое вещество АВ. Изменение количества веществ, участвующих в химической реакции, характеризует такая величина, как концентрация.
| Концентрация — количество вещества в единице объёма; её измеряют в моль/л. |
В ходе реакции концентрация исходных веществ (реагентов) уменьшается, а концентрация продукта реакции увеличивается. Изменение концентраций во времени и характеризует скорость химической реакции.
| Скорость химической реакции — отношение изменения концентрации реагента ко времени, за которое это изменение произошло. |
Математически эту закономерность можно выразить следующей формулой:
Если в приведённой формуле С1 и С2 — это начальная и конечная концентрации одного из реагентов, то разность С2 – С1 имеет отрицательное значение, ведь С2 0.
Размерность скорости реакции легко определить: концентрация измеряется в моль/л, время — в секундах, следовательно, единицей скорости реакции является 1 моль/(л • с).
Управление скоростью химической реакции имеет большое значение. Увеличение скорости реакции позволяет получить больше продуктов реакций: стали, пластмасс, химических удобрений, лекарств, топлива и др. Замедление скорости реакции позволяет уменьшать потери металла от коррозии, дольше сохранять продукты питания и т. д.
Рассмотрим, какие факторы влияют на скорость химической реакции.
✅ 1. Природа (состав и строение) реагирующих веществ. Реакции между органическими веществами протекают медленнее подобных реакций между неорганическими веществами. По-разному взаимодействуют галогены с водородом: фтор — со взрывом, хлор — со взрывом лишь при нагревании, бром — без взрыва, а реакция водорода с йодом является эндотермической и протекает медленно. Интенсивность взаимодействия щелочных металлов с водой зависит от их восстановительных свойств, которые усиливаются с увеличением радиуса атома.
✅ 2. Температура. Зависимость скорости химической реакции от температуры была установлена в конце 1884 г. голландским учёным Якобом Хендриком Вант-Гоффом.
Математическое выражение правила Вант-Гоффа записывают следующим образом:
где υ2 — скорость реакции при температуре t2;
υ1 — скорость реакции при температуре t1;
t2 — конечная температура реакции;
t1 — начальная температура реакции,
γ (греческая буква «гамма») — температурный коэффициент реакции, который соответствует изменению скорости химической реакции (увеличивает или уменьшает её) при изменении температуры на 10 градусов.
Например, температурный коэффициент какой–либо реакции близок к 3. Это означает, что при повышении температуры на 20 °С скорость реакции возрастёт в 9 раз:
✅ 3. Площадь соприкосновения реагирующих веществ. Этот фактор учитывается для гетерогенных реакций. Напомним, что гетерогенными (от греч. heteros — другой) называются реакции, идущие между веществами разного агрегатного состояния, т. е. имеющими поверхность раздела. Например, на поверхности соприкосновения жидкости или газа с твёрдым веществом и т. д.
Понятно, что, чем больше площадь соприкосновения реагирующих веществ, тем выше скорость химической реакции. Чтобы увеличить её, в промышленности используют особый метод, который называется «кипящий слой». Твёрдое вещество измельчают до очень мелких частиц, через которые затем пропускают снизу второй реагент, как правило, в газообразном состоянии. При прохождении этого реагента через слой измельчённого вещества наблюдается эффект, напоминающий кипение. Метод «кипящего слоя» используется при производстве серной кислоты для обжига серного колчедана, при каталитическом крекинге нефтепродуктов.
✅ 4. Концентрация реагирующих веществ. Зависимость была установлена норвежскими учёными Като Максимилианом Гульдбергом и Петером Вааге в 1867 г. и получила название закона действующих масс.
| Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции. |
Математическое выражение закона действующих масс для реакции aА + bВ = dD выглядит так:
где υ — скорость химической реакции, СА и СB — концентрации реагентов А и В, а и b — коэффициенты в уравнении реакции, k — коэффициент пропорциональности — константа скорости реакции, которая показывает скорость химической реакции при концентрации реагирующих веществ, равных 1 моль/л.
Например, для второй стадии производства азотной кислоты, которая описывается уравнением 2NO + O2 = 2NO2↑, закон действующих масс отражает формула υ = k • C 2 (NO) • С(O2)
Если в гетерогенной реакции принимает участие твёрдое вещество, его концентрация не входит в уравнение закона. Например, для реакции между раскалённым оксидом меди(II) и водородом СuО + Н2 = Сu + Н2O справедливо следующее выражение: υ = k • С(Н2)
Это означает, что внесение дополнительного количества твёрдого вещества (оксида меди(II)) не оказывает влияния на скорость реакции.
✅ 5. Катализатор. Напомним, что катализаторами (от греч. katalysis — разрушение) называются вещества, изменяющие скорость химической реакции и не входящие в состав продуктов реакции.
Современную химическую промышленность невозможно представить без использования катализаторов. С их помощью ускоряют химические процессы, чтобы быстрее получить нужные вещества и уничтожить вредные (например, химические отходы). Производство минеральных кислот, аммиака и метанола, уксусной кислоты и полимеров, нефтепереработка и производство лекарственных препаратов — около 90 % всех химических производств основано на применении катализаторов.
С помощью катализаторов удаётся повысить производительность химических процессов и уменьшить себестоимость продукции. Катализаторы также позволяют сделать производство экологически более безопасным, т. е. уменьшить загрязнение окружающей среды вредными выбросами.
Катализаторы вошли в жизнь человека, когда он стал использовать процессы брожения для получения уксуса из виноградного сока, варить сыр и выпекать хлеб. Ведь все эти процессы протекают в присутствии биологических катализаторов, или ферментов (от лат. fermentum — закваска). Их также называют энзимами.
Ферменты содержатся во всех живых клетках. Они направляют, регулируют и многократно ускоряют биологические процессы, играя тем самым важную роль в обмене веществ и энергии.
Область применения биологических катализаторов шире, чем неорганических: ежегодный рост их производства в мире составляет 15%, а неорганических — всего 3%. Ферменты «трудятся» в медицине, сельском хозяйстве, пищевой промышленности, защищают окружающую среду, помогают в быту. Например, использование стирального порошка с ферментами — залог успешной стирки. Зная, что ферменты имеют белковую природу и под действием высокой температуры способны денатурировать, вы понимаете, насколько важно следовать инструкции по применению таких порошков.
Обратное влияние на скорость химической реакции оказывают ингибиторы (от лат. inhibere — сдерживать, останавливать) — вещества, подавляющие или задерживающие течение физиологических и физико-химических (главным образом, ферментативных) процессов. Такие вещества важны, как и катализаторы: ингибиторы коррозии, например, помогают сохранить металлы от разрушения.
Конспект урока по химии «Скорость химических реакций». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: