Что принимать для свертывания крови
Какие таблетки помогают разжижать кровь
Для чего разжижают кровь
Нарушения свертываемости крови может возникать в любом возрасте. В первую очередь эта проблема касается всех, кто старше 50 лет. Густая кровь дает дополнительную нагрузку на сердце. Связано это с тем, что густую жидкость качать по огромной кровеносной системе сложнее, требуется больше мощности, которую должно вырабатывать сердце. Пульс при этом становится чаще, а толчки сильнее. Сердечная мышца при такой работе быстрее изнашивается, выходят из строя клапаны, нарушается герметичность предсердий.
Другая опасность густой крови – образование тромбов. Тромбы – это отдельные сгустки, которые образуются в результате налипания тромбоцитов друг к другу. Образовавшиеся тромбы крепятся на стенках сосудов и мешают кровотоку. Но страшнее всего для жизни человека – оторвавшийся тромб. Когда он несется по кровеносной системе, поток несет его к легким, а затем к сердцу. Перекрыв в одном из органов просвет артерии, тромб вызывает ишемический инсульт, который часто приводит к смерти.
Кроме того, густая кровь не может своевременно снабжать органы и ткани питательными веществами, из-за чего организм страдает от легких форм гипоксии. Чем гуще биологическая жидкость, тем сложнее ей подниматься от нижних конечностей к сердцу. В результате чего появляется застой крови в венах, тромбоз и варикоз.
Препараты для разжижения
Самыми доступными на сегодняшний день являются препараты на основе ацетилсалициловой кислоты, больше известной как Аспирин. Такие лекарства распространены в аптеках и стоят немного. В связи с тем, что ацетилсалициловая кислота несет определенные риски для системы кроветворения, и может стать причиной возникновения желудочных кровотечений или язв, медицина активно стала работать над созданием препаратов, свободных от аспирина. Такие лекарственные формы сегодня доступны в аптеках. Эту группу препаратов делят на две подгруппы
антиагреганты, которые не позволяют склеиваться кровеным тельцам.
антикоагулянты, которые предотвращают образованию фибриновых сгустков при свертываемости.
Такие препараты могут назначаться не только пожилым людям для разжижения крови, но и беременным женщинам, с целью обеспечить наилучший кровоток между матерью и плодом. Курс приема лекарственных средств этой группы насыщают кровь кислородом, что очень важно для формирующегося плода.
Антиагреганты
Основными показаниями для назначения антиагрегантов являются:
Сердечные поражения, приведшие к дефициту кровообращения миокарда или полностью лишившие его притока крови.
Ишемические поражения сердца, особенно сопровождающиеся некрозом тканей.
Профилактика тромбообразования у пациентов, перенесших инсульт.
Операции на сердце или вмешательства в восстановление кровеносной системы (стентирование).
Стоимость таких лекарственных средств несколько выше, чем у тех, что содержат ацетилсалициловую кислоту. Как правило, прием таких лекарств осуществляется курсом, что обеспечивает высокие реологические свойства крови постоянно.
Препараты без ацетилсалициловой кислоты
Пациентам, старше 18 лет, и не имеющих проблем с желудочно-кишечным трактом, без опасений назначают лекарственные средства, содержащие аспирин. Особенно, если продолжительность приема не превышает 5-7 дней. В остальных случаях рекомендовано избегать употребления больших доз ацетилсалициловой кислоты, особенно возрастным пациентам.
В список антиагрегантов, не имеющих в своем составе аспирина, входят:
Курантил с действующим веществом дипиридамол.
Тиклид, действие которого основано на тиклодипине.
Плавикс, разжижающих кровь благодаря кропидогрелу.
Брилинт, в основе которого лежит действующее вещество тикагрелор.
Эффиент, работающий благодаря входящему в состав прасугрел
Плетакс с действующим веществом цилостазол.
Трентал, действие которого обусловлено пентоксифиллином.
Широкий выбор препаратов позволяет грамотному врачу подобрать индивидуальный курс терапии для каждого пациента, опираясь на возможные побочные эффекты и наличие хронических заболеваний у больного.
Курантил с депиридамолом
Этот препарат можно назвать обязательным для употребления беременными женщинами на сроке после 20-ой недели вынашивания плода. В аннотации можно прочитать фразу, предупреждающую о возможных рисках. Если участковый акушер-гинеколог прописал курс Курантила, это говорит о том, что женщина не входит в группу риска и может без опасений принимать средство, разжижающее кровь.
Лекарственное средство разгоняет кровь, позволяет будущей маме делиться питательными веществами с ребенком. Прием Курантила позволит обеспечить полноценное развитие будущего малыша.
Описание препарата Тиклпид
Прием Триклида позволяет снизить агрегацию кровяных пластинок и существенно уменьшить вязкость биологической жидкости. Нарушение назначенной схемы лечения и передозировки могут привести к следующим побочным реакциям:
нехватке тромбоцитов, необходимых для естественной закупорки поврежденных участков артерий, сосудов и тканей;
снижению уровня белых кровяных телец;
болям в брюшной полости;
При сильном сгущении крови препарат назначают длительным курсом, а состояние пациента регулярно контролируется. Когда реология главной биологической жидкости будет восстановлена, препарат может быть отменен. Однако завершение приема лекарства не отменяет регулярного анализа качества крови.
Плавикс
Этот препарат стал лидером назначения после инсультов и при коронарном синдроме. Связано это с тем, что по сравнению с другими лекарственными средствами, Плавикс имеет в разы меньше побочных эффектов, которые опасны пациентам пенсионного возраста.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Препараты для разжижения крови
Согласно результатам медицинских исследований, у сердечно-сосудистых заболеваний могут быть разные причины. И если одни (наследственность, возраст) остаются неизменными, то другие можно корректировать с помощью отказа от вредных привычек и изменения образа жизни.
Повышенная вязкость крови – медицинский термин, эквивалентный разговорному выражению «густая кровь». Традиционно считается, что сгущение крови связано с повышением уровня протромбина – компонента свертывающей системы крови. Такое мнение бытует из-за того, что такие серьезные осложнения сердечно-сосудистых заболеваний, как инфаркт и инсульт, чаще возникают при повышенном уровне протромбина. На самом деле вязкость определяется многими факторами.
Главная функция крови заключается в транспортировке дыхательных газов, гормонов, питательных и многих других веществ к органам и системам. От этого напрямую зависят практически все активные процессы, которые происходят в нашем организме. Отклонение от нормы провоцирует её сгущение и разжижение. И в первом, и во втором случаях это приводит к нежелательным результатам.
Как определить у себя сгущение крови?
Для хорошего движения по сосудам кровь должна быть достаточно текучей. Гемостаз — биологическая система, которая, с одной стороны, сохраняет жидкое и текучее состояние крови, а с другой стороны, останавливает кровотечения путем свертывания крови (коагуляции). Коагулограмма – лабораторный тест, который как раз и оценивает, насколько эффективно работает гемостаз.
Риск повышенного тромбообразования имеют люди с ожирением, сахарным диабетом, нарушениями ритма сердца (среди которых наиболее значимы фибрилляция и трепетание предсердий), низкой двигательной активностью, пациенты после крупных операций (например, протезирования суставов, клапанов сердца, экстренных операций и т. п.), с варикозной болезнью, перенесенными инфарктами миокарда, инсультами, с различными аутоиммунными заболеваниями.
Тромбообразование в определенном участке сосудистого русла сопровождается острым или постепенным нарушением кровоснабжения какого-либо органа с нарушением его функций и последующим некрозом тканей.
Помимо вышеперечисленных состояний, коагулограмму выполняют перед операциями для оценки риска кровотечений, при назначении некоторых лекарственных препаратов, а также обязательно при заболеваниях печени, поскольку большая часть белков системы свертывания крови синтезируется именно в этом органе.
Как действуют препараты для разжижения крови?
Так называемые разжижители помогают крови плавно течь по венам и артериям. Они используются для лечения сердечных заболеваний, препятствуют образованию опасных сгустков в сосудах.
При этом многие заблуждаются, думая, что препараты реально делают кровь более жидкой и каким-то чудом разбивают тромбы. Нет, это не так, но они не дают крови образовывать новые сгустки, а также замедляют рост уже существующих тромбов.
Классификация препаратов
В современной медицинской практике существует две группы противосвертывающих препаратов для разжижения крови на длительный прием, и для каждой есть свои конкретные показания.
1) Кардиологические аспирины (аспирин кардио, кардиомагнил, аспекард, полокард и т.д.). Показаны всем, у кого обнаружены или подозреваются атеросклеротические бляшки – ведь аспирин предотвращает “растрескивание” и тромбирование бляшек (процессы, которые приводят к инфаркту или инсульту).
2) Непрямые антикоагулянты – варфарин и его более дорогие сородичи (прадакса, ксарелто и др.). Предотвращают образование тромбов в местах, где ток крови по разным причинам замедляется и вследствие этого есть опасность образования тромбов.
Лекарства, разжижающие кровь, можно принимать:
Оральные антикоагулянты, вмешиваясь в этот процесс, существенно увеличивают время свертывания крови. Однако пероральные антикоагулянты не разжижают кровь и не растворяют уже образовавшиеся сгустки крови, хотя и позволяют прекратить рост имеющихся тромбов.
В норме естественные антикоагулянты крови способствуют тому, что ее свертывание происходит только при нарушении целостности кровеносных сосудов. Однако при определенных клинических состояниях, называемых тромбозными нарушениями, этот же механизм может приводить к нежелательному образованию опасных для жизни кровяных сгустков — тромбов. В таких ситуациях действие антикоагулянтов позволяет предотвратить избыточное тромбообразование.
Как работает свертывание крови?
Формирование тромба в кровотоке. Кровеносный сосуд заполнен клетками крови значительно плотнее, чем показано на этом рисунке, так что ситуация там напоминает давку при входе на эскалатор в метро. Маленькие и относительно немногочисленные белые клетки — тромбоциты: справа можно видеть, как они активируются, меняют форму и прикрепляются к стенке сосуда, формируя агрегат — тромб.
Автор
Редакторы
Свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению плазмы крови в студенистый сгусток, затыкающий рану и останавливающий кровотечение. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных достижениях в ее изучении.
Каждый, кто хоть раз в жизни получал царапину или рану, приобретал тем самым замечательную возможность наблюдать превращение крови из жидкости в вязкую нетекучую массу, приводящее к остановке кровотечения. Этот процесс называется свертыванием крови и управляется сложной системой биохимических реакций.
Иметь какую-нибудь систему остановки кровотечения — абсолютно необходимо для любого многоклеточного организма, имеющего жидкую внутреннюю среду. Свертывание крови является жизненно необходимым и для нас: мутации в генах основных белков свертывания, как правило, летальны. Увы, среди множества систем нашего организма, нарушения в работе которых представляют опасность для здоровья, свертывание крови также занимает абсолютное первое место как главная непосредственная причина смерти: люди болеют разными болезнями, но умирают почти всегда от нарушений свертывания крови. Рак, сепсис, травма, атеросклероз, инфаркт, инсульт — для широчайшего круга заболеваний непосредственной причиной смерти является неспособность системы свертывания поддерживать баланс между жидким и твердым состояниями крови в организме.
Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: ученые постоянно создают новые методы диагностики и терапии нарушений свертывания. Но проблема в том, что система свертывания очень сложна. А наука о регуляции сложных систем учит, что управлять такими системами нужно особым образом. Их реакция на внешнее воздействие нелинейна и непредсказуема, и для того, чтобы добиться нужного результата, нужно знать, куда приложить усилие. Простейшая аналогия: чтобы запустить в воздух бумажный самолетик, его достаточно бросить в нужную сторону; в то же время для взлета авиалайнера потребуется нажать в кабине пилота на правильные кнопки в нужное время и в нужной последовательности. А если попытаться авиалайнер запустить броском, как бумажный самолетик, то это закончится плохо. Так и с системой свертывания: чтобы успешно лечить, нужно знать «управляющие точки».
Вплоть до самого последнего времени свертывание крови успешно сопротивлялось попыткам исследователей понять его работу, и лишь в последние годы тут произошел качественный скачок. В данной статье мы расскажем об этой замечательной системе: как она устроена, почему ее так сложно изучать, и — самое главное — поведаем о последних открытиях в понимании того, как она работает.
Как устроено свертывание крови
Остановка кровотечения основана на той же идее, что используют домохозяйки для приготовления холодца — превращении жидкости в гель (коллоидную систему, где формируется сеть молекул, способная удержать в своих ячейках тысячекратно превосходящую ее по весу жидкость за счет водородных связей с молекулами воды). Кстати, та же идея используется в одноразовых детских подгузниках, в которые помещается разбухающий при смачивании материал. С физической точки зрения, там нужно решать ту же самую задачу, что и в свертывании — борьбу с протечками при минимальном приложении усилий.
Свертывание крови является центральным звеном гемостаза (остановки кровотечения). Вторым звеном гемостаза являются особые клетки — тромбоциты, — способные прикрепляться друг к другу и к месту повреждения, чтобы создать останавливающую кровь пробку.
Общее представление о биохимии свертывания можно получить из рисунка 1, внизу которого показана реакция превращения растворимого белка фибриногена в фибрин, который затем полимеризуется в сетку. Эта реакция представляет собой единственную часть каскада, имеющую непосредственный физический смысл и решающую четкую физическую задачу. Роль остальных реакций — исключительно регуляторная: обеспечить превращение фибриногена в фибрин только в нужном месте и в нужное время.
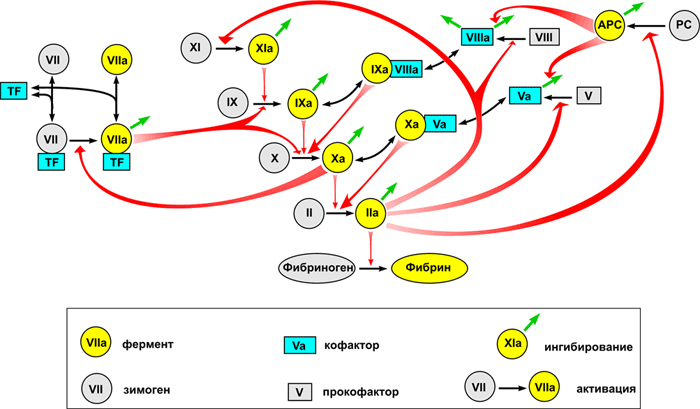
Рисунок 1. Основные реакции свертывания крови. Система свертывания представляет собой каскад — последовательность реакций, где продукт каждой реакции выступает катализатором следующей. Главный «вход» в этот каскад находится в его средней части, на уровне факторов IX и X: белок тканевый фактор (обозначен на схеме как TF) связывает фактор VIIa, и получившийся ферментативный комплекс активирует факторы IX и X. Результатом работы каскада является белок фибрин, способный полимеризоваться и образовывать сгусток (гель). Подавляющее большинство реакций активации — это реакции протеолиза, т.е. частичного расщепления белка, увеличивающего его активность. Почти каждый фактор свертывания обязательно тем или иным образом ингибируется: обратная связь необходима для стабильной работы системы.
Обозначения: Реакции превращения факторов свертывания в активные формы показаны односторонними тонкими черными стрелками. При этом фигурные красные стрелки показывают, под действием каких именно ферментов происходит активация. Реакции потери активности в результате ингибирования показаны тонкими зелеными стрелками (для простоты стрелки изображены как просто «уход», т.е. не показано, с какими именно ингибиторами происходит связывание). Обратимые реакции формирования комплексов показаны двусторонними тонкими черными стрелками. Белки свертывания обозначены либо названиями, либо римскими цифрами, либо аббревиатурами (TF — тканевый фактор, PC — протеин С, APC — активированный протеин С). Чтобы избежать перегруженности, на схеме не показаны: связывание тромбина с тромбомодулином, активация и секреция тромбоцитов, контактная активация свертывания.
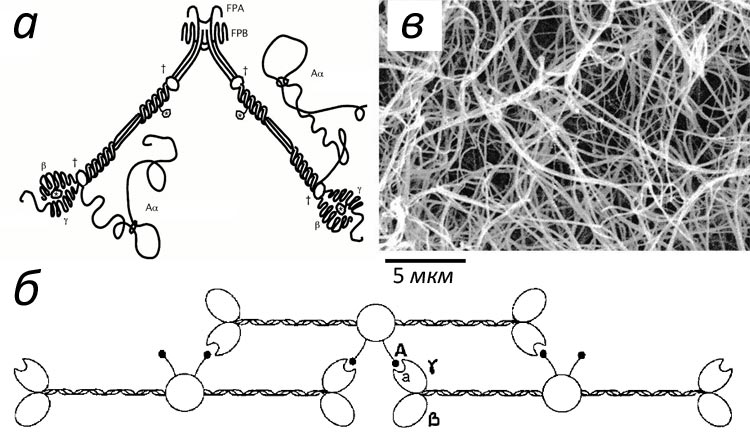
Фибриноген напоминает стержень длиной 50 нм и толщиной 5 нм (рис. 2а). Активация позволяет его молекулам склеиваться в фибриновую нить (рис 2б), а затем в волокно, способное ветвиться и образовывать трехмерную сеть (рис. 2в).
Рисунок 2. Фибриновый гель. а — Схематическое устройство молекулы фибриногена. Основа ее составлена из трех пар зеркально расположенных полипептидных цепей α, β, γ. В центре молекулы можно видеть области связывания, которые становятся доступными при отрезании тромбином фибринопептидов А и Б (FPA и FPB на рисунке). б — Механизм сборки фибринового волокна: молекулы крепятся друг к другу «внахлест» по принципу головка-к-серединке, образуя двухцепочечное волокно. в — Электронная микрофотография геля: фибриновые волокна могут склеиваться и расщепляться, образуя сложную трехмерную структуру.
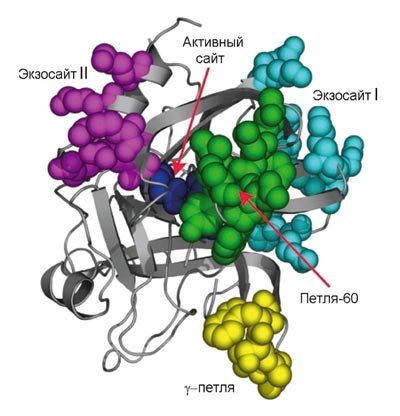
Рисунок 3. Трехмерная структура молекулы тромбина. На схеме показаны активный сайт и части молекулы, ответственные за связывание тромбина с субстратами и кофакторами. (Активный сайт — часть молекулы, непосредственно распознающее место расщепления и осуществляющее ферментативный катализ.) Выступающие части молекулы (экзосайты) позволяют осуществлять «переключение» молекулы тромбина, делая его мультифункциональным белком, способным работать в разных режимах. Например, связывание тромбомодулина с экзосайтом I физически перекрывает доступ к тромбину прокоагулянтным субстратам (фибриноген, фактор V) и аллостерически стимулирует активность по отношению к протеину C.
Активатор фибриногена тромбин (рис. 3) принадлежит к семейству сериновых протеиназ — ферментов, способных осуществлять расщепление пептидных связей в белках. Он является родственником пищеварительных ферментов трипсина и химотрипсина. Протеиназы синтезируются в неактивной форме, называемой зимогеном. Чтобы их активировать, необходимо расщепить пептидную связь, удерживающую часть белка, которая закрывает активный сайт. Так, тромбин синтезируется в виде протромбина, который может быть активирован. Как видно из рис. 1 (где протромбин обозначен как фактор II), это катализируется фактором Xa.
Вообще, белки свертывания называют факторами и нумеруют римскими цифрами в порядке официального открытия. Индекс «а» означает активную форму, а его отсутствие — неактивный предшественник. Для давно открытых белков, таких как фибрин и тромбин, используют и собственные имена. Некоторые номера (III, IV, VI) по историческим причинам не используются.
Активатором свертывания служит белок, называемый тканевым фактором, присутствующий в мембранах клеток всех тканей, за исключением эндотелия и крови. Таким образом, кровь остается жидкой только благодаря тому, что в норме она защищена тонкой защитной оболочкой эндотелия. При любом нарушении целостности сосуда тканевой фактор связывает из плазмы фактор VIIa, а их комплекс — называемый внешней теназой (tenase, или Xase, от слова ten — десять, т.е. номер активируемого фактора) — активирует фактор X.
Тромбин также активирует факторы V, VIII, XI, что ведет к ускорению его собственного производства: фактор XIa активирует фактор IX, а факторы VIIIa и Va связывают факторы IXa и Xa, соответственно, увеличивая их активность на порядки (комплекс факторов IXa и VIIIa называется внутренней теназой). Дефицит этих белков ведет к тяжелым нарушениям: так, отсутствие факторов VIII, IX или XI вызывает тяжелейшую болезнь гемофилию (знаменитую «царскую болезнь», которой болел царевич Алексей Романов); а дефицит факторов X, VII, V или протромбина несовместим с жизнью.
Такое устройство системы называется положительной обратной связью: тромбин активирует белки, которые ускоряют его собственное производство. И здесь возникает интересный вопрос, а зачем они нужны? Почему нельзя сразу сделать реакцию быстрой, почему природа делает ее исходно медленной, а потом придумывает способ ее дополнительного ускорения? Зачем в системе свертывания дублирование? Например, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа); это выглядит совершенно бессмысленным.
В крови также присутствуют ингибиторы протеиназ свертывания. Основными являются антитромбин III и ингибитор пути тканевого фактора. Кроме этого, тромбин способен активировать сериновую протеиназу протеин С, которая расщепляет факторы свертывания Va и VIIIa, заставляя их полностью терять свою активность.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин. Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы их инактивировать. Активированный протеин С производит несколько протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их полностью терять свою кофакторную активность. Таким образом, тромбин — продукт каскада свертывания — ингибирует свое собственное производство: это называется отрицательной обратной связью. И опять у нас регуляторный вопрос: зачем тромбин одновременно ускоряет и замедляет собственную активацию?
Эволюционные истоки свертывания
Формирование защитных систем крови началось у многоклеточных свыше миллиарда лет назад — собственно, как раз в связи с появлением крови. Сама система свертывания является результатом преодоления другой исторической вехи — возникновения позвоночных около пятисот миллионов лет назад. Скорее всего, эта система возникла из иммунитета. Появление очередной системы иммунных реакций, которая боролась с бактериями путем обволакивания их фибриновым гелем, привело к случайному побочному результату: кровотечение стало прекращаться быстрее. Это позволило увеличивать давление и силу потоков в кровеносной системе, а улучшение сосудистой системы, то есть улучшение транспорта всех веществ, открыло новые горизонты развития. Кто знает, не было ли появление свертывания тем преимуществом, которое позволило позвоночным занять свое нынешнее место в биосфере Земли?
У ряда членистогих (таких, как рак-мечехвост) свертывание также существует, но оно возникло независимо и осталось на иммунологических ролях. Насекомые, как и прочие беспозвоночные, обычно обходятся более слабой разновидностью системы остановки кровотечения, основанной на агрегации тромбоцитов (точнее, амебоцитов — дальних родственников тромбоцитов). Этот механизм вполне функционален, но накладывает принципиальные ограничения на эффективность сосудистой системы, — так же, как трахейная форма дыхания ограничивает максимально возможный размер насекомого.
К сожалению, существа с промежуточными формами системы свертывания почти все вымерли. Единственным исключением являются бесчелюстные рыбы: геномный анализ системы свертывания у миноги показал, что она содержит гораздо меньше компонентов (то есть, устроена заметно проще) [6]. Начиная же с челюстных рыб и до млекопитающих системы свертывания очень похожи. Системы клеточного гемостаза также работают по схожим принципам, несмотря на то, что мелкие, безъядерные тромбоциты характерны только для млекопитающих. У остальных позвоночных тромбоциты — крупные клетки, имеющие ядро.
Подводя итог, система свертывания изучена очень хорошо. В ней уже пятнадцать лет не открывали новых белков или реакций, что для современной биохимии составляет вечность. Конечно, нельзя совсем исключить вероятность такого открытия, но пока что не существует ни одного явления, которое мы не могли бы объяснить при помощи имеющихся сведений. Скорее наоборот, система выглядит гораздо сложнее, чем нужно: мы напомним, что из всего этого (довольно громоздкого!) каскада собственно желированием занимается только одна реакция, а все остальные нужны для какой-то непонятной регуляции.
Именно поэтому сейчас исследователи-коагулологи, работающие в самых разных областях — от клинической гемостазиологии до математической биофизики, — активно переходят от вопроса «Как устроено свертывание?» к вопросам «Почему свертывание устроено именно так?», «Как оно работает?» и, наконец, «Как нам нужно воздействовать на свертывание, чтобы добиться желаемого эффекта?». Первое, что необходимо сделать для ответа — научиться исследовать свертывание целиком, а не только отдельные реакции.
Как исследовать свертывание?
Для изучения свертывания создаются различные модели — экспериментальные и математические. Что именно они позволяют получить?
С одной стороны, кажется, что самым лучшим приближением для изучения объекта является сам объект. В данном случае — человек или животное. Это позволяет учитывать все факторы, включая ток крови по сосудам, взаимодействия со стенками сосудов и многое другое. Однако в этом случае сложность задачи превосходит разумные границы. Модели свертывания позволяют упростить объект исследования, не упуская его существенных особенностей.
Попытаемся составить представление о том, каким требованиям должны отвечать эти модели, чтобы корректно отражать процесс свертывания in vivo.
В экспериментальной модели должны присутствовать те же биохимические реакции, что и в организме. Должны присутствовать не только белки системы свертывания, но и прочие участники процесса свертывания — клетки крови, эндотелия и субэндотелия. Система должна учитывать пространственную неоднородность свертывания in vivo: активацию от поврежденного участка эндотелия, распространение активных факторов, присутствие тока крови.
Рассмотрение моделей свертывания естественно начать с методов исследования свертывания in vivo. Основа практически всех используемых подходов такого рода заключается в нанесении подопытному животному контролируемого повреждения с тем, чтобы вызвать гемостатическую или тромботическую реакцию. Данная реакция исследуется различными методами:
Рисунок 4. Формирование тромба in vivo в модели тромбоза, индуцированного лазером. Эта картинка воспроизведена из исторической работы, где ученые впервые смогли пронаблюдать развитие тромба «вживую». Для этого в кровь мыши впрыснули концентрат флуоресцентно меченных антител к белкам свертывания и тромбоцитам, и, поместив животное под объектив конфокального микроскопа (позволяющего осуществлять трехмерное сканирование), выбрали доступную для оптического наблюдения артериолу под кожей и повредили эндотелий лазером. Антитела начали присоединяться к растущему тромбу, сделав возможным его наблюдение.
Классическая постановка эксперимента по свертыванию in vitro заключается в том, что плазма крови (или цельная кровь) смешивается в некоторой емкости с активатором, после чего производится наблюдение за процессом свертывания. По методу наблюдения экспериментальные методики можно разделить на следующие типы:
Второй подход дает несравненно больше информации. Теоретически, зная концентрации всех факторов в произвольный момент времени, можно получить полную информацию о системе. На практике исследование даже двух белков одновременно дорого и связано с большими техническими трудностями.
Наконец, свертывание в организме протекает неоднородно. Формирование сгустка запускается на поврежденной стенке, распространяется с участием активированных тромбоцитов в объеме плазмы, останавливается с помощью эндотелия сосудов. Адекватно изучить эти процессы с помощью классических методов невозможно. Вторым важным фактором является наличие потока крови в сосудах.
Осознание этих проблем привело к появлению, начиная с 1970-х годов, разнообразных проточных экспериментальных систем in vitro. Несколько больше времени потребовалось на осознание пространственных аспектов проблемы. Только в 1990-е годы стали появляться методы, учитывающие пространственную неоднородность и диффузию факторов свертывания, и только в последнее десятилетие они стали активно использоваться в научных лабораториях (рис. 5).
Рисунок 5. Пространственный рост фибринового сгустка в норме и патологии. Свертывание в тонком слое плазмы крови активировалось иммобилизованным на стенке тканевым фактором. На фотографиях активатор расположен слева. Серая расширяющаяся полоса — растущий фибриновый сгусток.
Наряду с экспериментальными подходами для исследований гемостаза и тромбоза также используются математические модели (этот метод исследований часто называется in silico [8]). Математическое моделирование в биологии позволяет устанавливать глубокие и сложные взаимосвязи между биологической теорией и опытом. Проведение эксперимента имеет определенные границы и сопряжено с рядом трудностей. Кроме того, некоторые теоретически возможные эксперименты неосуществимы или запредельно дороги вследствие ограничений экспериментальной техники. Моделирование упрощает проведение экспериментов, так как можно заранее подобрать необходимые условия для экспериментов in vitro и in vivo, при которых интересующий эффект будет наблюдаем.
Регуляция системы свертывания
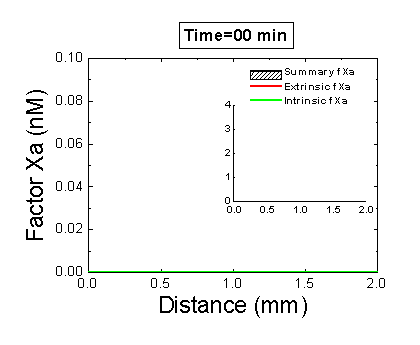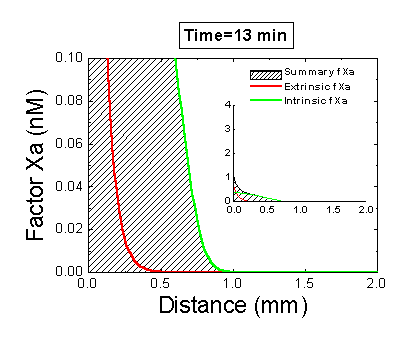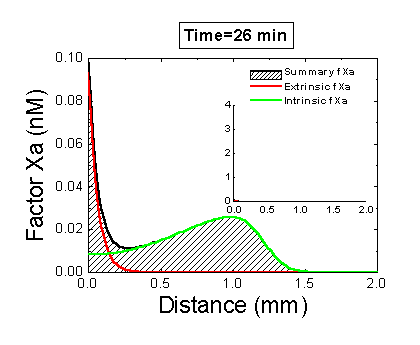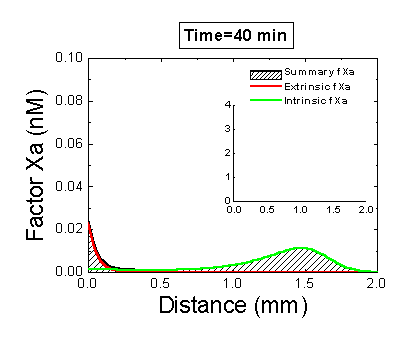
Рисунок 6. Вклад внешней и внутренней теназы в формирование фибринового сгустка в пространстве. Мы использовали математическую модель, чтобы исследовать, как далеко может простираться влияние активатора свертывания (тканевого фактора) в пространстве. Для этого мы посчитали распределение фактора Xa (который определяет распределение тромбина, который определяет распределение фибрина). На анимации показаны распределения фактора Xa, произведенного внешней теназой (комплексом VIIa–TF) или внутренней теназой (комплексом IXa–VIIIa), а также общее количество фактора Xa (заштрихованная область). (Вставка показывает то же самое на более крупной шкале концентраций.) Можно видеть, что произведенный на активаторе фактор Xa не может проникнуть далеко от активатора из-за высокой скорости ингибирования в плазме. Напротив, комплекс IXa–VIIIa работает вдали от активатора (т.к. фактор IXa медленнее ингибируется и потому имеет большее расстояние эффективной диффузии от активатора), и обеспечивает распространение фактора Xa в пространстве.
Сделаем следующий логический шаг и попробуем ответить на вопрос — а как описанная выше система работает?
Каскадное устройство системы свертывания
Запуск свертывания и роль положительных обратных связей
Как упоминалось в первой части статьи, многие реакции свертывания медленны. Так, факторы IXa и Xa сами по себе являются очень плохими ферментами и для эффективного функционирования нуждаются в кофакторах (факторах VIIIa и Va, соответственно). Эти кофакторы активируются тромбином: такое устройство, когда фермент активирует собственное производство, называется петлей положительной обратной связи.
Как было показано нами экспериментально и теоретически, положительная обратная связь активации фактора V тромбином формирует порог по активации — свойство системы не реагировать на малую активацию, но быстро срабатывать при появлении большой. Подобное умение переключаться представляется весьма ценным для свертывания: это позволяет предотвратить «ложное срабатывание» системы.
Роль внутреннего пути в пространственной динамике свертывания
Одной из интригующих загадок, преследовавших биохимиков на протяжении многих лет после открытия основных белков свертывания, была роль фактора XII в гемостазе. Его дефицит обнаруживался в простейших тестах свертывания, увеличивая время, необходимое для образования сгустка, однако, в отличие от дефицита фактора XI, не сопровождался нарушениями свертывания.
Один из наиболее правдоподобных вариантов разгадки роли внутреннего пути был предложен нами с помощью пространственно неоднородных экспериментальных систем. Было обнаружено, что положительные обратные связи имеют большое значение именно для распространения свертывания. Эффективная активация фактора X внешней теназой на активаторе не поможет сформировать сгусток вдали от активатора, так как фактор Xa быстро ингибируется в плазме и не может далеко отойти от активатора. Зато фактор IXa, который ингибируется на порядок медленнее, вполне на это способен (и ему помогает фактор VIIIa, который активируется тромбином). А там, куда сложно дойти и ему, начинает работать фактор XI, также активируемый тромбином. Таким образом, наличие петель положительных обратных связей помогает создать трехмерную структуру сгустка.
Путь протеина С как возможный механизм локализации тромбообразования
Активация протеина С тромбином сама по себе медленна, но резко ускоряется при связывании тромбина с трансмембранным белком тромбомодулином, синтезируемым клетками эндотелия. Активированный протеин С способен разрушать факторы Va и VIIIa, на порядки замедляя работу системы свертывания. Ключом к пониманию роли данной реакции стали пространственно-неоднородные экспериментальные подходы. Наши эксперименты позволили предположить, что она останавливает пространственный рост тромба, ограничивая его размер.
Подведение итогов
В последние годы сложность системы свертывания постепенно становится менее загадочной. Открытие всех существенных компонентов системы, разработка математических моделей и использование новых экспериментальных подходов позволили приоткрыть завесу тайны. Структура каскада свертывания расшифровывается, и сейчас, как мы видели выше, практически для каждой существенной части системы выявлена или предложена роль, которую она играет в регуляции всего процесса.
На рисунке 7 представлена наиболее современная попытка пересмотреть структуру системы свертывания. Это та же схема, что и на рис. 1, где разноцветным затенением выделены части системы, отвечающие за разные задачи, как обсуждалось выше. Не все в этой схеме является надежно установленным. Например, наше теоретическое предсказание, что активация фактора VII фактором Xa позволяет свертыванию пороговым образом отвечать на скорость потока, остается пока еще непроверенным в эксперименте.
Рисунок 7. Модульная структура системы свертывания: роль отдельных реакций свертывания в функционировании системы.
Вполне возможно, что эта картина еще не вполне полна. Тем не менее, прогресс в этой области в последние годы вселяет надежду, что в обозримом будущем оставшиеся неразгаданные участки на схеме свертывания обретут осмысленную физиологическую функцию. И тогда можно будет говорить о рождении новой концепции свертывания крови, пришедшей на смену старинной каскадной модели, которая верно служила медицине на протяжении многих десятилетий.
Статья написана при участии А.Н. Баландиной и Ф.И. Атауллаханова и была в первоначальном варианте опубликована в «Природе» [10].