Что принимать при бронхоспазме
Бронхиальная астма физического напряжения и методы ее лечения
Рассмотрены особенности клинического проявления бронхиальной астмы физического напряжения, обсуждены медикаментозные методы лечения заболевания. Показано, что использование левокарнитина приводит к формированию толерантности к физической нагрузке у детей
Characteristics of clinical presentation of physical tension bronchial asthma were considered, medication methods of the disease treatment were discussed. Using of BT factor was stated to form tolerance to physical activity among children with bronchial asthma.
В последние десятилетия отмечается значительный рост интереса специалистов к проблеме бронхиальной астмы и физической нагрузки. Это связано, с одной стороны, с созданием удобной модели для изучения обратимого бронхоспазма у больных, страдающих бронхиальной астмой, с другой стороны, с постоянно интригующей загадкой для специалистов в виде необоснованной легкости возникновения приступа и быстротой его обратного развития. Актуальность проблемы обусловлена и необходимостью создания рефрактерности больного к физической нагрузке. Наличие физической дезадаптации больного бронхиальной астмой — это один из основных психоэмоциональных стрессовых факторов, мешающих нормальному образу жизни пациента. Особенно важной эта проблема становится у детей, для которых характерен подвижный образ жизни. Астма физического напряжения (Exercise-induced asthma, EIA) довольно часто отмечается и у взрослых людей, когда они подвергаются сильной и длительной физической нагрузке. У взрослых, больных бронхиальной астмой, сформированная физическая интолерантность приводит к потере работоспособности и ранней инвалидизации.
Под астмой физического напряжения понимают острый, обычно произвольно проходящий бронхоспазм, наступающий во время физической нагрузки или непосредственно сразу после нее. По литературным данным, частота астмы напряжения варьирует от 30% до 90% в зависимости от применяемых критериев определения болезни и исследования [23, 29, 36]. Симптомы и обострения бронхиальной астмы провоцируются многочисленными триггерами, в том числе вирусными инфекциями, аллергенами, физической нагрузкой, табачным дымом и другими поллютантами. В одном из последних международных документов по бронхиальной астме у детей констатируется [38], что возраст и характерные триггеры могут быть использованы для выделения фенотипов заболевания (рис. 1).
По мнению 44 международных экспертов из 20 стран, выделение отдельных фенотипов может быть целесообразным, поскольку бронхиальная астма у детей является гетерогенной. Будучи частью «синдрома астмы», фенотипы бронхиальной астмы не являются отдельными заболеваниями. Рекомендации, учитывающие различные фенотипы астмы, должны помочь оптимизировать тактику лечения и прогноз.
Использование самых современных иммунологических и инструментальных методов исследования позволяют однозначно придти к выводу, что физическая нагрузка является одним из важнейших неиммунологических и нефармакологических стимулов, которые приводят к развитию острого спазма дыхательных путей у больных с бронхиальной астмой. Астма физического усилия — это одно из проявлений гиперчувствительности дыхательных путей, а не особая форма астмы. По мнению ряда исследователей, понятие «бронхиальная астма физической нагрузки» подразумевает развитие постнагрузочного бронхоспазма у больных атопической бронхиальной астмой. Это мнение нашло отражение в материалах Консенсуса «Бронхиальная астма. Глобальная стратегия» (2008–2011) и «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2006), в клинических материалах для педиатров «Аллергология и иммунология» под редакцией А. А. Баранова и Р. М. Хаитова (2011) [1–3].
Признаки EIA достаточно хорошо выявляются с помощью сбора анамнеза и объективного обследования во время проведения функциональных нагрузочных тестов.
После физической нагрузки (бег, тестирование на велоэргометре или степ-тесте) в течение 6 мин у части больных с бронхиальной астмой отмечается бронхоспазм, остро развившийся через 2, 5 или 10 мин. Наступившая обструкция дыхательных путей обычно ощущается пациентом как удушье и легко регистрируется с помощью функциональных тестов, отражающих скоростные изменения выдыхаемого потока воздуха — пиковая скорость выдоха (ПСВ), максимальная объемная скорость (МОС25, 50, 75), объем форсированного выдоха за 1 сек (ОФВ1) [16, 37]. В течение первых нескольких минут нагрузки отмечается фаза расширения бронхов, которая в конце нагрузочной пробы сменяется бронхоспазмом [36]. EIA страдают до 90% больных бронхиальной астмой и 40% пациентов с аллергическим ринитом; среди атлетов и в общей популяции распространенность колеблется от 6% до 13%. EIA часто остается не выявленной. Приблизительно 9% больных EIA не имеют никаких клинических признаков астмы или аллергии [9].
Большинство больных с тяжелой формой бронхиальной астмы уже через 3–4 мин нагрузки вынуждены прервать проведение пробы из-за быстро наступившего бронхоспазма. На протяжении последующих 30–60 мин бронхоспазм проходит. В этот период больной рефрактерен к физической нагрузке, и только после его окончания повторная нагрузка вновь приводит к развитию обратимого, но значительно менее выраженного бронхоспазма [17, 24].
Следует различать два часто используемых в литературе термина:
Снижение ОФВ1 по сравнению с донагрузочным более чем на 15% обычно указывает на наличие EIA. По данным ряда исследований, показатель ОФВ0,5 описывает бронхоконстрикцию лучше, чем ОФВ1, и лучше коррелирует со степенью выраженности клинических симптомов бронхиальной астмы. Снижение ОФВ0,5 на 13% по сравнению с донагрузочным значением является достоверным клиническим параметром наличия астмы физического напряжения [35].
Патогенез обратимой обструкции при астме физического усилия, несмотря на интенсивное изучение, остается не до конца уточненным [7, 9, 18].
Одним из основных механизмов является охлаждение слизистой дыхательных путей вследствие гипервентиляции, обусловленной физической нагрузкой (так называемая респираторная потеря тепла). Охлаждение дыхательных путей — это один из основных пусковых механизмов EIA, так как даже одна гипервентиляция без физической нагрузки, вызывающая снижение температуры слизистой, может привести к бронхоспазму [35, 37].
Высушивание слизистой оболочки дыхательных путей за счет респираторной потери воды приводит к повышению осмолярности на поверхности слизистой. Это, в свою очередь, ведет к дегрануляции тучных клеток и раздражению ирритантных рецепторов слизистой оболочки дыхательных путей [15, 25].
Легочный сурфактант препятствует спадению узких дыхательных путей. Воспаление, сопровождающееся пропотеванием плазменных белков в просвет дыхательных путей, приводит к потере сурфактантом части этих свойств, особенно в условиях понижения температуры слизистой оболочки бронхов во время физических упражнений или в холодное время года у больных с EIA [14].
Для понимания механизма бронхоспазма, возникающего у больных с EIA, представляется интересным сообщение группы японских исследователей, изучавших состояние адренорецепторного аппарата клеток у больных с бронхиальной астмой. У больных с EIA имеет место несоответствие между концентрацией адреналина во время физической нагрузки и количеством рецепторов, способных воспринять этот медиатор [23].
Вполне вероятно, что патогенез EIA многофакторный и зависит, в первую очередь, от баланса гуморальных и нервных механизмов регуляции бронхотонуса.
Несмотря на имеющиеся противоречия, неуточненный патогенез заболевания, следует признать правомочность следующего суждения: у больных EIA астма возникла не вследствие физической нагрузки, и физическая нагрузка не является единственным провоцирующим фактором у этих пациентов. Реакция на физическую нагрузку есть проявление сформировавшейся гиперреактивности бронхов, присущей любой форме бронхиальной астмы.
Медикаментозные методы лечения EIA
Большое количество лекарств блокирует постнагрузочный бронхоспазм. Короткодействующие бета-2-агонисты обеспечивают защиту 80–95% больных EIA с незначительным побочным эффектом, М-холинолитики — 50–70%. Эти препараты долгие годы рассматривались как терапия первой линии. С созданием двух пролонгированных бронхолитических средств — сальметерола и формотерола — начался новый этап эффективного предотвращения постнагрузочного бронхоспазма. Ингаляция 50 мкг сальметерола защищает от EIA в течение 9 часов. Однако при продолжительном ежедневном приеме появляется тенденция к уменьшению эффективного времени защиты [9].
Хроническому аллергическому воспалению слизистой дыхательных путей придается ведущее значение в патогенезе EIA, однако данные об эффективности противовоспалительных препаратов у этой группы больных многочисленны, но противоречивы [21].
Назначение ингаляционных глюкокортикостероидов (ИКС) до нагрузки не предотвращает развитие удушья [19, 28, 29]. У 50% больных, получающих ингаляционные кортикостероиды с хорошо контролируемым эффектом лечения, сохраняются признаки EIA [21, 24]. У больных EIA 53% максимального профилактического эффекта будесонида было получено при назначении низких доз и 83% при назначении высоких доз. При EIA применение ИКС с профилактической целью требует назначения значительно больших доз, чем для осуществления контроля за заболеванием [29, 13]. У 59% больных, получающих будесонид и сальбутамол длительным курсом (22 мес), сохранились признаки EIA. Большие дозы ИКС могут контролировать бронхоспазм, вызываемый физической нагрузкой [13].
Заслуживают внимания сообщения об успешном использовании для предупреждения EIA ингибиторов или антагонистов лейкотриенов, влияющих на аллергическое воспаление слизистых дыхательных путей [8, 10].
Кромоглициевая кислота (Интал) эффективен у 70–87% больных с диагностированной EIA и имеет минимальный побочный эффект. Недокромил натрия (Тайлед) обеспечивает равнозначный защитный эффект у детей [20, 24]. Этот препарат предотвращает развитие бронхоспазма у части больных EIA. Причем протективный эффект сильнее при выраженном бронхоспазме [32]. Однако полученные в последнее время сведения о сравнительной с плацебо эффективности Интала ставят под сомнение целесообразность использования кромонов в лечении бронхиальной астмы.
Бронхоспастический эффект провокационного теста с физической нагрузкой не удалось выявить у 53% больных EIA, получавших Бета-каротин в суточной дозе 64 мг в сутки в течение 1 недели. Бета-каротин является активным антиоксидантным препаратом, что, по-видимому, объясняет этот эффект [26]. Аналогичный эффект был получен у 55% больных с EIA при назначении Ликопина, также относящегося к антиоксидантам, в дозе 30 мг в день в течение 1 недели, предшествующей провокационной пробе [27].
Возможности применения метаболиков (левокарнитина) у детей с бронхиальной астмой со сниженной толерантностью к физической нагрузке
Использование короткодействующих бета-2-агонистов и М-холинолитиков эффективно предотвращает формирование постнагрузочного бронхоспазма у большинства больных бронхиальной астмой. Однако использование медикаментозной защиты у больных бронхиальной астмой перед предполагаемой физической нагрузкой, иногда даже незначительной, не всегда оправдано, так как подчеркивает психосоциальную дезадаптацию пациента. Поэтому во всем мире продолжается активный поиск новых препаратов, обладающих профилактическим действием в отношении постнагрузочного бронхоспазма.
Достаточно перспективный путь в лечении и профилактике постнагрузочного бронхоспазма — это использование метаболиков. Медикаментозная коррекция метаболических нарушений может привести к формированию толерантности к физической нагрузке у больных бронхиальной астмой.
Левокарнитин является активным метаболиком и существенно влияет на биоэнергетические процессы. Играет жизненно важную роль в обеспечении физиологических функций организма и поддержании здоровья.
Любая физическая нагрузка выполняется с затратами энергии. Единственным источником энергии для мышечного сокращения служит аденозинтрифосфат (АТФ). Именно карнитин принимает непосредственное участие в катаболизме липидов, обеспечивая его начальные этапы — перенос длинноцепочечных жирных кислот в виде сложных эфиров из цитоплазмы через наружную и внутреннюю митохондриальные мембраны в матрикс митохондрий.
Энергетические возможности организма являются одним из наиболее важных факторов, лимитирующих его физическую работоспособность.
Целью нашего исследования явилось изучение возможности использования левокарнитина (препарата Элькар®) для профилактики постнагрузочного бронхоспазма у детей с бронхиальной астмой.
Задачи исследования
Материалы и методы. Обследован 61 ребенок в возрасте от 6 до 18 лет, страдающий бронхиальной астмой. Основная группа — дети с бронхиальной астмой (n = 39), имеющие подтвержденный постнагрузочный бронхоспазм и получающие левокарнитин (Элькар®) ежедневно в течение 2 месяцев в дозах, рекомендованных производителем (по 200–300 мг 2–3 раза/сут, суточная доза — 400–900 мг). Контрольная группа (n = 22) левокарнитин не получала. Наличие постнагрузочного бронхоспазма было верифицировано с помощью стандартного нагрузочного теста.
Нагрузочный тест. Нагрузочная проба была проведена на велоэргометре, степ-тесте или тредмиле. Проба двухступенчатая с мощностью нагрузки 1–1,5 и 2–2,5 Вт/кг до выявления пороговой реакции. Время проведения пробы — 6 минут. Частота вращения педалей на велоэргометре — 60 об./мин. Проба проводилась с одетым носовым зажимом. До пробы у больного регистрировали ЭКГ и проводили спирографическое исследование. Непосредственно перед исследованием осуществляли подсчет пульса, измерение АД, пикфлоуметрию. В дальнейшем подсчет пульса проводился на 3-й минуте от начала проведения пробы и через 5 минут после ее окончания. АД измеряли сразу и через 5 минут после окончания пробы. Выявление нарушения бронхиальной проходимости регистрировалось с помощью пикфлуометра (ПСВ) и контролировалось аускультативно и с помощью спирограммы.
Нагрузочная проба считалась положительной при появлении клинически выявленного бронхоспазма (ослабление дыхания), сухих свистящих хрипов и/или снижении показателей ПСВ через 5 минут от окончания тренировки на 15% и более по данным пикфлоуметрии и/или других «скоростных» показателей спирографии (ОФВ1, МОС25, 50, 75).
Физическая работоспособность (Physical Work Capacity, РWС) определена расчетным методом с помощью модифицированной формулы, предложенной В. Л. Карпманом (1969) [5]:
PWC170 = N нагрузки × (170 — СС покоя)/ЧСС при 2-й нагрузке — ЧСС покоя (кг × м/мин)
Особенности реакции гемодинамики на нагрузку определяли по следующим показателям:
(S — поверхность тела в м 2 );
ИК = (1 — ДАД/ЧСС) × 100
Использовались следующие функциональные методики:
1) спирография с анализом кривой поток–объем (до и после окончания курса лечения левокарнитином);
2) дыхательное мониторирование [4];
3) электрокардиографическое исследование;
4) нагрузочные пробы с функциональным контролем показателей дыхательной и сердечно-сосудистой систем проведены у обследованных детей до начала лечения левокарнитином (препаратом Элькар®) и после окончания 2-месячного курса лечения.
Результаты исследования
Представлены результаты обследования и лечения 61 ребенка с бронхиальной астмой. Дети в возрасте до 7 лет составляли 1,6%, от 7 до 10 лет — 24,6% и старше 10 лет — 73,8%. Соотношение мальчиков и девочек — 2,8:1. У 78,7% больных выявлена бытовая сенсибилизация, у 21,3% — сочетание бытовой и пыльцевой аллергии. Больные с легким и среднетяжелым течением составили 80,3%. Связь приступов удушья с физической нагрузкой отмечалась у 63,9% детей, с резкими запахами — у 37,7%, с переменой погоды — у 41%. Проявления пищевой аллергии наблюдались у 36,1% больных. Средний возраст формирования бронхиальной астмы составил 8 лет 2 месяца, средняя продолжительность заболевания на момент обследования — 7 лет 4 месяца. Больные получали базисную терапию ингаляционными глюкокортикостероидами в дозе от 200 до 800 мкг по беклометазону.
В табл. 1 представлены данные о формировании толерантности к физической нагрузке у детей с бронхиальной астмой в процессе лечения левокарнитином (препаратом Элькар®). У 15,3% больных основной группы до лечения отмечена положительная реакция на нагрузку 1,0 Вт/кг, что свидетельствовало о крайней степени дезадаптации к физической нагрузке и высокой степени гиперреактивности бронхов. У 56,4% тест оказался положительным на нагрузку 1,5 Вт/кг и у 28,3% — на 2,0 Вт/кг. Вполне сопоставимые результаты были в контрольной группе: у 18,2% больных отмечена положительная реакция уже на нагрузку 1,0 Вт/кг, у 68,2% — на нагрузку 1,5 Вт/кг и у 13,6% нагрузка в 2,0 Вт/кг вызывала бронхоспазм (табл. 1).
После окончания 2-месячного курса левокарнитина толерантность у больных достоверно возросла (р
Г. А. Новик, доктор медицинских наук, профессор
ГБОУ ВПО СПбГПМА Минздравсоцразвития России, Санкт-Петербург
«Ловушки», в которые можно угодить при лечении бронхиальной астмы
Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ? С чем связаны возможны
 |
| Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания |
Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ?
С чем связаны возможные ошибки в диагностике?
Какова основная роль b-агонистов в терапии бронхиальной астмы?
Как назначаются кортикостероиды?
Несмотря на возросшую компетентность врачей и доступность эффективных методов лечения, смертность от бронхиальной астмы остается высокой. Предотвратить многие смертельные исходы и даже избежать большинства случаев госпитализации можно было бы при проведении правильного лечения.
Необходимо помнить, что ведение больных астмой — процесс сложный и длительный.
Недооценка степени несостоятельности дыхания. Тяжесть состояния пациента и степень несостоятельности его дыхательной системы можно не распознать, если пренебречь тщательным выяснением всех проявлений болезни и построением диаграммы измерений максимальной скорости потока (МСП) выдыхаемого воздуха.
Зачастую у больных астмой снижены виды на будущее, хотя некоторые и склонны недооценивать серьезность симптомов своего заболевания. Чтобы выявить такую недооценку, нужно подробно расспросить пациента, бывает ли у него кашель или хриплое дыхание ночью или при физической нагрузке.
Если пациентам не удается достичь наилучшей возможной функции легких, то для коррекции этого состояния необходимо для начала вычислить нормальную МСП выдыхаемого воздуха для данного пациента, пользуясь диаграммой, прилагаемой к пикфлуометру.
Если измеренная МСП более чем на 20% меньше вычисленной, стоит провести исследование обратимости этого состояния, что делается путем сопоставления МСП или жизненной емкости легких (ЖЕЛ) до и после лечения.
Необходимая терапия может состоять всего лишь в однократном приеме бронходилятатора, но если это не увеличивает МСП на 20%, то есть до вычисленного уровня, могут понадобиться более серьезные меры, например трехнедельный курс системных кортикостероидов (30 мг преднизолона в день для взрослых). Таким образом выясняется наилучший достижимый уровень МСП, на который ориентируются в последующем лечении.
Иногда пациенты сообщают об уменьшении одышки, но при этом значения МСП не изменяются. В таких случаях необходимо провести измерение ЖЕЛ с помощью спирометра, которое может подтвердить улучшение, не определяемое по МСП (рис. 2). Спирометрами в настоящее время укомплектованы все врачебные приемные.
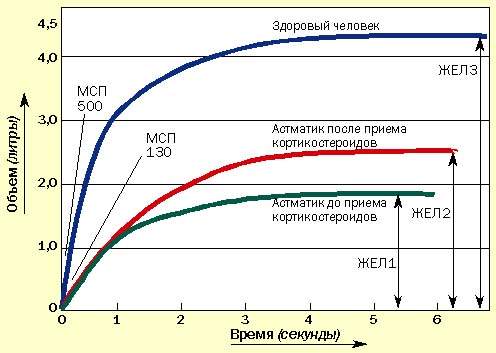 |
| Рисунок 2. Изменение ЖЕЛ под влиянием курса кортикостероидов. МСП может не измениться, но увеличение ЖЕЛ свидетельствует об улучшении состояния |
Бронхиальная астма, замаскированная под хроническое обструктивное заболевание легких (ХОЗЛ). Страдающие одышкой пациенты, которым поставлен диагноз ХОЗЛ или эмфизема, могут иметь скрытый бронхоспастический элемент, обусловленный бронхиальной астмой.
Таким пациентам необходимо провести исследование обратимости процесса, как описано выше. Любое улучшение функции легких можно поддержать, проводя адекватное лечение бронхиальной астмы. При отсутствии улучшения легочной функции назначение кортикостероидов ничем не оправдано, а только приводит к нежелательным побочным эффектам, таким как остеопороз.
Что должен помнить врач, наблюдающий больных с бронхиальной астмой
Постоянный прием b-агонистов короткого действия. Показано, что лечение астмы постоянным приемом b-агонистов увеличивает гиперреактивность легких и утяжеляет бронхиальную астму [1]. Если пациент использует b-агонисты скорее регулярно, чем случайно, их применение должно сопровождаться назначением ингаляционных кортикостероидов или, если кортикостероиды уже применяются, увеличением их дозы до достаточной, чтобы контролировать астму. Таким образом, b-агонисты оставляют на случаи одышки и хрипов.
Последние методические указания по лечению бронхиальной астмы в Британии рекомендуют начинать с высокой дозы ингаляционных или системных кортикостероидов для достижения быстрого контроля, затем постепенно снижать дозу до минимальной, обеспечивающей нормальное самочувствие пациента и оптимальные значения МСП или ЖЕЛ на фоне минимального применения бронходилятатора (рис. 3). Быстрое облегчение состояния, достигаемое при применении кортикостероидов, улучшает настроение пациента и увеличивает его доверие к лечению.
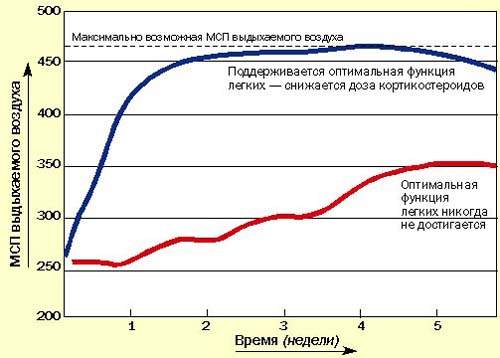 |
| Рисунок 3. Рекомендуется начинать с высоких доз кортикостероидов, а затем постепенно снижать дозу до минимальной (оптимальные значения МСП или ЖЕЛ) |
Последние данные свидетельствуют о том, что назначать кортикостероиды нужно как можно раньше всем астматикам, и не только для контролирования симптомов, но и для предотвращения прогрессирующих структурных повреждений легких, обусловленных хроническим воспалением [2,3]. Это означает, что кортикостероиды следует предпочесть b-агонистам, как только диагноз подтверждается МСП-диаграммой. b-агонисты остаются препаратами резерва на крайний случай.
Возможность альтернативного лечения. Хотя ингалируемые кортикостероиды должны быть краеугольным камнем в лечении астмы, в случаях, трудно поддающихся лечению, можно использовать и некоторые другие препараты. Доказано, что противовоспалительным эффектом обладают теофиллины в достаточно небольших дозах, но надо учитывать в каждом индивидуальном случае их возможное взаимодействие с другими препаратами.
Пожилым пациентам целесообразно назначать ипратропиум. Иногда оказываются эффективными недокромил и кромогликат.
Бронходилятаторы длительного действия, такие как сальметерол, могут облегчать состояние, особенно ночью, блокируя бронхоконстрикторные механизмы. Однако необходимо, чтобы все вышеперечисленные препараты сопровождались применением адекватных доз кортикостероидов.
Техника ингаляции. Нужно добиться, чтобы у пациентов выработались правильные навыки обращения с ингалятором. Врач должен помочь подобрать тот тип ингалятора, который наиболее удобен пациенту, и проверить его работоспособность. Для этого в кабинете врача должен быть полный набор ингаляторов.
Спейсеры. Применяемые вместе с аэрозольными ингаляторами, спейсеры облегчают проникновение препарата в легкие и снижают как накопление его в глотке, так и системное всасывание за счет проглатывания.
Спейсеры помогают координировать выброс препарата со вдохом. Это особенно важно при ингалировании кортикостероидов. Так как кортикостероиды применяются только дважды в день, громоздкий спейсер можно хранить дома.
Спейсеры обеспечивают лучшее накопление препарата в легких, чем распылители. Необходимо правильно их применять: встряхнуть ингалятор, чтобы лекарство смешалось с носителем, и однократно впрыснуть смесь с последующим скорейшим вдохом [4].
Триггерные факторы. Нераспознанные триггерные факторы могут быть и дома, и на работе, и на отдыхе, то есть практически в любом месте. Выявить источник поможет анамнез. Например, при профессиональной бронхиальной астме состояние улучшается во время отпуска и в выходные дни. Отсутствие раздражителя уменьшает или устраняет проявления болезни и снижает необходимость в лекарствах.
Проблемой, которую часто не принимают во внимание, может быть пассивное курение. Такие препараты, как b-блокаторы и нестероидные противовоспалительные средства (НПВС), также могут вызывать астму.
Использование распылителей (небулайзеров) без фоновой кортикостероидной терапии. При лечении острого астматического приступа без назначения пероральных кортикостероидов все еще используют распылители, которые обеспечивают проникновение более высокой дозы b-агонистов. Это действительно снимает бронхоспазм, но поскольку высокая доза b-агонистов не воздействует на сопутствующий воспалительный процесс, необходимо сразу же дать больному кортикостероиды внутрь, чтобы предотвратить нарастание приступа; эффект бронходилятаторов снижается по мере увеличения отека слизистой.
Если тяжесть приступа такова, что требуется небулайзер, необходимо назначить системные кортикостероиды. Даже при умеренном приступе бронходилятаторы сами по себе приносят лишь временное облегчение и есть опасность повторения приступа — возможно, глубокой ночью!
Несвоевременное назначение оральных кортикостероидов. Если не проводить противовоспалительной терапии, у больных нарастает отек слизистой, что приводит к повторению приступов. Такие пациенты часто нуждаются в госпитализации и назначении высоких доз кортикостероидов в течение нескольких дней, прежде чем у них наступит стабилизация состояния.
Пациенты, подверженные быстроразвивающимся приступам, нуждаются в как можно более раннем назначении кортикостероидов и бронходилятаторов. Они должны уметь распознавать ухудшение состояния, всегда иметь под рукой кортикостероиды и знать, как их использовать. Не следует заставлять этих пациентов дожидаться прихода к ним врача (рис. 4).
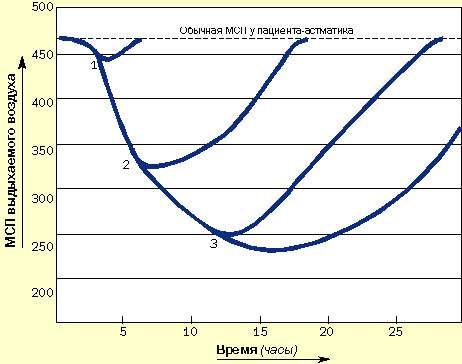 |
| Рисунок 4. Зависимость развития острых приступов от времени назначения кортикостероидов и как результат применения длительных курсов системной кортикостероидной терапии. (1) Кортикостероиды назначены сразу после возникновения приступа: выздоровление наступает быстро. (2) Кортикостероиды назначены через 6 часов: выздоровление замедлено. (3) Кортикостероиды назначены позже чем через 12 часов: приступ тяжелый и длительный, выздоровление наступает медленно |
Пациенты с постепенным развитием приступов могут подождать и посмотреть, помогает ли увеличенная доза ингаляционных кортикостероидов в сочетании с бронходилятаторами.
Неадекватный курс системных кортикостероидов. Иногда назначенные кортикостероиды отменяют до полного купирования приступа, что ведет к сохранению гиперреактивности бронхов и очередному приступу.
Подобная цепь событий может привести пациента к ложному заключению, что у него бронхиальная астма, трудно поддающаяся лечению.
Ситуацию можно исправить длительным курсом кортикостероидов, продолжающимся в течение нескольких дней после стабилизации состояния, и снижением их дозы постепенно до достижения минимальной поддерживающей.
Прекращение наблюдения за пациентом после острого приступа или госпитализации. Трудности возникают при отмене системного кортикостероида и назначении ингаляционного. В этот переходный период необходимо тщательное наблюдение; по достижении стабилизации состояния дозу ингалируемого кортикостероида постепенно снижают до минимально необходимой, чтобы заболевание никак себя не проявляло и функция легких была оптимальной.
Целью последующего лечения становится поддержание наивысшей МСП, достигнутой в больнице после курса системных кортикостероидов.
Консультация, проведенная через некоторое время после выписки, дает хорошую возможность проверить план ведения пациента, выяснить, что не так, и внести соответствующие поправки.
Кашель и хрипы с гнойной мокротой иногда принимают за легочную инфекцию. Однако мокрота больных астмой содержит гораздо больше эозинофилов, чем полиморфных клеток и бактерий. В пожилом возрасте левожелудочковая недостаточность и сердечная астма должны наводить на мысль о предшествующей бронхиальной астме. Будьте осторожны с b-блокаторами!
Внезапная одышка может быть обусловлена пневмотораксом или легочной эмболией. Хрипы встречаются при туберкулезе легких, бронхиальной карциноме или инородном теле и могут быть четко локализованы. Следовательно, у любого пациента с астмой, развившейся во взрослом возрасте, необходимо провести рентгенологическое исследование органов грудной клетки.
После установления диагноза основная цель врача — освободить пациента от проявлений болезни и оптимизировать функцию легких, а также установить контроль за болезнью. Для этого специально обученный медперсонал должен обучать больных и проверять правильность выполнения ими всех назначений.
Конечно, в некоторых случаях это может оказаться затруднительным, однако план предписанных действий способно усвоить абсолютное большинство больных.
Все пациенты должны:
Литература
1. Sears M. R., Taylor D. R. et al. Regular inhaled b-agonist treatment in bronchial asthma. Lancet 1990;336:1491–1396.
2. Tari Haahtela et al. Comparinson of terbutaline with budesonide in newly detected asthma. N Engl J Med 1991;325:388–392.
3. Redingon A. K., Howarth P. H. Airway remodelling in asthma. Thorax 1997;52:310–312.
4. O’Callaghan C., Barry P. Spacer devices in the treatment of asthma. BMJ 1997;314:1061–1062.
Спирометрия при хронической бронхиальной астме
Бочкообразная грудная клетка при хронической бронхиальной астме возникает из-за задержки воздуха в периферических отделах легких, что приводит к постоянному поддержанию грудной клетки в состоянии вдоха. Задержанный воздух не выдыхается и бесполезно занимает большую часть легких (остаточный объем). Это снижает объем воздуха (жизненную емкость легких), входящего в легкое.
Воздух задерживается из-за хронического воспаления, вызывающего отек слизистой периферических бронхиол. При лечении кортикостероидами отек спадает и воздух высвобождается. Это доказывается увеличением ЖЕЛ, определенной спирометрически. МСП может не изменяться (см. рис. 2.)
Обратите внимание!
Приступ астмы
Хроническая астма/ХОЗЛ
_575.gif)
.gif)