Что провоцирует повышение мочевой кислоты
Мочевая кислота как фактор риска ССО
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Я надеюсь, что следующая лекция тоже вызовет у нас вопросы – мы с вами подискутируем.
Сегодня мне выпало говорить о мочевой кислоте. Если честно, готовясь к этой лекции, я вначале сама запуталась. Фактор риска, не фактор риска? Что с этим делать. Надо нам ее снижать – как снижать и так далее.
Может быть, несколько путано, но я постараюсь вам рассказать о том, что удалось мне добыть в ответ на все эти вопросы.
«И это все о ней…» – я перефразировала название знаменитого фильма. Я думаю, что доктора, которые смотрят нас, помнят этот знаменитый фильм – «И это все о нем». Играл Игорь Костолевский, в которого была влюблена практически половина женского населения страны.
Если говорить о мочевой кислоте, то еще Мясников в своей лекции говорил: «… представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами метаморфоза – холестерином и мочевой кислотой».
Мое личное мнение, что это фактор риска сердечно-сосудистых заболеваний (ССЗ). С ним надо бороться. Попытаюсь доказать свою позицию.
Мочевая кислота – конечный продукт пуринового обмена. Мы видим, что для того чтобы она образовалась, необходима активность ксантин-оксидазы. Нужен ксантин. Мочевая кислота является конечным продуктом пуринового метаболизма. Это слабая органическая кислота, которая затем ионизируется в моно-натриевый урат.
Секретируется мочевая кислота почками. При почечной недостаточности у пациентов возможны признаки гиперурикемии.
Удаляется из организма с мочой. В меньшей степени – с фекалиями. Нам нужны нормы. Для женщин они несколько разные. Для взрослой женщины норма до 6 мг/дл. Для взрослых мужчин – до 6,8 мг/дл.
Причины очень легко подразделить на две большие части: повышенное образование мочевой кислоты и снижение выведения уратов.
Если говорить о повышенном образовании мочевой кислоты, то есть огромный спектр патологических состояний. Наследственные ферментные дефекты, псориаз, эритремия, опухоли, рабдомиолиз, ожирение. Очень неспецифический показатель, казалось бы.
Если говорить о ферментном дефекте, то те и те ферменты, которые участвуют в синтезе мочевой кислоты, могут подвергаться дефектным ферментам. Это гипоксантил-гуанин-фосфорибозил-трансфераза и аденин-фосфорибозил-трансфераза.
Если происходит либо частичная, либо полная потеря активности этих ферментов, то все это опосредуется в различные заболевания. Чаще всего это подагра. Это могут быть такие генетические синдромы, как синдром Леша-Нихена, синдром почечнокаменной болезни и так далее.
Ураты выводятся плохо. Чаще всего в этом повинны почки. Они демонстрируют проявления почечной недостаточности, диабета, ацидоза, саркоидоза. Или, например, применение различных препаратов. Но мы прекрасно знаем, что применение диуретиков в больших дозах, бесконтрольно (а иногда и не в очень больших дозах) тоже приводят к повышению уровня мочевой кислоты.
Вот эти портреты. Часто подагра – это болезнь богатых. Мы знаем очень много персонажей (авторы которых любили исторические детективы). Например, А. Дюма красочно описывал Мазарини, который страдал подагрой, и так далее.
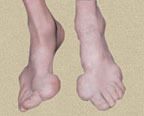
Боль в суставе первого пальца. Сустав красный. Он крайне болезненный. Болезнь настолько, что образно показывают, что как будто что-то разрывает. Рак сидит на этой области. Картинка вверху доказывает правильность моего утверждения, что это болезнь богатых.
Подагрические тофусы. Где их надо искать. На ушах, на пальцах. Я думаю, что с такими картинками вы тоже встречались, уважаемые коллеги. Если этот тофус вскрывается, то это совсем беда. Здесь нам могут помочь и обязательно нужны еще и хирурги.
Но сегодня мы говорим о мочевой кислоте как о возможном факторе влияния на сердечно-сосудистый риск (ССР). Что это может обусловливать. Какие состояния для нас важны, чтобы сделать какую-то взаимосвязь между наличием мочевой кислоты и ее уровнем и ССР.
Увеличение мочевой кислоты приводит к увеличению адгезии и агрегации тромбоцитов. Изменяется функция эндотелия у этих пациентов. Замедляется окислительный метаболизм. Нарушается реологическое свойство крови. Разве этого не достаточно, чтобы повысить ССР.
Казалось бы, достаточно. Но давайте обратимся к медицине, основанной на доказательствах. Мы сейчас не можем делать ни одной лекции без этих слов. Я отношусь к этому по-своему. Тем не менее, принимая все эти правила, рассказываю о том, что сделано в этой сфере с позиции доказательной медицины в плане того, является ли мочевая кислота фактором риска ССЗ.
Более 50-ти лет об этом говорят. Очень много исследований. Первое исследование «The Chicago Heart Association on Detection Project in Industry The Chicago People’ s Gas Company Study» доказало, что уровень мочевой кислоты в крови является независимым фактором риска ССЗ. Но только у женщин. У мужчин такой зависимости не было.
Выполненные затем исследования тоже демонстрировали, что четкая связь между мочевой кислотой и ССЗ отмечалась именно у женщин. Очень известное исследование «NHANES», в котором оценивалась и поддержка нутриционная, доказало, что гиперурикемия независимо и значимо ассоциирована с риском смерти от ССЗ.
Данное исследование также показало, что гиперурикемия ассоциирована с развитием ИБС у пациентов, не употребляющих алкоголь и не ассоциирована с развитием ИБС у пациентов, употребляющих алкоголь в малых и умеренных количествах.
Я безумно счастлива. Ко мне присоединился профессор Агеев Таиль Фаипович. Мы долго не виделись. Еще я счастлива потому, что он присоединился именно на этом слайде. Я практически не даю ему возможности прочитать слайд. Но обращаюсь с вопросом.
Гиперурикемия ассоциирована с развитием ИБС у пациентов, не употребляющих алкоголь. При этом гиперурикемия не ассоциирована с развитием ИБС у пациентов, употребляющих алкоголь. Значит ли это, что алкоголь просто сам по себе является фактором риска, поэтому гиперурикемия размылась в этом. Как вы считаете?
Таиль Фаипович Агеев, профессор, доктор медицинских наук:
– Добрый день, уважаемые коллеги, уважаемая и любимая Оксана Михайловна. Чувствую себя в студии. Пришел – подключился к диалогу.
Проблема крайне важна. Но вы там не упомянули важный момент. На слайде есть маленькая, но крайне важная приписка: «Гиперурикемия при употреблении алкоголя в малых и умеренных количествах». Может быть, разгадка этой тайны связана с количеством этого алкоголя. Может быть, малое и умеренное количество…
Во всяком случае, принято считать, что малые дозы алкоголя даже что-то улучшают. Как это не страшно произносить.
Оксана Драпкина: Нас сегодня смотрят профессионалы, поэтому можно сказать.
Таиль Агеев: Это утверждение можно ассоциировать именно с этой припиской, которая является ключевой. Малое и умеренное количество, вероятно, оказывает какое-то защищающее влияние, в том числе и на обмен мочевой кислоты. Но это мое предположение.
Оксана Драпкина: Мои тоже предположения. Нам бы очень хотелось узнать у уважаемой аудитории. (Обращаясь к зрителям). Дорогие друзья, вы что думаете по этому поводу. Еще раз взгляните на слайд и напишите, какие мысли у вас есть по этому вопросу.
Следующее исследование. Я не буду их все перечислять. Попыталась сделать побольше противоречивых слайдов.
Это исследование рассказывает, что гиперурикемия является предиктором смертности от ССЗ уже у мужчин. Первые исследования доказывали наличие четкой связи с гиперурикемией у женщин, но не у мужчин. Дальнейшее исследование доказывает, что эта связь прослеживается в обоих полах. Конечно, она более слабая у мужчин.
Более близкое нам исследование «SHEP», в которое включались пожилые пациенты (значит, коморбидные) тоже доказало, что гиперурикемия является независимым предиктором сердечно-сосудистых событий у пожилых пациентов с изолированной ситолической артериальной гипертензией.
Исследование, результатам которого, как рассказывают некоторые очевидцы (что слышала – то передаю), аплодировали какое-то определенное время.
Исследование «LIFE», где тестировалась гипотеза о том, какие препараты, старые или новые (на тот момент новыми были сартаны) лучше в плане влияния на прогнозы ССО. Там боролись «Атенолол» («Atenolol») и «Лозартан» («Losartan»). Оно тоже доказало, что существует связь между гипреурикемией и ССО у женщин с АГ.
В этом же исследовании было продемонстрировано, что «Лозартан» способен снижать содержание мочевой кислоты. Сразу возникает вопрос. Один ли «Лозаратан» как представитель АТ-рецепторов…
Это класс-эффект или это уникальное свойство этой молекулы. Я тоже попыталась в этом разобраться. Анализ литературы диктует необходимость сделать мне такой вывод. Мое мнение сейчас склоняется в пользу того, что риск осложнений ССЗ у больных, например, с АГ и вообще с сердечно-сосудистой патологией зависит от концентрации мочевой кислоты.
В подтверждение этого хочу привести работу. Она не новая, 2000-го года. Но она хорошо структурирована. В зависимости от квартили концентрации мочевой кислоты изменяется стандартизированный по возрасту риск ССЗ в течение четырех лет, как у мужчин, так и у женщин.
Совсем свежие данные. Уверена, что вы слышали об этом интересном исследовании «Случай-контроль». Связь между применением антигипертензивных препаратов и риском развития подагры у больных с АГ.
Что нам это исследование дало. Очень кратко его охарактеризую. Это исследование 24-х тысяч пациентов с впервые установленным диагнозом подагры. Здоровые лица составили группу контроля, поэтому исследование «Случай-контроль». Они были в сетевой базе данных здравоохранения соединенного королевства.
Было много моментов, которые можно было обсудить. Сегодня предметом интереса является связь между приемом антигипертензивных препаратов и риском развития подагры. Что получилось у этих исследователей. На снижение уровня мочевой кислоты оказывают влияние только два класса препаратов. Это кальциевые блокаторы и «Лозартан». Не просто блокаторы АТ-рецепторов, а уникальная молекула «Лозартана».
Снижение в группе «Лозартана» более выражено. Про «Лозартан» я не сильно удивилась. Это было доказано после «LIFE». А про кальциевые блокаторы – меня это заставило посмотреть на очень неоднородную группу этих кальциевых блокаторов.
Остановлюсь на «Лозартане». Действительно урикозурический эффект известен. Он нами любим и используется. Этой молекуле свойственны противовоспалительные и антиагрегантные действия.
Я буду очень осторожна. Моделирующее небольшое антиатеросклеротическое действие. Улучшение когнитивной функции. Позитивное влияние на эректильную функцию.
Вернусь к исследованию «LIFE». Там было продемонстрировано не только то, что есть у этой молекулы антиурекимические свойства. Мы видим репрезентативное число пациентов – 9193.
Возрастная группа нашего любимого возраста пациентов, которые находятся на стационарном лечении. Наблюдение должно было быть 5 лет, срок наблюдения составил 4,8 лет. Исследование было завершено досрочно в связи с тем, что были получены неоспоримые доказательства хорошего эффекта «Лозартана».
Конечной точкой была сердечно-сосудистая смертность и фатальный и нефатальный ИМ. Антигипертензивный эффект был одинаковый. Так часто во многих исследованиях бывает. Получается, что в «Ascot» было практически также. Не будем сейчас об этом много говорить.
Снижение ССЗ и смертности на 13%, инсульта – на 25%. Особенно хорошо инсульт снижался в группе пациентов с изолированной систолической АГ. Мне кажется, что это было в основном из-за того, что когда было подисследование этого большого исследования «LIFE», оказалось, что влияние «Лозаратана» на фибрилляцию предсердий было четко продемонстрировано.
За счет чего «Лозартан» мог снижать развитие фибрилляции предсердий. За счет ли влияния на гипертрофию миокарда и, соответственно, замедления ремоделирования. Или за счет антифибротических свойств. Или это идет параллельно друг другу. На сегодняшний день это не совсем понятно.
Если говорить о том, что стимулируются АТ 2-рецепторы, то в них входит некий антифибротический эффект и другие благоприятные эффекты. Фиброз у таких пациентов – это основа тахиаритмии. Дезорганизованные пучки «рукавов» миокарда левого предсердия, которые находятся в устье легочных вен, густо окутаны легочной тканью у пациентов, например, с фибрилляцией предсердий.
Таким образом, у пациентов с фибрилляцией предсердий, особенно у пациентов с сахарным диабетом, фибротическая ткань достаточно выражена. Это приводит к тому, что это сердце предуготовано, в основном, к суправентрикулярным нарушениям ритма. Самое частое из них – фибрилляция предсердий.
Мы клинически видели влияние «Лозартана». Но в эксперименте показано, что «Лозартан» влияет именно на фиброз. Его влияние на фиброз чуть больше, чем у горячо любимого «Амлодипина».
То же самое было продемонстрировано на другом сартане – «Валсартане» («Valsartan»). Исследование, которое было опубликовано в 2008-м году. Применение «Валсартана» приводило к уменьшению синтеза коллагена первого типа, а также уровня альдостерона у больных с гипертрофической кардиомиопатией.
На мой взгляд, это очень перспективное еще одно направление, которое позволит показать новые свойства сартанов. У сартанов антифибротический эффект неплохо выявлен.
Заканчивая выступление, хочу сказать, как можно еще доказать, что мочевая кислота влияет на риск ССЗ. Готовясь к сегодняшней юбилейной интернет-сессии, я встретилась с этой работой. Работа по оценке эффективности высоких доз пуринола у пациентов с ИБС, с хронической стабильной стенокардией.
Что в этой работе получилось. Мне показалась она очень интересной. Она небольшая. 65 больных со стенокардией с положительной нагрузочной пробой. Эти больные разделяются на две группы: плацебо и аллопуринол. Перекрест, из-за которого мы на исследование полагаемся.
Те, кто получал аллопуринол, потом получали плацебо, и наоборот. Оказалось, что те, кто принимали аллопуринол, снижали уровень мочевой кислоты, лучше переносили стенокардию. У них была меньше депрессия сегмента ST и меньше приступов стенокардии.
Уважаемые коллеги. Мой ответ – да. Состояние чревоугодия, веселья, которое, с одной стороны, и продлевает жизнь, потому что стресса меньше. Но, с другой стороны, приводит к росту факторов риска развития неинфекционных заболеваний, которым служит повышение уровня мочевой кислоты. Это повод об этом задуматься и изучать возможности влияния на этот маркер.
Мочевая кислота повышена: причины гиперурикемии
Вместе с пищей, в организм человека попадает множество различных веществ. Среди них присутствуют и пуриновые молекулы. Оказавшись внутри, они распадаются под воздействием фермента ксантиноксидаза.
В результате появляется мочевая кислота, правильная концентрация которой очень важна для нормального функционирования организма. Отклонения от нормы могут быть спровоцированы как безобидными факторами, так и серьезными патологиями.
Гиперурикемия – это патология, развивающаяся на фоне излишнего наличия мочевой кислоты в организме человека. Она может быть врожденной или сопутствующей. Разделяют ее на два вида:
Симптоматика
Регулярные боли в животе — симптом повышенного уровня мочевой кислоты.
Незначительное повышение показателей не влияет на самочувствие человека. Опасным становится регулярное наличие высокого уровня мочевой кислоты.
Проявления заболевания у людей различны: у малышей, гиперурикемия сопровождает различные пеленочные дерматиты и высыпания.
Такие патологии характеризуются устойчивостью к выработанным способам лечения. Бывали случаи, когда борьба с заболеваниями шла годами, а о причине никто и не догадывался; у детей чуть постарше возможны такие симптомы:
у взрослого человека (наиболее распространено среди мужского пола) – появляются такие признаки:
Стабилизировать показатели мочевой кислоты получится только после избавления от болезни, которая привела к сбою в метаболизме пуриновых молекул.
Заболевания, влияющие на изменение мочевой кислоты
Артериальная гипертензия может вызвать появление гиперурикемии.
Среди патологий, которые могут сопутствовать гиперурикемии, выделяют следующие:
Как лечить подагру, смотрите в тематическом видеоролике:
Патологии крови
Повышение показателей мочевой кислоты сопутствует таким состояниям:
На фоне перечисленных болезней происходит сбой в обмене веществ пурина. Следствием подобного нарушения является развитие гиперурикемии.
Болезни паращитовидных желез
Повышенный уровень сахара в крови способствует вторичному развитию гиперурикемии.
Генетические предрасположенности
Частыми спутниками гиперурикемии являются синдромы:
Все они сопровождаются нарушениями в пуриновом обмене, из-за которого и возникает повышение конечного продукта.
Другие влияющие факторы
Неправильное питание ведет к развитию данного заболевания.
Помимо возникающих заболеваний, причинам гиперурикемии могут быть и такие действия:
Как справиться с гиперурикемией
Соблюдение диеты поможет вернуть в норму уровень мочевой кислоты.
В случае, если заболевания отсутствуют, а повышение вызвано неправильным образом жизни, для избавления от этой проблемы рекомендуется следующее:
Все перечисленные рекомендации следует выполнять только после консультации с врачом. Получив его одобрение, можно без опаски вступить на путь избавления от излишков мочевой кислоты.
Если не обращать внимания на симптомы и вовремя не обратиться за помощью, гиперурикемия может привести к очень серьезным осложнениям, вплоть до летального исхода. Не нужно шутить со своим здоровьем, оно одно на всю жизнь и заслуживает того, чтобы люди о нем заботились.
Диагностика и лечение подагрического артрита
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислот
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислоты (уратов) с развитием рецидивирующего острого артрита и образованием подагрических узелков (тофусов).
Подагра относится к «старым» болезням и известна со времен глубокой древности. Термин «подагра» происходит от греческих слов pus, что означает стопа, и agra — захват. Таким образом, уже в названии заболевания подчеркивается одно из кардинальных проявлений подагрического артрита. Подагра рассматривается не только как недуг, при котором патологический процесс локализуется в опорно-двигательном аппарате, но и как системное заболевание, характеризующееся поражением жизненно важных органов, и прежде всего почек. Распространенность подагры в различных регионах варьирует в широких пределах и во многом связана с особенностями питания населения, составляя в среднем 0,1%. В США этот показатель равен 0,84% (возможно, эта цифра завышена).
Подагрой болеют преимущественно мужчины (отношение мужчины/женщины составляет 9:1). У мужчин и в норме наблюдается более высокий уровень мочевой кислоты. У женщин репродуктивного возраста повышенное содержание эстрогенов способствует увеличению почечного клиренса уратов. В постменопаузальном периоде уровень мочевой кислоты у них такой же, как и у мужчин соответствующего возраста. Поэтому, если пик заболеваемости у мужчин падает на возраст 35–50 лет, то у женщин — на 55–70 лет. Однако подагра может развиваться и в более молодом возрасте и отмечается даже у детей.
Как известно, мочевая кислота является конечным продуктом расщепления пуринов и выделяется из организма почками. У здоровых лиц за 24 ч выделяется с мочой 400–600 мг мочевой кислоты. Для понимания патогенеза подагры следует остановиться на клиренсе мочевой кислоты. Он характеризует объем крови, способный очиститься в почках от мочевой кислоты за 1 мин. В норме этот показатель равен 9 мл/мин. Источником образования мочевой кислоты в организме являются пуриновые соединения, которые поступают с пищей или образуются в организме в процессе обмена нуклеотидов. В плазме крови мочевая кислота находится в виде свободного урата натрия. В норме верхняя граница этого показателя для мужчин составляет 0,42 ммоль/л (7 мг%) и для женщин — 0,36 ммоль/л (6 мг%). Содержание мочевой кислоты выше этих цифр расценивается как гиперурикемия и рассматривается в качестве фактора высокого риска развития подагры. Так, по данным Фремингемского исследования, развитие подагрического артрита наблюдается у 17% мужчин и женщин с урикемией 7,0–7,9 мг%, у 25% — с 8–8,9 мг% и у 90% — при уровне мочевой кислоты выше 9,0 мг%.
При наличии стойкого повышения мочевой кислоты в сыворотке крови выше для данного индивидуума уровня она начинает откладываться в тканях в виде свободного урата натрия, который в мочевых путях переходит в мочевую кислоту.
Выделяются следующие клинические варианты подагры:
Гиперурикемия может длительное время протекать без каких-либо субъективных и объективных симптомов и лишь случайно диагностироваться при обследовании больного. Однако она не столь безобидна, как это может показаться на первый взгляд, и нередко ассоциируется с нарушениями жирового и углеводного обмена, а также, что еще более серьезно, приводит к уратной нефропатии. Следует отметить условность дефиниции «асимтоматическая подагра». Для ее выявления необходимо повторно исследовать уровень мочевой кислоты, особенно у «подагрической личности», т. е. у мужчин молодого возраста с пристрастием к алкоголю, ожирением и артериальной гипертонией. В некоторых случаях период асимптоматической (химической) гиперурикемии длится несколько лет и только после этого происходит клиническая презентация подагры. Следует иметь в виду, что гиперурикемии обычно предшествует гиперурикозурия. Поэтому у больных с мочекислым диатезом нужно повторно исследовать уровень мочевой кислоты не только в крови, но и в моче с целью своевременного выявления подагры.
Содержание мочевой кислоты в крови может повышаться под влиянием различных факторов, как внутренних, так и внешних. Эти факторы способствуют либо увеличению образования эндогенных пуринов, либо замедлению их выделения почками. С этих позиций выделяют два типа гиперурикемии — метаболический и почечный. Метаболический тип характеризуется повышением синтеза эндогенных пуринов при наличии высокой урикозурии и нормальном клиренсе мочевой кислоты. Напротив, при почечном типе наблюдается низкий клиренс мочевой кислоты и, следовательно, нарушение выделения мочевой кислоты почками. Представленные типы гиперурикемии имеют первостепенное значение в выборе противоподагрических модифицирующих болезнь препаратов, используемых в терапии этого заболевания.
Причины повышенного биосинтеза пуринов
Нозологические формы и клинические синдромы:
Лекарства, диета и хронические интоксикации:
Причины замедления выведения мочевой кислоты почками
Нозологические формы и клинические синдромы:
Лекарства и хронические интоксикации:
Выделяют также первичную и вторичную подагру. При первичной подагре какое-либо фоновое заболевание, предшествующее ее развитию, отсутствует. В основе такой подагры лежит семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами, или так называемый «конституциональный диспуризм». Исследования уратного гомеостаза показали аутосомно-доминантный тип наследования таких аномалий. В частности, это наблюдается при врожденных нарушениях в содержании энзимов, занимающих ключевое положение в метаболизме пуринов. Так, при снижении активности гипоксантин-гуанин-фосфорибозилтрансферазы происходит увеличение ресинтеза пуринов из нуклеотидов, что способствует развитию синдрома Леша-Найхана. Этот синдром встречается только у детей и у лиц молодого возраста и обычно заканчивается уратной нефропатией с летальным исходом. При высоком содержании фосфорибозилпирофосфата также наблюдается метаболический тип гиперурикемии, так как этот фермент участвует в синтезе предшественников мочевой кислоты. Что касается вторичной подагры, то она является одним из синдромов другого заболевания, «второй болезнью», развивающейся при многих патологических процессах и чаще всего при хронической почечной недостаточности.
Большое значение в распознавании подагры, особенно ее ранней стадии, имеет клиническая картина острого подагрического артрита. Она хорошо известна, однако частота диагностических ошибок в первый год заболевания достигает 90%, а через 5–7 лет правильный диагноз ставится только в половине случаев. Поздняя диагностика связана с недооценкой классических ранних признаков заболевания, а также с многообразием дебюта и течения подагры. Ее диагностика строится на особенностях клинической картины заболевания, повышенного содержания мочевой кислоты в крови и обнаружения кристаллов урата натрия в тканях. На практике широко применяются следующие так называемые Римские диагностические критерии подагры:
Диагноз подагры считается достоверным при наличии любых двух из четырех критериев.
Менее распространены диагностические критерии подагры, предложенные Американской коллегией ревматологов (АСК) в 1977 г., которые скорее характеризуют острый воспалительный артрит или его рецидивирующие атаки, нежели подагру в целом. Согласно этим критериям, достоверный диагноз ставится при наличии 6 из 12 признаков:
В первые 3–4 года подагра протекает по типу рецидивирующего острого воспалительного моноартрита с полным обратным развитием и восстановлением функции суставов, при этом межприступный период продолжается от нескольких месяцев до 1–2 лет. В дальнейшем этот период укорачивается, в процесс вовлекаются все новые и новые суставы и воспалительные явления локализуются не только в суставах стоп, но распространяются на суставы верхних конечностей, что обычно совпадает с образованием тофусов. Тофусы представляют собой депозиты кристаллов мочевой кислоты. Они появляются в среднем спустя 6 лет после первого приступа подагры, но иногда и через 2–3 года. Ураты чаще всего откладываются на поверхности суставного хряща, в синовиальной оболочке, синовиальных влагалищах, сухожилиях, а также в субкортикальной области эпифизов костей. Наиболее часто они располагаются на ушных раковинах и на задней поверхности локтевых суставов. Тофусы подразделяются на единичные и множественные, а также классифицируются в соответствии с их размерами, при этом к мелким относят тофусы до 1 см в диаметре, к средним — от 1 до 2,5 см и к крупным — более 2,5 см. Подагрические узлы с локализацией в опорно-двигательном аппарате являются основным элементом формирования хронического подагрического артрита. Тофусы могут располагаться в почках и других висцеральных органах.
Хроническое течение подагры не ограничивается только вовлеченностью суставов и формированием тофусов, но и характеризуется поражением внутренних органов. Подагрическая нефропатия является наиболее важным с прогностической точки зрения проявлением подагры и самой распространенной причиной летальных исходов при этом заболевании. Среди отдельных вариантов подагрической нефропатии выделяют острую мочекислую блокаду канальцев почек, мочекислый нефролитиаз, обусловленный отложением солей мочевой кислоты в чашечках и лоханках почек, хроническую уратную нефропатию и диффузный гломерулонефрит. Острая мочекислая блокада канальцев почек происходит, например, при распаде опухоли вследствие массивной медикаментозной или рентгенотерапии. Хроническая уратная нефропатия связана с отложением уратов в интерстиции почек, а развитие диффузного гломерулонефрита — с иммунными нарушениями у лиц с дисрегуляцией пуринового обмена. Такой гломерулонефрит по своей иммуноморфологии чаще всего является мезангиопролиферативным и при нем выявляют депозиты IgG и комплемента. Следует иметь в виду, что подагра часто ассоциируется с такими патологическими состояниями, как артериальная гипертония, ожирение, гиперлипидемия, жировая дистрофия печени, атеросклероз, нарушения мозгового кровообращения, алкогольная зависимость.
Течение подагры характеризуется разнообразием темпов развития болезни. Возможно относительно доброкачественное течение с редкими приступами, небольшой гиперурикемией и урикозурией и длительным сохранением функциональной недостаточности опорно-двигательного аппарата. В других случаях, напротив, с самого начала заболевания наблюдаются частые атаки острого артрита с сильными болями или непрерывные атаки с множественным поражением суставов на протяжении нескольких недель или месяцев (подагрический статус). Рефрактерное к проводимой терапии течение подагры приводит к быстрому развитию функциональной недостаточности суставов и почек.
В основе выделения вариантов течения подагры лежат: количество приступов артрита в течение года, число пораженных суставов, выраженность костно-хрящевой деструкции, наличие тофусов, патология почек и ее характер.
Варианты течения подагры
Легкое: приступы артрита 1–2 раза в год и захватывают не более 2 суставов, нет поражения почек и деструкции суставов, тофусы отсутствуют или они единичные и не превышают 1 см в диаметре.
Средней тяжести: 3–5 приступов в год, поражение 2–4 суставов, умеренно выраженная костно-суставная деструкция, множественные мелкие тофусы, поражение почек ограничено почечно-каменной болезнью.
Тяжелое: частота приступов более 5 в год, множественное поражение суставов, множественные тофусы крупных размеров, выраженная нефропатия.
Основными задачами терапии подагрического артрита являются:
Купирование острого подагрического артрита проводится противовоспалительными средствами. Для этих целей используются: колхицин — колхицин, колхикум-дисперт; нестероидные противовоспалительные препараты (НПВП) — вольтарен, дикловит, диклоран, целебрекс, мовалис); кортикостероиды — полькортолон, преднизолон, метилпреднизолон; или комбинация НПВП и кортикостероидов — амбене. Как колхицин, так и НПВП способствуют обратному развитию острого артрита в течение нескольких часов, в то время как у не прошедших лечение больных он может длиться несколько недель. До недавнего времени полагали, что лучшим препаратом для купирования приступа острого артрита при подагре является колхицин. Ярко выраженный и быстрый (в течение 48 ч) эффект колхицина рассматривался как один из диагностических признаков этого заболевания. Колхицин способен предупредить дальнейшее развитие острого приступа подагры при его назначении в первые 30–60 мин атаки. Его лечебное действие обусловлено угнетением фагоцитарной активности нейтрофилов. При остром приступе подагры мононатриевые соли уратов, фагоцитированные нейтрофилами, приводят вследствие мембранолитического их действия к гибели этих клеток и высвобождению лизосомальных ферментов, которые отвечают за развитие острого воспаления.
Из НПВП предпочтение отдают индометацину (индотард, метиндол) и диклофенаку (вольтарен, диклоран, диклофен). Эти препараты назначают в дозе 200–250 мг/сут, причем в первые часы приступа применяют большую часть суточной дозы. Проведенные контролированные исследования не выявили более высокой эффективности традиционных НПВП по сравнению с селективными ингибиторами ЦОГ-2 (нимесил, нимулид, целебрекс), например целекоксибами (коксиб, целебрекс). Однако окончательное суждение о сравнительной эффективности этих препаратов можно вынести только в ходе дальнейших исследований. Суточная доза колхицина составляет 4–6 мг/сут, причем 2/3 этой дозы больной принимает до 12 ч дня в первый день приступа. Обычно разовая доза составляет 0,6 мг и ее принимают каждый час до явного снижения подагрического воспаления. После значительного уменьшения воспаления дозу колхицина начинают снижать по 0,6 мг 2 раза в день, вплоть до полной отмены. Нередко у больных не удается наращивать суточную дозу до оптимальной из-за появления побочных реакций. Основными побочными эффектами колхицина являются тошнота, рвота, понос, возможны также геморрагический гастроэнтерит, лейкопения, нейропатия. При подагрическом статусе, характеризующемся непрерывными атаками острого артрита, рефрактерными к терапии НПВП, возможно внутривенное введение колхицина.
Противоподагрическая терапия (базисная, модифицирующая болезнь) направлена на профилактику рецидивов острого артрита, снижение содержания мочевой кислоты в крови, предупреждение дальнейшего формирования тофусов и их обратное развитие. Все противоподагрические препараты делятся на две большие группы: урикодепрессоры (урикостатики) и урикозурики. Урикодепрессоры тормозят синтез мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего гипоксантин в ксантин, а ксантин в мочевую кислоту. Урикозурики повышают экскрецию мочевой кислоты, подавляя обратную реабсорбцию уратов почечными канальцами.
К препаратам первой группы относится аллопуринол (аллопуринол, аллопуринол-эгис, аллупол, пуринол, ремид, тиопуринол, милурит), который занимает лидирующее положение среди дру-гих противоподагрических средств. Показанием к применению аллопуринола являются метаболическая подагра, высокая гиперурикемия, частые острые атаки артрита, мочекислая болезнь, генетически обусловленный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы. Применение аллопуринола возможно и у больных с подагрической нефропатией с начальными проявлениями хронической почечной недостаточности и небольшой азотемии. Начальная доза аллопуринола составляет 300 мг/сут. В случае неэффективности такой дозы ее увеличивают до 400–600 мг/сут, а при достижении клинического эффекта постепенно снижают. Поддерживающая доза определяется уровнем гиперурикемии и обычно составляет 100–300 мг/сут.
Аллопуринол способствует исчезновению атак острого артрита или их заметному ослаблению, обратному развитию тофусов и отчетливому их размягчению, снижению уровня мочевой кислоты до субнормальных цифр, нормализации показателей мочевого синдрома, урежению почечных колик и выделительной функции почек. У некоторых больных он поначалу вызывает повышение уровня мочевой кислоты и обострение подагрического артрита, поэтому на первом этапе терапии его комбинируют с противовоспалительными препаратами, в частности с низкими дозами колхицина или НПВП. По этой причине его не следует принимать при остром подагрическом артрите. При лечении аллопуринолом нередко развиваются побочные реакции, которые проявляются желудочно-кишечной токсичностью, аллергическими реакциями (кожная сыпь, эозинофилия), гепатотоксичностью с повышением сывороточных аминотрансфераз.
Урикозурические препараты, представляющие собой слабые органические кислоты, имеют меньшее значение в терапии подагры, чем урикостатики. Их не следует назначать при высоком содержании мочевой кислоты в крови, а также при нефропатии даже с начальными проявлениями почечной недостаточности. Из урикозурических препаратов сульфинпиразон и пробенецид особенно широко используются в США. Сульфинпиразон (сульфинпиразон, апо-сульфинпиразон, антуран) назначают по 200–400 мг/сут в два приема. Его, как и другие урикозурические средства, принимают с большим количеством жидкости, которую для профилактики нефролитиаза следует ощелачивать. Побочные реакции встречаются относительно часто и проявляются желудочной и кишечной диспепсией, лейкопенией, аллергическими реакциями. Противопоказанием к назначению сульфинпиразона является язвенная болезнь желудка и, конечно, подагрическая нефропатия.
Пробенецид (бенемид) является производным бензойной кислоты. Препарат назначается по 1,5–2,0 г/сут. Бензойная кислота содержится в клюкве, а также в ягодах и листьях брусники. Поэтому отвары и морсы из ягод и листьев этих растений показаны больным подагрой и в большей степени больным с подагрической нефропатией, тем более что помимо бензойной кислоты они содержат гиппуровую кислоту, обладающую урикосептическими свойствами. Урикозурическая активность присуща блокатору рецептора ангиотензина II и фенофибрату (грофибрат, нофибал). Наиболее эффективны производные бензбромарона, которые обладают не только урикозурическими свойствами, но и урикодепрессорными. Они используются в качестве монотерапии или в сочетании с аллопуринолом. Таким комбинированным препаратом является алломарон. Алломарон содержит 20 мг бензбромарона и 100 мг аллопуринола, его обычно принимают по 1 таблетке 2 раза в день.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и ощелачивающие растворы, которые способны снизить риск развития нефропатии и, в частности, мочекаменной болезни. К этим препаратам относятся магурлит, блемарен и уралит. Их применение должно регулярно контролироваться показателем рН мочи. Помимо этих средств, можно принимать питьевую соду 2–4 г в день или щелочные минеральные воды.
При выраженных симптомах артрита необходимо также проводить местное лечение (долобене, финалгон, диклоран плюс, долгит крем, немулид гель, бишофит-гель).
Диете при подагре придают наибольшее значение по сравнению с другими ревматическими болезнями. Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела. Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров. Жиры снижают экскрецию мочевой кислоты почками. Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино. Исключают из пищевого рациона печенку, почки, жирные сорта мяса, мясные бульоны, копчености, горох, бобы, чечевицу, шпинат, цветную капусту, шпроты, сельдь. Следует ограничить потребление мяса до 2–3 раз в неделю, при этом лучше употреблять его в отварном виде.
Сочетание строгой диеты с длительным применением противоподагрических препаратов, а также активное воздействие на заболевания, которые повышают содержание мочевой кислоты в крови, способны существенно замедлить темпы прогрессирования костно-хрящевой деструкции, предупредить дальнейшее формирование тофусов и сохранить функциональное состояние опорно-двигательного аппарата и почек.
В. В. Бадокин, доктор медицинских наук, профессор
РМАПО, Москва