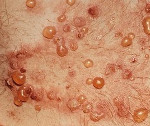
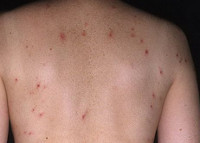
Чем лечить герпетический дерматит
Нейродермит: причины и профилактика заболевания
Ежегодно специалисты фиксируют около 7 млн новых случаев кожных заболеваний. Неприятные ощущения и неэстетичный вид кожных покровов заставляют людей скрывать свой недуг от окружающих и ограничивать себя в досуге. Одним из наиболее распространенных дерматологических заболеваний является нейродермит.
Что такое нейродермит?

Нейродермит — хроническая болезнь нейроаллергического генеза. Это рецидивирующий недуг, для которого характерны периоды обострения, ремиссии и сезонности. В моменты острого течения болезни отмечаются покраснение кожных покровов, шелушение и сильный зуд, заставляющий человека расчесывать кожу до крови. Следующая стадия — возникновение волдырей, которые сначала не отличаются по цвету от кожных покровов. Затем папулы приобретают розово-коричневый оттенок. Узелки начинают разрастаться, образуя единый очаг без четких границ. Кожа постепенно синеет, а затем краснеет. Во время ремиссии кожные покровы обесцвечиваются. Если болезнь протекает в тяжелой форме, этот период не наступает.
Важно знать! Сильный зуд заставляет человека расчесывать кожу. В ранки легко поникает гнойная или грибковая инфекция, которая может вызвать вторичное инфицирование и усугубить течение нейродермита.
Наиболее часто заболевание нейродермит проявляется на коленных и локтевых сгибах, на шее, груди, предплечьях, в паху, в ягодичных складках, но в некоторых случаях папулы с характерным блеском обнаруживаются на лице.
В острый период болезни кожная реакция сочетается с аллергическим ринитом, бронхиальной астмой или поллинозом.
Для окружающих дерматит не опасен, однако у заболевшего недуг может спровоцировать нервный срыв.
Группы риска
Бывает нейродермит у детей и у взрослых. Обычно первые признаки дерматита возникают у малышей в возрасте от 6 месяцев до 7 лет. Болезнь протекает как пищевая аллергия. С наступлением полового созревания у 60-80% детей нейродермит самостоятельно устраняется, однако кожа по-прежнему остается очень чувствительной.
Нейродермит передается по наследству и носит семейный характер. Если ваши близкие родственники страдают аллергией, то у вас высокий риск появления болезни.
В группе риска находятся люди с патологиями нервной системы и гормональными нарушениями. В этом случае для того, чтобы спровоцировать болезнь, человеку достаточно испытать серьезный стресс.
Согласно статистике, городские жители из-за плохой экологии наиболее подвержены этому дерматологическому недугу, чем те, кто постоянно проживает в сельской местности.
Причины возникновения заболевания и профилактика нейродермита
Нейродермит — недуг, на появление которого влияет множество факторов.
От чего бывает нейродермит:
Профилактика нейродермита практически не отличается от мер, принимаемых для предотвращения возникновения других недугов. Она предполагает правильное питание, соблюдение режима дня, ограничение чрезмерных физических и умственных нагрузок, укрепление иммунитета.
Людям, предрасположенным к появлению кожных аллергических реакций, рекомендуется носить одежду из натуральных материалов.
В период ремиссии не стоит подвергать кожу действию высоких и низких температур. Следует отказаться от агрессивных средств для пилинга. Нежелательно пользоваться кремами, содержащими в составе корицу, перец, ментол.
Важно знать! Женщине, страдающей от нейродермита, рекомендуется проводить профилактические мероприятия до зачатия ребенка. Для поддержания естественного иммунитета малыша ей следует продлить грудное вскармливание.
Что может спровоцировать обострение нейродермита
В случае успешного лечения период ремиссии длится от нескольких недель до 5 и более лет. Однако болезнь может неожиданно вернуться, что потребует от пациента оперативного обращения к врачу.
Одним из главных условий, способствующих снижению частоты обострения нейродермита у взрослых и детей, является выявление факторов риска. В некоторых случаях врачи советуют сдать анализы на аллергены.
Чтобы снизить риск обострения, специалисты рекомендуют отказаться или ограничить употребление продуктов питания, способных вызвать кожные реакции (шоколад, цитрусовые, соленья, копчености).
Алкоголь — один из факторов, провоцирующих возвращение дерматита. Пациентам, страдающим от нейродермита, стоит воздержаться от употребления спиртного.
Виды нейродермита
Выделяют несколько разновидностей этого заболевания, каждая из которых имеет ряд отличительных особенностей. Ниже приведены разные виды нейродермита с фото, на которых видно его проявление.
Ограниченный нейродермит
Эта форма заболевания характеризуется возникновением сыпи на четко ограниченном участке кожи. Узловые образования обычно локализуются на шее, в области половых органов, в паху, под коленями и в месте локтевого сгиба.
Особенности:
Диффузный нейродермит
Эта форма болезни протекает намного сложнее. На теле образуются множественные очаги. Обычно нейродермит локализуется на руках, ногах, в местах сгиба коленей и локтей, на щеках, носу, губах. Если недуг возник в детском возрасте, в момент обострения поражается кожа вокруг глаз и волосистая часть головы.
Отличительный признак болезни — мокнущие ранки, которые со временем подсыхают.
Терапия ограниченного и диффузного нейродермита практически не отличается и предполагает использование мазей, уменьшающих зуд, а также проведение физиотерапевтических мероприятий.
Лечение заболевания
Приступая к терапии этого заболевания, следует помнить, что избавиться навсегда от него не получится. При правильном определении симптомов и лечения нейродермита возможно достижение впечатляющих результатов.
Основные способы терапии:
Один из методов лечения — гормонотерапия. Прием гормональных средств показан при частых рецидивах. Однако такие медикаменты имеют множество противопоказаний. Мази с содержанием гормонов нельзя наносить на чувствительные участки кожи. Ограничено время применения таких препаратов (не более 5 дней).
Специалисты клиники «ПсорМак» в Москве работают по авторской методике. Врачи назначают мази собственного изготовления с учетом формы заболевания, что обеспечивает эффективность терапии. Методика полностью исключает небезопасное лечение гормонами и ультрафиолетом.
В основе терапии — комплексный подход, предполагающий использование мазей и препаратов на основе лечебных трав, а также иглотерапию. Если к нейродермиту присоединяется грибковая инфекция, врачи назначают антимикотики.
Уход за кожей и необходимость диеты
Чтобы предотвратить обострение нейродермита, необходимо позаботиться о регулярном увлажнении и насыщении кожи липидами, отказаться от скрабов.
Диета с правильным меню при нейродермите у взрослых — один из способов продлить период ремиссии. Пациентам рекомендуется отказаться от сахара, алкоголя, кофе, продуктов с глютеном и химическими консервантами.
Советы специалиста по лечению заболевания
Лечение недуга предполагает не только активную работу врача, но и соблюдение простых рекомендаций пациентом. Если вы столкнулись с этим заболеванием, следуйте следующим советам:
Лечение — ответственная задача, с которой вам поможет справиться только квалифицированный врач. Специалисты клиники «ПсорМак» в Москве готовы ответить на волнующие вас вопросы и после детальной диагностики назначить своевременное и эффективное решение. Профессионалы клиники работают по уникальной авторской методике, позволяющей добиться устойчивого результата. Свяжитесь с нами через онлайн чат на сайте или закажите бесплатный обратный звонок. Вы можете также позвонить нам по телефонам 8 (800) 500-49-16, +7 (495) 150-15-14 и записаться на прием в удобное время.
Лечение инфекций кожи при атопическом дерматите у детей
В международном согласительном документе по атопическому дерматиту (США, 2002) эксперты отмечают, что атопический дерматит, как правило, наследственное заболевание, часто ассоциированное с астмой, пищевой аллергией, аллергическим ринитом и рецидивирующим
В международном согласительном документе по атопическому дерматиту (США, 2002) эксперты отмечают, что атопический дерматит, как правило, наследственное заболевание, часто ассоциированное с астмой, пищевой аллергией, аллергическим ринитом и рецидивирующими кожными инфекциями. Инфекция может существенно изменить течение заболевания. В случае развития у пациента бактериальной, грибковой или вирусной инфекций кожи необходимо по возможности быстро идентифицировать эту инфекцию и начать специфическую терапию для ее устранения [1].
Подобный подход обусловлен тем фактом, что вирусы, бактерии и грибки могут быть триггерами атопического дерматита и приводить к обострению заболевания. С другой стороны, дефицит керамидов в результате выраженного снижения уровня сфингомиелина способствует сухости кожи и более легкому проникновению инфекционных агентов и аллергенов в поврежденный эпидермис. Кроме того, эпидермальный барьер кожи нарушают протеазы клещей домашней пыли и Staphylococcus (S.)aureus, что в сочетании с другими факторами также повышает риск проникновения аллергенов и поддерживает воспалительный процесс в коже. Есть также наблюдения, свидетельствующие о роли бактериальных и грибковых колонизаций в формировании резистентного к терапии и более тяжелого рецидивирующего течения атопического дерматита [2, 3]. Наконец, вторичное инфицирование кожи или глубокие расчесы могут привести к ее рубцовым изменениям, что в целом не типично для самого атопического дерматита.
Для микрофлоры здоровой кожи обычно не характерна колонизация S. aureus, в то время как кожа более чем 90% пациентов с атопическим дерматитом обсеменена этим видом бактерий, количество которых в мокнущих очагах может составить свыше 14 млн на кв. см [2]. Более того, высокая степень колонизации кожи S. aureus возможна даже в случае отсутствия клинических проявлений бактериальной инфекции кожи. Продуцируемые S. aureus на поверхности кожи токсины (так называемые суперантигены) стимулируют активацию Т-лимфоцитов и макрофагов и тем самым усиливают аллергический воспалительный иммунный ответ кожи. Исследования показали, что экзотоксины S. aureus ухудшают течение атопического дерматита, а уровень специфических иммуноглобулин (Ig) E-антител к стафилококковым суперантигенам коррелирует с тяжестью заболевания [3]. Предполагается также участие суперантигенов в развитии нечувствительности кожи к топическим глюкокортикостероидам и/или снижению терапевтического эффекта этих препаратов [3–5].
В редких случаях кожа больных атопическим дерматитом инфицируется вирусами, чаще вирусом простого герпеса 1, 2 типов, а также вирусом контагиозного моллюска [1, 5, 7]. Герпетическая инфекция кожи может неоднократно встречаться у одних и тех же больных, тогда как у других — практически никогда. Предполагают, что наибольшему риску подвержены пациенты с тяжелым течением атопического дерматита или больные, не получившие должного лечения. Иногда герпетическую экзему у больных атопическим дерматитом следует дифференцировать с такой бактериальной инфекцией кожи, как импетиго. Eczema molluscatum, в отличие от герпетической экземы, неопасное осложнение, которое встречается редко.
Одной из важных причин инфицирования кожи у больных атопическим дерматитом ученые считают дефицит антимикробных пептидов в коже, необходимых для защиты организма против бактерий, вирусов и грибов [5]. Считается, что инфекционные осложнения кожи при атопическом дерматите сопровождаются определенными иммунологическими нарушениями: при бактериальных инфекциях — дефицитом эпидермальных антимикробных пептидов и дисбалансом Т-хелперов (Th1/Th2) — в случае вирусных поражений кожи [5]. По последним данным, у больных атопическим дерматитом с таким осложнением, как герпетическая экзема, в кератиноцитах кожи обнаружена достоверно более низкая экспрессия антимикробных пептидов [5].
Перечислим инфекции кожи, которые чаще всего могут осложнять течение атопического дерматита и их возбудителей:
Однако возможность развития подобных осложнений следует рассматривать не только в случае клинически выраженной стадии обострения атопического дерматита, но и при отсутствии ответа на соответствующую терапию. Высокая колонизация кожи S. aureus или грибковой инфекцией может иметь место и в отсутствие выраженной клинической картины заболевания.
По данным M. Furue и соавторов, в течение 6 мес наблюдавших 1271 пациента с атопическим дерматитом (из них 210 детей младшего возраста, 546 детей и 515 взрослых), были диагностированы следующие осложнения: герпетические инфекции и/или дерматит Капоши у 2,4% детей раннего возраста, 2,5% детей старшего возраста и 3,5% взрослых; ассоциация атопического дерматита с контагиозным моллюском у 7% детей раннего возраста, 9% детей и 0,2% взрослых [8].
Отечественные специалисты указывают на формирование осложненных форм атопического дерматита в значительно большем числе случаев: у 25–34% детей, страдающих атопическим дерматитом [7].
Участие микробов и вирусов в развитии обострений и рецидивирующего тяжелого течения атопического дерматита обосновывает необходимость дифференцированного подхода к комплексной терапии таких больных. Остановимся на основных этапах лечения осложненных форм атопического дерматита у детей. Речь пойдет о наружной, этиотропной и иммуномодулирующей терапии [7].
Наружная терапия
Напомним, что ключевым моментом терапии любых форм и стадий атопического дерматита является вспомогательная базисная терапия: регулярное применение очищающих и увлажняющих средств дерматокосметической линии [1]. Цель такого подхода состоит в ограничении размножения бактерий и восстановлении барьерной функции кожи.
В случае диагностирования у ребенка, страдающего атопическим дерматитом, активной бактериальной инфекции кожи лечение должно включать правильный уход за кожей (очищение/гидратация, антисептики) и применение топических и/или пероральных антибиотиков.
Этиотропная терапия
При бактериальной инфекции с наличием экссудации и мокнутия кожи используют топические антибиотики. Установлено, что эффективнее всего рост колоний микроорганизмов, являющихся наиболее частыми возбудителями кожных инфекций (в том числе S. аureus, Streptococcus pyogenes, S. еpidermidis, Corynebacterium spp.), подавляет фузидиевая кислота [9]. Кроме того, концентрация этого антибиотика после однократного нанесения, в частности мази фуцидина, составляет в коже 2,2% (в эпидермисе —
430 мкг/мл, в дерме — 286 мкг/мл и подкожной жировой клетчатке —
109 мкг/мл); для сравнения: проникающая способность эритромицина составляет 0,3%, тетрациклина — 0,28%, мупироцина (бактробан) — 0,02%. Иными словами, фузидиевая кислота в 100 раз лучше проникает в кожу, чем мупироцин, и в 8 раз лучше, чем тетрациклин и эритромицин. Показано, что фузидиевая кислота проникает даже в деваскуляризированные зоны и некротические ткани, а ее биодоступность составляет 90%.
Поскольку при атопическом дерматите экзематозное поражение кожи, в частности области экссудации и экскориации, представляет собой благоприятную среду для размножения S. аureus, считается, что в лечении заболевания предпочтительнее использовать сочетание топического глюкокортикостероида с антибиотиком. Это позволит разорвать «порочный круг«: S. аureus снижает эффективность кортикостероидов посредством продуцируемого стафилококкового токсина, тогда как кортикостероиды подавляют воспаление.
Таким образом, доказана патогенетическая роль бактерий в развитии и поддержании аллергического воспаления при атопическом дерматите, что обосновывает необходимость применения комбинированных препаратов, содержащих топические кортикостероиды и антибактериальные средства. Показано, что назначение таких лекарственных средств позволяет более эффективно бороться с клиническими признаками атопического дерматита, чем терапия только одним наружным кортикостероидом. Так, в ходе двух рандомизированных клинических исследований (от 34 до 207 больных) сравнивалась эффективность местного применения различных комбинированных препаратов, содержащих антибактериальные средства в сочетании с топическими кортикостероидами, и монотерапии наружными кортикостероидами у больных атопическим дерматитом, имеющих кожные проявления вторичной инфекции [10, 11]. Клиническое улучшение констатировали у 54–95% участников, причем без статистически значимых различий субъективных и объективных данных в зависимости от использования различных комбинированных препаратов. Однако в группе с применением фузидиевой кислоты–гидрокортизона ацетат (фуцидин Г) клиническое улучшение наступало быстрее, чем в группе с применением миконазола–гидрокортизона [10], а лабораторно подтвержденный положительный эффект лечения в группе с применением бетаметазона валерата–фузидиевой кислоты (фуцикорт) был выше, чем в группе, где применяли миконазол–гидрокортизон [11].
Tакой подход — топическое использование антибиотика и крема — мягкого кортикостероида гидрокортизона — приводил к достоверно более ранней регрессии симптомов воспаления кожи при легком и среднетяжелом течении атопического дерматита [12]. Назначение крема, содержащего антибиотик и кортикостероид, представляется совершенно необходимым в случае клинических проявлений инфицирования кожи (мокнущая экзема). Такой препарат желательно использовать коротким курсом (до 1–2 нед), с тем чтобы избежать развития резистентности S. аureus [13]. При этом для применения на лице, кожных складках, в подмышечных впадинах, паховой области, на открытых участках тела предпочтительно выбирать комбинированный препарат в виде крема— мягкого кортикостероида и антибиотика (например, фузидиевая кислота + гидрокортизона ацетат (фуцидин Г), 2–3 раза в день в виде легких аппликаций). В случае острых и хронических форм дерматитов, локализованных на участках с толстой кожей (ладони и стопы), резистентных к слабым топическим кортикостероидам, целесообразнее назначить мазевую форму комбинированного препарата, содержащего кортикостероид средней/высокой активности (например, фузидиевая кислота/бетаметазона валерат (фуцикорт), целестодерм В с гарамицином и т. п.) 2–3 раза в день.
Вместе с тем исследования показали, что колонизация кожи S. аureus вновь наступала через 2–4 нед после завершения лечения комбиницией местного кортикостероида и антибиотика. Объясняется это прежде всего тем, что даже в случае применения высокочувствительных антибиотиков достичь полной эрадикации S. аureus очень сложно. Поддержанию инфицирования кожи способствуют такие факторы, как возможность передачи S. aureus от родителей, находящихся в непосредственном контакте с больным ребенком, а также содержание S. aureus в назальной слизи самого больного.
При неэффективности топических антибиотиков, а также атопическом дерматите, осложненном бактериальной инфекцией (например, импетиго), протекающей с лихорадкой, интоксикацией, воспалительными изменениями крови, показано назначение антибиотика широкого спектра действия перорально (цефалоспорины 1–3 поколений, макролиды, аминогликозиды) на 7–10 дней. Не рекомендуется прием фторхинолонов, тетрациклинов [7].
Однако, несмотря на то что в результате приема системных антибиотиков значительно снижался уровень микробиологически подтвержденной колонизации кожи S. аureus, все же это не способствовало клиническому улучшению течения тяжелой формы атопического дерматита у детей [14].
Способность достоверно снижать колонизацию S. aureus и частоту кожных инфекций описана также в отношении препаратов нового класса нестероидных топических иммунодепрессантов — ингибиторов кальциневрина такролимуса и пимекролимуса (элидел) [1, 4]. Так, в результате длительного применения пимекролимуса у детей в возрасте 3–23 мес жизни, страдающих атопическим дерматитом, было отмечено достоверно меньше случаев кожных инфекций [15]. Этот факт еще раз подтверждает важную роль Th2-опосредованного воспаления кожи и колонизации бактерий, при котором огромную роль играют взаимоотношения между цитокинами, адгезивными молекулами и антимикробными пептидами [4, 16]. Другой иммуносупрессивный препарат, действие которого также основано на ингибировании кальциневрина, — циклоспорин. Этот препарат обладает способностью уменьшать количество S. аureus на коже пациентов с атопическим дерматитом, что наиболее выражено у больных, одновременно имеющих высокую степень колонизации микроба и клинические проявления бактериальной инфекции кожи [17]. Однако применение данного препарата ограничено в педиатрической практике.
При грибковой инфекции, подтвержденной микробиологически, назначают: противогрибковые средства системного действия (флуконазол (дифлюкан) с периода новорожденности, детям старше 2 лет можно назначить тербинафин (экзифин), итраконазол (орунгал), кетоконазол — с 12 лет) в течение 7–14 дней в сочетании с местной терапией.
Кетоконазол и итраконазол ингибируют продукцию интерлейкина-4 и интерлейкина-5 и синтез эргостерола, что приводит к неспецифическому антивоспалительному эффекту и снижению уровня специфических IgE к Malassezia furfur [5].
При сочетанном поражении кожи больных атопическим дерматитом бактериальной и/или грибковой инфекцией наиболее оптимальными препаратами выбора являются комбинированные средства: тридерм, акридерм ГК. Тридерм в форме мази наносят на кожу туловища и конечностей, а в форме крема — на нежные участки кожи (в области складок, предплечья). В педиатрической практике в основном используют крем тридерм. Препарат наносят тонким слоем на пораженные участки кожи 2 раза в день, курс лечения в среднем составляет 7–12 дней.
Как известно, терапия наружными кортикостероидами служит стандартом лечения обострений атопического дерматита. Однако мощное противовоспалительное действие, присущее данным препаратам, может повысить чувствительность кожи к бактериальной и грибковой инфекциям, что является препятствием к длительному использованию топических гормональных средств при наличии этих инфекций. Кроме того, дети более чувствительны к наружным кортикостероидам из-за их высокой кожной абсорбции; последняя обусловлена также сухостью кожи [1]. Однако при этом есть предположения, что применение только монотерапии топическими антибиотиками или фунгицидными препаратами способствует сенсибилизации кожи, обострению аллергического воспаления с развитием кандидозной инфекции [18].
Во всех случаях врачу следует индивидуально подбирать для пациентов с атопическим дерматитом лекарственные средства — с учетом течения заболевания и состояния кожи.
При герпетической инфекции:
При контагиозном моллюске:
Иммуномодулирующая терапия
В случаях диагностирования у пациентов с атопическим дерматитом рецидивирующей бактериальной, грибковой и/или вирусной инфекции, а также при наличии у них очагов хронической инфекции, устойчивых к стандартной терапии, показано назначение иммуномодулирующей терапии, которая должна проводиться под контролем иммунологических показателей. В педиатрической практике наиболее широкое распространение получил ликопид — иммуномодулятор, обладающий способностью воздействовать на основные популяции клеток иммунной системы (макрофаги, Т- и В-лимфоциты), что, вероятно, связано с наличием у них специфических внутриклеточных рецепторов к глюкозаминилмурамилдипептиду [7, 18]. По своей структуре ликопид является синтетическим аналогом основного фрагмента пептидогликана клеточной стенки всех известных бактерий (мурамилдипептида). Активация макрофагов под воздействием ликопида приводит к усилению синтеза провоспалительных цитокинов (интерлейкина-1, фактора некроза опуходи a, колониестимулирующих факторов), в результате чего активируются фагоцитоз, пролиферация и дифференцировка Т- и В-лимфоцитов, усиливается синтез иммуноглобулинов, повышается цитотоксичность, стимулируется лейкопоэз.
Исследование С. Ю. Резайкиной, проводившееся у больных атопическим дерматитом, выявило преимущественное снижение функциональной активности нейтрофильного фагоцитоза (изменение кислородного метаболизма нейтрофилов), которое восстанавливалось при приеме ликопида [20]. В результате применения ликопида в комплексной терапии больных со среднетяжелым течением атопического дерматита существенно снизилась частота обострений заболевания и наблюдалась выраженная коррекция измененных лабораторных показателей.
Ликопид назначают детям в возрасте от 1 года до 16 лет внутрь в форме таблеток 1 мг. При лечении гнойно-воспалительных заболеваний кожи суточная доза препарата составляет 1 мг в течение 10 дней. При лечении герпетической инфекции препарат назначают внутрь в дозе 1 мг 3 раза в сутки в течение 10 дней. Противопоказания к применению ликопида: беременность, индивидуальная непереносимость препарата. В отдельных случаях возможно возникновение таких побочных эффектов, как повышение температуры тела до 37,9°С (является кратковременным, проходит самостоятельно и не требует отмены препарата). Взрослым ликопид назначают внутрь за 30 мин до еды (таблетки 10 мг) и сублингвально (таблетки 1 мг) в зависимости от степени тяжести заболевания.
Для изопринозина (инозин пранобекс) характерно двойное действие — противовирусное (за счет подавления репликации ДНК и РНК вирусов) и иммуномодулирующее (за счет комплекса инозина усиливается продукция интерлейкинов, хемотаксическая и фагоцитарная активность моноцитов и макрофагов, повышается синтез антител и усиливается пролиферация Т-лимфоцитов, Т-хелперов, естественных киллеров). Показанием к назначению изопринозина являются все вирусные инфекции кожи у страдающих атопическим дерматитом детей старше 1 года (контагиозный моллюск, герпесная инфекция, вульгарные бородавки, папилломавирусная инфекция). Изопринозин назначают по 1 таблетке на 10 кг/массы тела в сутки, на 3–4 приема в течение 10–14 дней — в зависимости от степени тяжести инфекционных заболеваний; при необходимости курс лечения повторяют.
По данным Л. В. Лусс, включение другого иммуномодулятора — полиоксидония — в комплексную терапию больных атопическим дерматитом и бронхиальной астмой, протекающими в сочетании с признаками вторичного иммунного дефицита и устойчивыми к проводимой терапии, позволяет добиться высокого клинического эффекта [21].
Среди детей, страдающих атопическим дерматитом, нередки случаи заболевания чесоткой. В таких случаях течение атопического дерматита сопровождается сильным упорным зудом кожи, а часто и ее инфицированием.
При присоединении чесотки лечение включает:
– спрегаль — применяется во всех возрастных группах и не имеет противопоказаний; распыляется в вечернее время на кожные покровы пациента от области шеи до подошв; препарат оставляют на 12 ч, после чего ребенка тщательно моют. При необходимости возможно повторное использование препарата через 4–10 дней после первичной обработки;
– бензилбензоат — 20% мазь наносят на кожные покровы в первый, второй, четвертый день, также со сменой белья, одежды, обработкой помещения;
– для обработки кожи можно использовать также 33% серную мазь, медифокс;
Таким образом, микробная колонизация и суперинфекция кожи (например, S. aureus, Malassezia furfur) могут играть определенную роль в обострениях атопического дерматита, что обосновывает необходимость дополнительного назначения больным антимикробных средств. Инфекционные агенты участвуют также в развитии и поддержании хронического аллергического воспаления кожи при атопическом дерматите. Как правило, такое течение заболевания характеризуется частыми рецидивами и тяжелым течением. Своевременная диагностика инфекций кожи и назначение оптимальной этиотропной терапии исключительно важны для достижения клинического улучшения состояния больных с атопическим дерматитом.
Эксперты по атопическому дерматиту подчеркивают, что этиотропную терапию можно прекращать только после купирования инфекционного процесса и очищения кожи [1]. Одновременно следует продолжать лечение противовоспалительными средствами (по показаниям — топические кортикостероиды коротким курсом, длительно — ингибиторы кальциневрина) на фоне непрерывного применения увлажняющих средств для гидратации кожи [2, 5].
Литература
Д. Ш. Мачарадзе, доктор медицинских наук, профессор
РУДН, Москва
Герпетиформный дерматит Дюринга
Герпетиформный дерматит Дюринга — хроническое рецидивирующее поражение кожи, проявляющееся полиморфной сыпью в виде эритематозных пятен, пузырей, папул, волдырей и сопровождающиеся выраженным зудом и жжением. Заболевание получило свое название благодаря тому, что элементы сыпи при дерматите Дюринга группируются таким же образом, как высыпания при герпесе. Диагностика проводится при помощи гистологического исследования, анализа содержимого пузырей и реакции прямой иммунофлуоресценции. В лечении герпетиформного дерматита Дюринга эффективна сульфоновая группа препаратов и кортикостероиды.
Общие сведения
Герпетиформный дерматит Дюринга встречается в любом возрасте, но наиболее часто он развивается в 30-40 лет. Мужчины более подвержены этому заболеванию, чем женщины. В некоторых случаях герпетиформный дерматит Дюринга является кожной реакцией на имеющуюся в организме злокачественную опухоль внутренних органов, то есть выступает в качестве параонкологического дерматоза.
Причины возникновения
Причины и механизм развития герпетиформного дерматита Дюринга неизвестны. У многих пациентов выявляется непереносимость белка глютеина, содержащегося в злаковых растениях. В пользу аутоиммунного компонента в развитии заболевания говорит обнаружение IgA-антител на границе дермы и эпидермиса — в области базальной мембраны. Предполагают, что определенную роль в возникновении герпетиформного дерматита Дюринга играют повышенная йодная чувствительность, наследственность, аскаридоз, воспалительные процессы желудочно-кишечного тракта (гастрит, язвенная болезнь), вирусные заболевания (ОРВИ, герпетическая инфекция и др.).
Симптомы
Обычно герпетиформный дерматит Дюринга имеет острое начало с появлением очагов полиморфной сыпи. Высыпаниям могут предшествовать умеренный подъем температуры тела, общая слабость, зуд и чувство покалывания. Элементы сыпи могут возникать на любом участке кожного покрова, кроме подошв и ладоней. Но наиболее частое их расположение — это разгибательные поверхности рук и ног, область лопаток, плечи, поясница и ягодицы. На ладонях могут возникать петехии и экхимозы — крупные (больше 3мм) пятна внутрикожных кровоизлияний. Высыпания сопровождаются выраженным дискомфортом: ощущением жжения, интенсивным зудом и парестезиями. Поражение слизистых оболочек при герпетиформном дерматите Дюринга, как правило, отсутствует. В редких случаях в полости рта могут возникать пузыри, быстро переходящие в эрозии.
Истинный полиморфизм сыпи при герпетиформном дерматите Дюринга связан с одновременным появлением на коже различного размера эритематозных пятен, волдырей, папул и пузырей. Со временем к истинному полиморфизму присоединяется ложный: образуются связанные с трансформацией высыпаний эрозии и корочки, а также вызванные сильным расчесыванием кожи экскориации. При заживлении элементов сыпи на коже остаются очаги гипо- и гиперпигментации, иногда рубцы.
Эритематозные пятна при герпетиформном дерматите Дюринга имеют четкий контур и округлую форму. Их гладкая поверхность часто покрыта расчесами, кровянистыми и серозными корочками. Со временем они пропитываются выпотом из расширенных сосудов и превращаются в похожие на волдыри (уртикароподобные) образования. Последние растут по периферии и сливаются, трансформируясь в розово-синюшные очаги, покрытые корочками, расчесами и пузырьками. Наряду с этим эритематозные пятна могут переходить в сочные розово-красные папулы. Кроме того, возникновение папул и уртикароподобных высыпаний может происходить без стадии эритематозного пятна.
Пузырные элементы сыпи при герпетиформном дерматите Дюринга могут быть небольшого размера — везикулы и диаметром более 2 см — буллезные высыпания. Они заполнены прозрачной жидкостью, помутнение которой говорит о присоединении инфекции. Пузыри вскрываются и подсыхают с образованием корки. Из-за расчесывания происходит снятие корки и на месте пузыря остается эрозия.
В зависимости от преобладания того или иного вида сыпи над остальными выделяют следующие виды герпетиформного дерматита Дюринга: папулезную, везикулезную, буллезную и уртикароподобную. Возможны атипичные варианты заболевания: трихофитоидные, экзематоидные, строфулоидные и др.
Острые периоды герпетиформного дерматита Дюринга сочетаются с довольно продолжительными ремиссиями (от нескольких месяцев до года и более). Обострения часто протекают с ухудшением общего состояния больного, подъемом температуры, нарушениями сна.
Диагностика
При подозрении на герпетиформный дерматит Дюринга проводят йодную пробу Ядассона. На здоровый участок кожи накладывают компресс с мазью, содержащей 50% йодида калия. Через 24 ч компресс снимают. Выявление на его месте покраснения, везикул или папул говорит в пользу герпетиформного дерматита Дюринга. Если проба отрицательна, то ее повторяют. Для этого через 48 ч накладывают такой же компресс на область пигментации, оставшейся после бывших высыпаний. Пробу Ядассона можно проводить с приемом препарата йода внутрь. Но такое исследование чревато резким обострением заболевания.
При герпетиформном дерматите Дюринга в клиническом анализе крови обнаруживается повышенное содержание эозинофилов. При цитологическом исследовании содержимого пузырей также выявляется большое количество эозинофилов. Однако эти данные, как и проба Ядассона, не являются обязательными или строго специфичными для заболевания.
Наиболее надежным способом диагностики герпетиформного дерматита Дюринга считается гистологическое исследование участков пораженной кожи. Оно выявляет расположенные под эпидермисом полости, скопления эозинофилов, нейтрофилов и остатков их разрушенных ядер. Реакция прямой иммунофлуоресценции (РИФ) обнаруживает на верхушках дермальных сосочков отложения IgA.
В диагностике буллезной формы герпетиформного дерматита Дюринга необходима дифференциация с другими буллезными дерматитами: буллезным пемфигоидом, вульгарной пузырчаткой и другими видами пузырчатки.
Поскольку герпетиформный дерматит Дюринга является параонкологическим заболеванием, для пациентов пожилого возраста желательно проведение дополнительных обследовании для исключения онкологической патологии внутренних органов: УЗИ органов брюшной полости и моче-половой системы, рентгенограмму легких, КТ почек и т. п.
Лечение герпетиформного дерматита Дюринга
Больным герпетиформным дерматитом Дюринга показано лечение у дерматолога. Назначают диету, исключающую злаки и йодосодержащие продукты (морская рыба, морепродукты, салат и др.). Медикаментозная терапия проводится препаратами сульфоновой группы: диафенилсульфон, сульфасалазин, солюсульфон и другие. Эти препараты обычно назначают внутрь циклами по 5-6 дней с перерывами в 1-3 дня. В случаях неэффективности сульфоновой терапии лечение проводят средними дозами кортикостероидов (преднизолон, дексаметазон и др.) Для купирования зуда применяют антигистаминные препараты: лоратадин, цетиризин, дезлоратадин.
Местное лечение герпетиформного дерматита Дюринга включает теплые ванны с раствором марганцовки, вскрытие пузырей и их обработку зеленкой или фукарцином, наложение кортикостероидных мазей или аэрозолей, применение 5% дерматоловой мази.
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
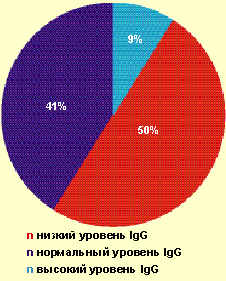 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
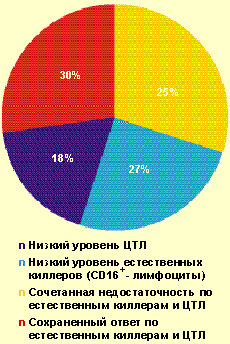 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Лечение инфекций кожи при атопическом дерматите у детей
В международном согласительном документе по атопическому дерматиту (США, 2002) эксперты отмечают, что атопический дерматит, как правило, наследственное заболевание, часто ассоциированное с астмой, пищевой аллергией, аллергическим ринитом и рецидивирующим
В международном согласительном документе по атопическому дерматиту (США, 2002) эксперты отмечают, что атопический дерматит, как правило, наследственное заболевание, часто ассоциированное с астмой, пищевой аллергией, аллергическим ринитом и рецидивирующими кожными инфекциями. Инфекция может существенно изменить течение заболевания. В случае развития у пациента бактериальной, грибковой или вирусной инфекций кожи необходимо по возможности быстро идентифицировать эту инфекцию и начать специфическую терапию для ее устранения [1].
Подобный подход обусловлен тем фактом, что вирусы, бактерии и грибки могут быть триггерами атопического дерматита и приводить к обострению заболевания. С другой стороны, дефицит керамидов в результате выраженного снижения уровня сфингомиелина способствует сухости кожи и более легкому проникновению инфекционных агентов и аллергенов в поврежденный эпидермис. Кроме того, эпидермальный барьер кожи нарушают протеазы клещей домашней пыли и Staphylococcus (S.)aureus, что в сочетании с другими факторами также повышает риск проникновения аллергенов и поддерживает воспалительный процесс в коже. Есть также наблюдения, свидетельствующие о роли бактериальных и грибковых колонизаций в формировании резистентного к терапии и более тяжелого рецидивирующего течения атопического дерматита [2, 3]. Наконец, вторичное инфицирование кожи или глубокие расчесы могут привести к ее рубцовым изменениям, что в целом не типично для самого атопического дерматита.
Для микрофлоры здоровой кожи обычно не характерна колонизация S. aureus, в то время как кожа более чем 90% пациентов с атопическим дерматитом обсеменена этим видом бактерий, количество которых в мокнущих очагах может составить свыше 14 млн на кв. см [2]. Более того, высокая степень колонизации кожи S. aureus возможна даже в случае отсутствия клинических проявлений бактериальной инфекции кожи. Продуцируемые S. aureus на поверхности кожи токсины (так называемые суперантигены) стимулируют активацию Т-лимфоцитов и макрофагов и тем самым усиливают аллергический воспалительный иммунный ответ кожи. Исследования показали, что экзотоксины S. aureus ухудшают течение атопического дерматита, а уровень специфических иммуноглобулин (Ig) E-антител к стафилококковым суперантигенам коррелирует с тяжестью заболевания [3]. Предполагается также участие суперантигенов в развитии нечувствительности кожи к топическим глюкокортикостероидам и/или снижению терапевтического эффекта этих препаратов [3–5].
В редких случаях кожа больных атопическим дерматитом инфицируется вирусами, чаще вирусом простого герпеса 1, 2 типов, а также вирусом контагиозного моллюска [1, 5, 7]. Герпетическая инфекция кожи может неоднократно встречаться у одних и тех же больных, тогда как у других — практически никогда. Предполагают, что наибольшему риску подвержены пациенты с тяжелым течением атопического дерматита или больные, не получившие должного лечения. Иногда герпетическую экзему у больных атопическим дерматитом следует дифференцировать с такой бактериальной инфекцией кожи, как импетиго. Eczema molluscatum, в отличие от герпетической экземы, неопасное осложнение, которое встречается редко.
Одной из важных причин инфицирования кожи у больных атопическим дерматитом ученые считают дефицит антимикробных пептидов в коже, необходимых для защиты организма против бактерий, вирусов и грибов [5]. Считается, что инфекционные осложнения кожи при атопическом дерматите сопровождаются определенными иммунологическими нарушениями: при бактериальных инфекциях — дефицитом эпидермальных антимикробных пептидов и дисбалансом Т-хелперов (Th1/Th2) — в случае вирусных поражений кожи [5]. По последним данным, у больных атопическим дерматитом с таким осложнением, как герпетическая экзема, в кератиноцитах кожи обнаружена достоверно более низкая экспрессия антимикробных пептидов [5].
Перечислим инфекции кожи, которые чаще всего могут осложнять течение атопического дерматита и их возбудителей:
Однако возможность развития подобных осложнений следует рассматривать не только в случае клинически выраженной стадии обострения атопического дерматита, но и при отсутствии ответа на соответствующую терапию. Высокая колонизация кожи S. aureus или грибковой инфекцией может иметь место и в отсутствие выраженной клинической картины заболевания.
По данным M. Furue и соавторов, в течение 6 мес наблюдавших 1271 пациента с атопическим дерматитом (из них 210 детей младшего возраста, 546 детей и 515 взрослых), были диагностированы следующие осложнения: герпетические инфекции и/или дерматит Капоши у 2,4% детей раннего возраста, 2,5% детей старшего возраста и 3,5% взрослых; ассоциация атопического дерматита с контагиозным моллюском у 7% детей раннего возраста, 9% детей и 0,2% взрослых [8].
Отечественные специалисты указывают на формирование осложненных форм атопического дерматита в значительно большем числе случаев: у 25–34% детей, страдающих атопическим дерматитом [7].
Участие микробов и вирусов в развитии обострений и рецидивирующего тяжелого течения атопического дерматита обосновывает необходимость дифференцированного подхода к комплексной терапии таких больных. Остановимся на основных этапах лечения осложненных форм атопического дерматита у детей. Речь пойдет о наружной, этиотропной и иммуномодулирующей терапии [7].
Наружная терапия
Напомним, что ключевым моментом терапии любых форм и стадий атопического дерматита является вспомогательная базисная терапия: регулярное применение очищающих и увлажняющих средств дерматокосметической линии [1]. Цель такого подхода состоит в ограничении размножения бактерий и восстановлении барьерной функции кожи.
В случае диагностирования у ребенка, страдающего атопическим дерматитом, активной бактериальной инфекции кожи лечение должно включать правильный уход за кожей (очищение/гидратация, антисептики) и применение топических и/или пероральных антибиотиков.
Этиотропная терапия
При бактериальной инфекции с наличием экссудации и мокнутия кожи используют топические антибиотики. Установлено, что эффективнее всего рост колоний микроорганизмов, являющихся наиболее частыми возбудителями кожных инфекций (в том числе S. аureus, Streptococcus pyogenes, S. еpidermidis, Corynebacterium spp.), подавляет фузидиевая кислота [9]. Кроме того, концентрация этого антибиотика после однократного нанесения, в частности мази фуцидина, составляет в коже 2,2% (в эпидермисе —
430 мкг/мл, в дерме — 286 мкг/мл и подкожной жировой клетчатке —
109 мкг/мл); для сравнения: проникающая способность эритромицина составляет 0,3%, тетрациклина — 0,28%, мупироцина (бактробан) — 0,02%. Иными словами, фузидиевая кислота в 100 раз лучше проникает в кожу, чем мупироцин, и в 8 раз лучше, чем тетрациклин и эритромицин. Показано, что фузидиевая кислота проникает даже в деваскуляризированные зоны и некротические ткани, а ее биодоступность составляет 90%.
Поскольку при атопическом дерматите экзематозное поражение кожи, в частности области экссудации и экскориации, представляет собой благоприятную среду для размножения S. аureus, считается, что в лечении заболевания предпочтительнее использовать сочетание топического глюкокортикостероида с антибиотиком. Это позволит разорвать «порочный круг«: S. аureus снижает эффективность кортикостероидов посредством продуцируемого стафилококкового токсина, тогда как кортикостероиды подавляют воспаление.
Таким образом, доказана патогенетическая роль бактерий в развитии и поддержании аллергического воспаления при атопическом дерматите, что обосновывает необходимость применения комбинированных препаратов, содержащих топические кортикостероиды и антибактериальные средства. Показано, что назначение таких лекарственных средств позволяет более эффективно бороться с клиническими признаками атопического дерматита, чем терапия только одним наружным кортикостероидом. Так, в ходе двух рандомизированных клинических исследований (от 34 до 207 больных) сравнивалась эффективность местного применения различных комбинированных препаратов, содержащих антибактериальные средства в сочетании с топическими кортикостероидами, и монотерапии наружными кортикостероидами у больных атопическим дерматитом, имеющих кожные проявления вторичной инфекции [10, 11]. Клиническое улучшение констатировали у 54–95% участников, причем без статистически значимых различий субъективных и объективных данных в зависимости от использования различных комбинированных препаратов. Однако в группе с применением фузидиевой кислоты–гидрокортизона ацетат (фуцидин Г) клиническое улучшение наступало быстрее, чем в группе с применением миконазола–гидрокортизона [10], а лабораторно подтвержденный положительный эффект лечения в группе с применением бетаметазона валерата–фузидиевой кислоты (фуцикорт) был выше, чем в группе, где применяли миконазол–гидрокортизон [11].
Tакой подход — топическое использование антибиотика и крема — мягкого кортикостероида гидрокортизона — приводил к достоверно более ранней регрессии симптомов воспаления кожи при легком и среднетяжелом течении атопического дерматита [12]. Назначение крема, содержащего антибиотик и кортикостероид, представляется совершенно необходимым в случае клинических проявлений инфицирования кожи (мокнущая экзема). Такой препарат желательно использовать коротким курсом (до 1–2 нед), с тем чтобы избежать развития резистентности S. аureus [13]. При этом для применения на лице, кожных складках, в подмышечных впадинах, паховой области, на открытых участках тела предпочтительно выбирать комбинированный препарат в виде крема— мягкого кортикостероида и антибиотика (например, фузидиевая кислота + гидрокортизона ацетат (фуцидин Г), 2–3 раза в день в виде легких аппликаций). В случае острых и хронических форм дерматитов, локализованных на участках с толстой кожей (ладони и стопы), резистентных к слабым топическим кортикостероидам, целесообразнее назначить мазевую форму комбинированного препарата, содержащего кортикостероид средней/высокой активности (например, фузидиевая кислота/бетаметазона валерат (фуцикорт), целестодерм В с гарамицином и т. п.) 2–3 раза в день.
Вместе с тем исследования показали, что колонизация кожи S. аureus вновь наступала через 2–4 нед после завершения лечения комбиницией местного кортикостероида и антибиотика. Объясняется это прежде всего тем, что даже в случае применения высокочувствительных антибиотиков достичь полной эрадикации S. аureus очень сложно. Поддержанию инфицирования кожи способствуют такие факторы, как возможность передачи S. aureus от родителей, находящихся в непосредственном контакте с больным ребенком, а также содержание S. aureus в назальной слизи самого больного.
При неэффективности топических антибиотиков, а также атопическом дерматите, осложненном бактериальной инфекцией (например, импетиго), протекающей с лихорадкой, интоксикацией, воспалительными изменениями крови, показано назначение антибиотика широкого спектра действия перорально (цефалоспорины 1–3 поколений, макролиды, аминогликозиды) на 7–10 дней. Не рекомендуется прием фторхинолонов, тетрациклинов [7].
Однако, несмотря на то что в результате приема системных антибиотиков значительно снижался уровень микробиологически подтвержденной колонизации кожи S. аureus, все же это не способствовало клиническому улучшению течения тяжелой формы атопического дерматита у детей [14].
Способность достоверно снижать колонизацию S. aureus и частоту кожных инфекций описана также в отношении препаратов нового класса нестероидных топических иммунодепрессантов — ингибиторов кальциневрина такролимуса и пимекролимуса (элидел) [1, 4]. Так, в результате длительного применения пимекролимуса у детей в возрасте 3–23 мес жизни, страдающих атопическим дерматитом, было отмечено достоверно меньше случаев кожных инфекций [15]. Этот факт еще раз подтверждает важную роль Th2-опосредованного воспаления кожи и колонизации бактерий, при котором огромную роль играют взаимоотношения между цитокинами, адгезивными молекулами и антимикробными пептидами [4, 16]. Другой иммуносупрессивный препарат, действие которого также основано на ингибировании кальциневрина, — циклоспорин. Этот препарат обладает способностью уменьшать количество S. аureus на коже пациентов с атопическим дерматитом, что наиболее выражено у больных, одновременно имеющих высокую степень колонизации микроба и клинические проявления бактериальной инфекции кожи [17]. Однако применение данного препарата ограничено в педиатрической практике.
При грибковой инфекции, подтвержденной микробиологически, назначают: противогрибковые средства системного действия (флуконазол (дифлюкан) с периода новорожденности, детям старше 2 лет можно назначить тербинафин (экзифин), итраконазол (орунгал), кетоконазол — с 12 лет) в течение 7–14 дней в сочетании с местной терапией.
Кетоконазол и итраконазол ингибируют продукцию интерлейкина-4 и интерлейкина-5 и синтез эргостерола, что приводит к неспецифическому антивоспалительному эффекту и снижению уровня специфических IgE к Malassezia furfur [5].
При сочетанном поражении кожи больных атопическим дерматитом бактериальной и/или грибковой инфекцией наиболее оптимальными препаратами выбора являются комбинированные средства: тридерм, акридерм ГК. Тридерм в форме мази наносят на кожу туловища и конечностей, а в форме крема — на нежные участки кожи (в области складок, предплечья). В педиатрической практике в основном используют крем тридерм. Препарат наносят тонким слоем на пораженные участки кожи 2 раза в день, курс лечения в среднем составляет 7–12 дней.
Как известно, терапия наружными кортикостероидами служит стандартом лечения обострений атопического дерматита. Однако мощное противовоспалительное действие, присущее данным препаратам, может повысить чувствительность кожи к бактериальной и грибковой инфекциям, что является препятствием к длительному использованию топических гормональных средств при наличии этих инфекций. Кроме того, дети более чувствительны к наружным кортикостероидам из-за их высокой кожной абсорбции; последняя обусловлена также сухостью кожи [1]. Однако при этом есть предположения, что применение только монотерапии топическими антибиотиками или фунгицидными препаратами способствует сенсибилизации кожи, обострению аллергического воспаления с развитием кандидозной инфекции [18].
Во всех случаях врачу следует индивидуально подбирать для пациентов с атопическим дерматитом лекарственные средства — с учетом течения заболевания и состояния кожи.
При герпетической инфекции:
При контагиозном моллюске:
Иммуномодулирующая терапия
В случаях диагностирования у пациентов с атопическим дерматитом рецидивирующей бактериальной, грибковой и/или вирусной инфекции, а также при наличии у них очагов хронической инфекции, устойчивых к стандартной терапии, показано назначение иммуномодулирующей терапии, которая должна проводиться под контролем иммунологических показателей. В педиатрической практике наиболее широкое распространение получил ликопид — иммуномодулятор, обладающий способностью воздействовать на основные популяции клеток иммунной системы (макрофаги, Т- и В-лимфоциты), что, вероятно, связано с наличием у них специфических внутриклеточных рецепторов к глюкозаминилмурамилдипептиду [7, 18]. По своей структуре ликопид является синтетическим аналогом основного фрагмента пептидогликана клеточной стенки всех известных бактерий (мурамилдипептида). Активация макрофагов под воздействием ликопида приводит к усилению синтеза провоспалительных цитокинов (интерлейкина-1, фактора некроза опуходи a, колониестимулирующих факторов), в результате чего активируются фагоцитоз, пролиферация и дифференцировка Т- и В-лимфоцитов, усиливается синтез иммуноглобулинов, повышается цитотоксичность, стимулируется лейкопоэз.
Исследование С. Ю. Резайкиной, проводившееся у больных атопическим дерматитом, выявило преимущественное снижение функциональной активности нейтрофильного фагоцитоза (изменение кислородного метаболизма нейтрофилов), которое восстанавливалось при приеме ликопида [20]. В результате применения ликопида в комплексной терапии больных со среднетяжелым течением атопического дерматита существенно снизилась частота обострений заболевания и наблюдалась выраженная коррекция измененных лабораторных показателей.
Ликопид назначают детям в возрасте от 1 года до 16 лет внутрь в форме таблеток 1 мг. При лечении гнойно-воспалительных заболеваний кожи суточная доза препарата составляет 1 мг в течение 10 дней. При лечении герпетической инфекции препарат назначают внутрь в дозе 1 мг 3 раза в сутки в течение 10 дней. Противопоказания к применению ликопида: беременность, индивидуальная непереносимость препарата. В отдельных случаях возможно возникновение таких побочных эффектов, как повышение температуры тела до 37,9°С (является кратковременным, проходит самостоятельно и не требует отмены препарата). Взрослым ликопид назначают внутрь за 30 мин до еды (таблетки 10 мг) и сублингвально (таблетки 1 мг) в зависимости от степени тяжести заболевания.
Для изопринозина (инозин пранобекс) характерно двойное действие — противовирусное (за счет подавления репликации ДНК и РНК вирусов) и иммуномодулирующее (за счет комплекса инозина усиливается продукция интерлейкинов, хемотаксическая и фагоцитарная активность моноцитов и макрофагов, повышается синтез антител и усиливается пролиферация Т-лимфоцитов, Т-хелперов, естественных киллеров). Показанием к назначению изопринозина являются все вирусные инфекции кожи у страдающих атопическим дерматитом детей старше 1 года (контагиозный моллюск, герпесная инфекция, вульгарные бородавки, папилломавирусная инфекция). Изопринозин назначают по 1 таблетке на 10 кг/массы тела в сутки, на 3–4 приема в течение 10–14 дней — в зависимости от степени тяжести инфекционных заболеваний; при необходимости курс лечения повторяют.
По данным Л. В. Лусс, включение другого иммуномодулятора — полиоксидония — в комплексную терапию больных атопическим дерматитом и бронхиальной астмой, протекающими в сочетании с признаками вторичного иммунного дефицита и устойчивыми к проводимой терапии, позволяет добиться высокого клинического эффекта [21].
Среди детей, страдающих атопическим дерматитом, нередки случаи заболевания чесоткой. В таких случаях течение атопического дерматита сопровождается сильным упорным зудом кожи, а часто и ее инфицированием.
При присоединении чесотки лечение включает:
– спрегаль — применяется во всех возрастных группах и не имеет противопоказаний; распыляется в вечернее время на кожные покровы пациента от области шеи до подошв; препарат оставляют на 12 ч, после чего ребенка тщательно моют. При необходимости возможно повторное использование препарата через 4–10 дней после первичной обработки;
– бензилбензоат — 20% мазь наносят на кожные покровы в первый, второй, четвертый день, также со сменой белья, одежды, обработкой помещения;
– для обработки кожи можно использовать также 33% серную мазь, медифокс;
Таким образом, микробная колонизация и суперинфекция кожи (например, S. aureus, Malassezia furfur) могут играть определенную роль в обострениях атопического дерматита, что обосновывает необходимость дополнительного назначения больным антимикробных средств. Инфекционные агенты участвуют также в развитии и поддержании хронического аллергического воспаления кожи при атопическом дерматите. Как правило, такое течение заболевания характеризуется частыми рецидивами и тяжелым течением. Своевременная диагностика инфекций кожи и назначение оптимальной этиотропной терапии исключительно важны для достижения клинического улучшения состояния больных с атопическим дерматитом.
Эксперты по атопическому дерматиту подчеркивают, что этиотропную терапию можно прекращать только после купирования инфекционного процесса и очищения кожи [1]. Одновременно следует продолжать лечение противовоспалительными средствами (по показаниям — топические кортикостероиды коротким курсом, длительно — ингибиторы кальциневрина) на фоне непрерывного применения увлажняющих средств для гидратации кожи [2, 5].
Литература
Д. Ш. Мачарадзе, доктор медицинских наук, профессор
РУДН, Москва