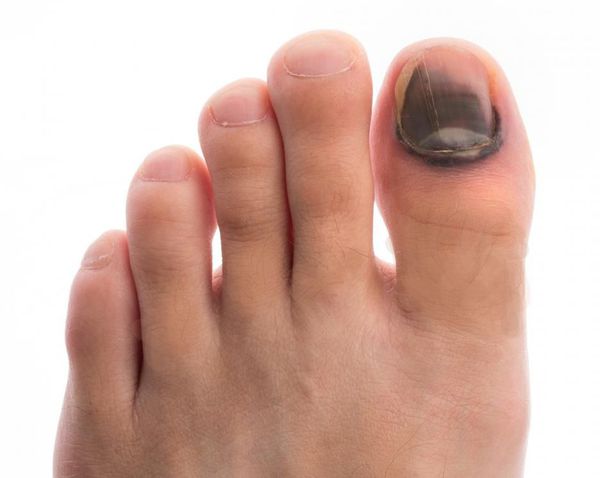
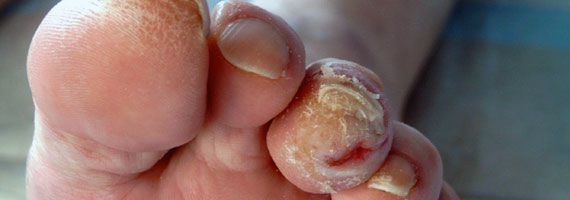
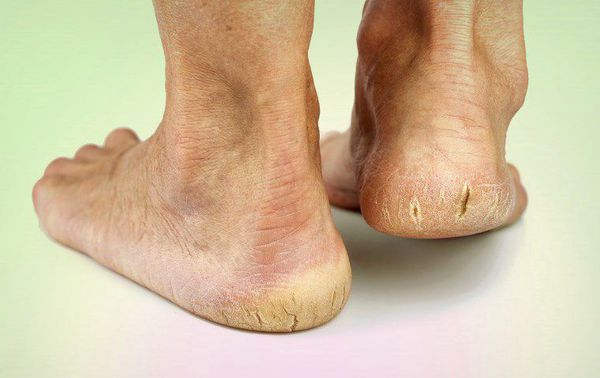
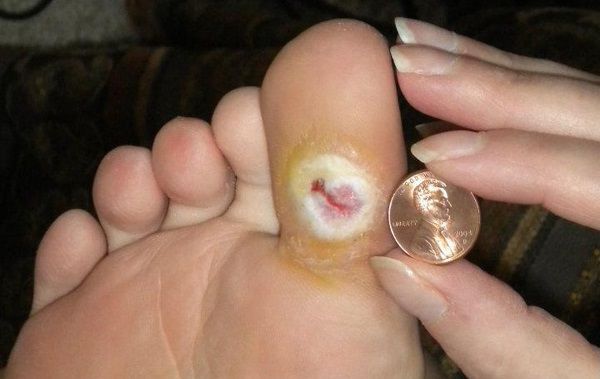
Чем лечить голеностопный сустав при сахарном диабете 2 типа
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 36 лет.
Определение болезни. Причины заболевания
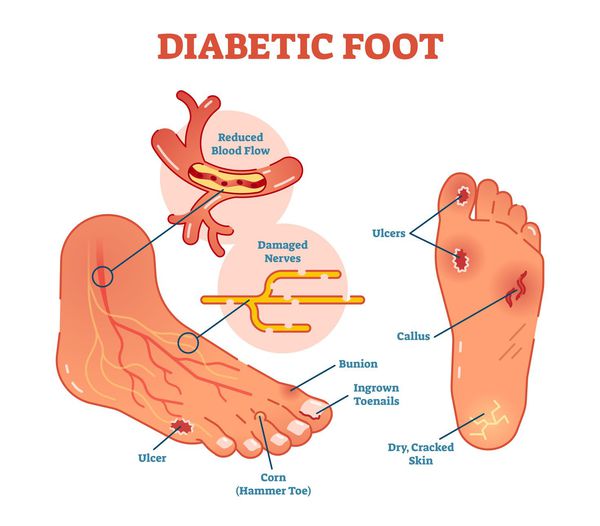
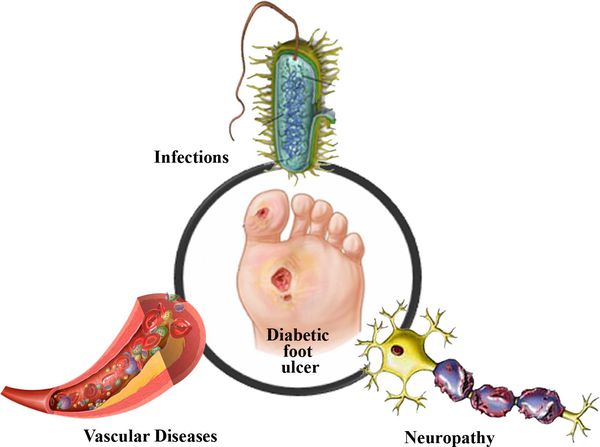
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [1]
Главная причина ДС — это Сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «Сахарный диабет» должен помнить о таком грозном возможном осложнении.
СДС развивается в разной степени и разных формах:
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-«мозолью» в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
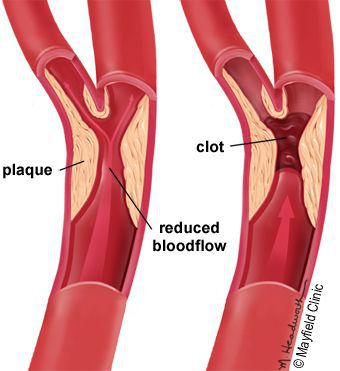
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
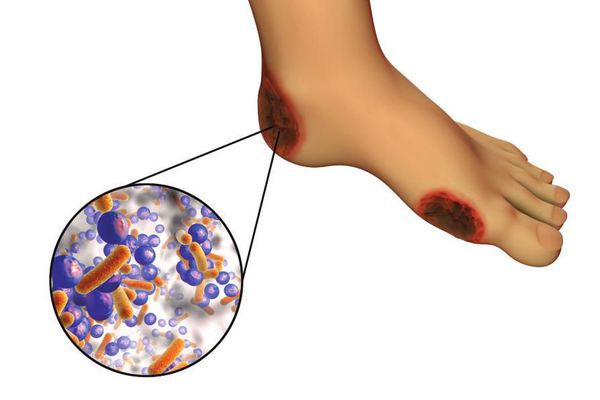
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
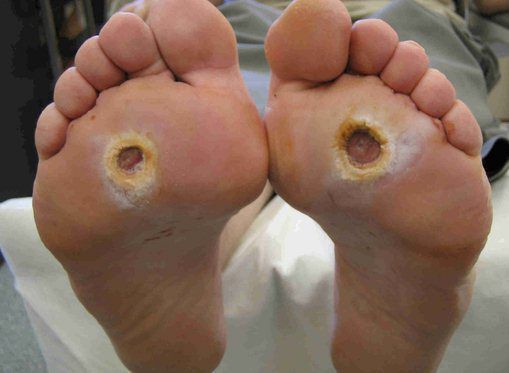
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую патологическую последовательность:
Таки образом, при СДС происходит повреждение всех тканей нижней конечности.
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
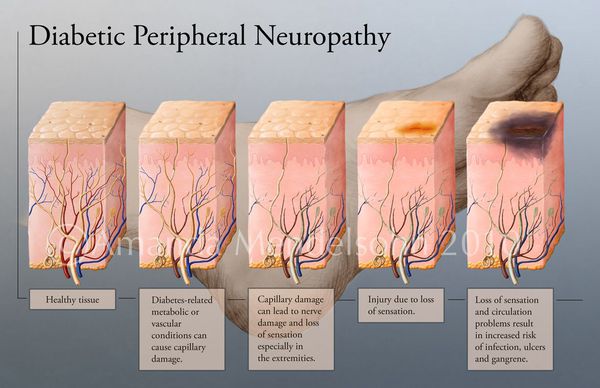
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
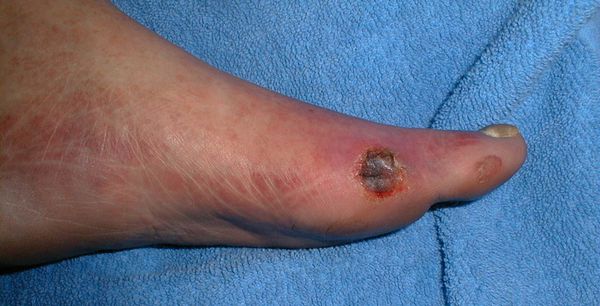
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
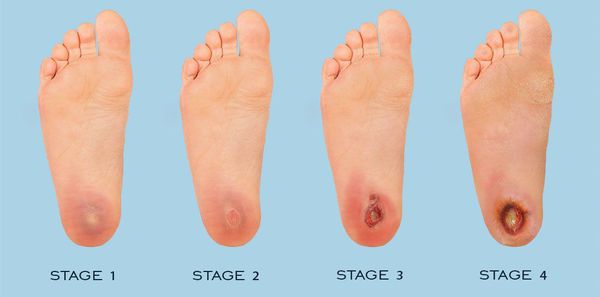
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Урок 11. Осложнения на ноги
Причины поражения стоп
У пациентов с сахарным диабетом достаточно часто возникают различные патологические изменения стоп, причем даже обычные проблемы (например, мозоли или трещины) могут привести к серьезному осложнению — синдрому диабетической стопы (язва на стопе, гангрена стопы).
Основными причинами развития поражений стоп при сахарном диабете являются:
Периферическая нейропатия
С одной стороны, симптомами периферической нейропатии могут быть боль, ощущение ползания мурашек, судороги, с другой — пораженные нервные волокна теряют чувствительность к боли, теплу и холоду, давлению. Это значит, что вы можете не почувствовать травму: например, вы можете не заметить инородный предмет в ботинке или ожог при согревании ног около камина или батареи до тех пор, пока уже не образуется рана.
Деформация пальцев и свода стопы
Поражение нервных волокон может привести к деформации пальцев и свода стопы, что, в свою очередь, также может закончиться язвенными дефектами стоп. Если у вас есть какие-либо изменения: «косточки», плоскостопие, деформация пальцев — спросите своего врача, где можно заказать или приобрести ортопедическую обувь. Ношение индивидуальной ортопедической обуви — обязательная профилактика возникновения язв стопы.
Снижение кровотока в артериях нижних конечностей (атеросклероз артерий нижних конечностей)
Основными причинами развития атеросклероза при сахарном диабете являются:
Таким образом, для профилактики развития атеросклероза надо контролировать все эти факторы. Основным клиническим симптомом атеросклероза артерий нижних конечностей является возникновение боли при ходьбе — так называемая перемежающаяся хромота, которая проходит через некоторое время после остановки. Если у вас есть этот симптом, вы незамедлительно должны бросить курить. Также необходимо регулярно принимать препараты, контролирующие артериальное давление и снижающие уровень атерогенных липидов в крови. В некоторых случаях могут быть эффективны препараты, улучшающие периферический кровоток.
При плохом кровообращении ваши ноги могут постоянно мерзнуть. Помните, что нельзя согревать ноги на батарее, у открытого огня, парить в горячей воде — это может привести к образованию ожогов и язвенных дефектов, поскольку у вас также может быть нейропатия, т.е. вы не будете чувствовать высокую температуру. Лучший способ согреть ноги — носить теплые носки.
Как возникают проблемы с ногами?
Повреждения кожи
Кожа при сахарном диабете становится очень сухой, что может привести к ее шелушению и появлению трещин. Все дело в том, что поражаются нервные волокна, отвечающие за водный и липидный баланс кожи. Повреждения заживают длительно, а кроме того, могут инфицироваться. Вероятность этого особенно велика при высоком уровне глюкозы в крови. Для профилактики трещин и шелушения после ванны ноги тщательно вытирают, уделяя особое внимание межпальцевым промежуткам. Для предотвращения появления трещин необходимо мазать подошвы и пятки увлажняющим кремом, при этом нельзя втирать крем в межпальцевые промежутки.
Мозоли и натоптыши
При сахарном диабете мозоли встречаются гораздо чаще и нарастают гораздо быстрее, чем у остальных людей. Это обусловлено деформацией пальцев и свода стопы, а также перераспределением зон высокого давления. Таким образом, мозоли могут являться свидетельством того, что вам необходимы ортопедические корректоры или обувь.
Если своевременно не удалять мозоли, то они будут трескаться и инфицироваться, приводя к развитию язвенных дефектов. Однако самим удалять большие и старые мозоли опасно. Лучше обратиться в кабинет «Диабетической стопы», где опытный персонал при помощи специального аппарата обработает вам ноги.
Ежедневная обработка натоптышей и мозолей с помощью пемзы поможет предотвратить их нарастание, причем лучше всего использовать пемзу после душа или ванны, пока кожа еще влажная. Ни в коем случае нельзя пользоваться бритвенными лезвиями или терками, а также какими-либо химическими растворами — это может привести к повреждению или ожогам и дальнейшему инфицированию. После обработки мозолей пемзой необходимо смазывать их кремом.
Синдром диабетической стопы
Иногда пациенты говорят: «У меня диабетическая стопа», подразумевая, что так называется нога при сахарном диабете. На самом деле синдром диабетической стопы — это очень серьезное осложнение сахарного диабета, проявляющееся наличием язвы на стопе.
Язвенные дефекты чаще всего образуются в местах наибольшего давления: головки плюсневых костей, межфаланговые сочленения при деформации пальцев. Язвенные дефекты на боковых поверхностях стоп чаще всего свидетельствуют о тесной обуви.
Даже если язва никак вас не беспокоит, вы немедленно должны проконсультироваться с вашим лечащим врачом или врачом кабинета «Диабетическая стопа».
В зависимости от состояния вашей язвы, врач:
После заживления язвенного дефекта вы должны соблюдать правила ухода за ногами и при необходимости носить ортопедическую обувь.
Синдром диабетической стопы
Как сохранить ноги
Подзаголовок статьи может показаться несколько вызывающим. «Как сохранить ноги…» К сожалению, именно на этот вопрос приходится искать ответы тем, кто столкнулся с диагнозом «диабетическая стопа».
КОВАРСТВО ДИАБЕТИЧЕСКОЙ СТОПЫ
Я не сомневаюсь, что название этого грозного синдрома прекрасно известно всем страдающим сахарным диабетом. Врачи наверняка рассказывали о мерах предосторожности и предупреждали о симптомах. Но, увы, диабет трудно контролировать, а развитие синдрома диабетической стопы может занять десятилетия. Медленные изменения не привлекают внимания до тех пор, пока развитие патологии не переходит в «высокую» стадию.
Не хочу никого пугать, но считаю, что эту статистику должен знать каждый больной сахарным диабетом. Это превосходный стимул для строжайшего следования правилам профилактики. Итак
Эти цифры слишком красноречивы, чтобы оставить их без внимания.
ДИАБЕТ РАЗРУШАЕТ СОСУДЫ
Особенность анатомии человека такова, что скачки содержания сахара в крови разрушающе действуют на кровеносные сосуды нижних конечностей. Происходит необратимое повреждение артерий малого диаметра и, соответственно, нарушение кровообращения. Возникает так называемая ишемическая форма диабетической стопы – из-за недостаточного питания деградируют ткани на ногах, образуются и разрастаются незаживающие раны, разрушается костная ткань, нервы, суставы, сухожилия. Нарастает серьезный риск развития гангрены, сепсиса, ампутации.
ДИАБЕТ УБИВАЕТ НЕРВЫ
Высокий уровень сахара в крови приводит к снижению проводимости нервных волокон, расположенных на ступнях. В результате теряется чувствительность и драматически возрастает риск получения случайной травмы. Больной просто не замечает повреждения на ногах, а ишемия не дает возможности ранам заживать. Заболевание прогрессирует.
ДИАБЕТИЧЕСКАЯ СТОПА: ДИАГНОСТИКА
Диагностика при синдроме диабетической стопы – это сложная комплексная медицинская задача. Обязательно проводится аппаратное исследование состояния артерий, определяется состояние костей стопы, анализируется чувствительность – тактильная, температурная и вибрационная. Обязателен бактериальный анализ и, разумеется, развернутый анализ крови.
В клинике сосудистой хирургии установлено самое совершенное на сегодняшний день оборудование, позволяющее быстро и точно определить состояние конечностей и составить адекватную тактику лечения.
ЛЕЧЕНИЕ ДИАБЕТИЧЕСКОЙ СТОПЫ: ПОМНИМ О ДИАБЕТЕ!
Я должен подчеркнуть, что при лечении диабетической стопы необходимо всегда помнить о первопричине заболевания – сахарном диабете. Необходимо квалифицированное наблюдение эндокринолога, строжайшее соблюдение рекомендаций и назначений, а также постоянный контроль уровня глюкозы. Нормализация углеводного обмена – принципиальное условие успешного лечения.
 | Записаться на приём к профессору Матвееву |  |
ЛЕЧЕНИЕ ДИАБЕТИЧЕСКОЙ СТОПЫ: ВОССТАНАВЛИВАЕМ ПРОХОДИМОСТЬ СОСУДОВ
Основная причина поражения стоп – это нарушение кровоснабжения. Соответственно, для устранения последствий ишемии необходимо восстановить функциональность артерий.
В Клинике сосудистой хирургии применяются методы малотравматичного эндоскопического лечения кровеносных сосудов. Операции баллонной ангиопластики (расширения просвета при помощи вводимого внутрь артерии надуваемого воздухом баллона) и стентирования (установки сетчатого каркаса, жестко фиксирующего просвет артерии).
Восстановление кровоснабжения создает условия для заживления язв и ликвидации воспалительных процессов.
СОСУДИСТАЯ И ГНОЙНАЯ ХИРУРГИЯ: ПРОБЛЕМА ВЗАИМОДЕЙСТВИЯ
Диабетическая стопа относится к патологиям, лечение которых должно быть комплексным и включать проведение операции на сосудах и лечение открытых язв. «Традиционные» клиники достаточно настороженно относятся к такому сочетанию – необходимость одновременного использования методов сосудистой и гнойной хирургии приводит к значительным техническим и организационным проблемам. В результате – нарушение комплексности и снижение качества лечения.
В Клинике сосудистой хирургии мы изначально ориентировались именно на комплексный подход, инфраструктура Клиники позволяет максимально эффективно воздействовать на диабетическую стопу.
ДИАБЕТИЧЕСКАЯ СТОПА: ТОЛЬКО ОПРАВДАННЫЕ ОЖИДАНИЯ
Я не хочу внушать неоправданные надежды. Реальность такова, что при развитии на фоне диабетической стопы гнойно-некротического процесса вероятность ампутации достигает 75%.
Правильное лечение и, прежде всего, восстановление нормального кровообращения, позволяет избежать ампутации при диабетической стопе на 1-3 стадиях.
Если началась диабетическая гангрена (диабетическая стопа 4-5 стадии), задача заключается в минимизации объема ампутации. Я опять повторю про необходимость восстановления кровоснабжения – в этом случае возможно ограничиться удалением необратимо пораженных участков стопы (как правило, один-два пальца). Здесь главное – избежать «высокой ампутации» и сохранить функциональность ноги.
ДИАБЕТИЧЕСКАЯ СТОПА: ПРОФИЛАКТИКА
Основные рекомендации по профилактике диабетической стопы сводятся к заботе о состоянии ног (подробнее – в статье « Рекомендации пациентам с синдромом диабетической стопы »).
Отмечу, что раннее обращение к специалисту позволит избежать тяжелых последствий. Будьте осторожны и внимательны к своему здоровью!
 | Записаться на приём к профессору Матвееву |  |
Диабетическая стопа
Синдром диабетической стопы — явление комплексное. Оно состоит из:
Симптомы диабетической стопы
В результате больные диабетом теряют чувствительность ног. А раз так, травмы стоп становятся практически неизбежными. И это приводит к опасным осложнениям. Пониженный иммунитет провоцирует развитие инфекций, поэтому раны гноятся, воспаляются и долго заживают.
Специалисты различают три формы синдрома диабетической стопы:
Диабетическая язва стопы — самая частая причина госпитализации людей с диабетом в мире.
Чаще всего синдром диабетической стопы встречается у пациентов в возрасте старше 40 лет.
Ампутации нижних конечностей у больных сахарным диабетом производятся в 17-45 раз чаще, чем у лиц, не страдающих диабетом. При этом 6-30% больных после первой ампутации подвергаются ампутации второй конечности в течение 1-3 лет, через 5 лет — 28-51%.
Диагностика синдрома диабетической стопы включает в себя исследование тактильной и температурной, а также вибрационной чувствительности; измерение давления в артериях ног, рентгенологическое исследование костей стопы, проведение ангиографии сосудов; исследование выделений из ран на бактерии; развернутый анализ крови.
Лечение диабетической стопы
Тем не менее, прогрессирование синдрома диабетической стопы даже при правильном лечении далеко не всегда можно остановить. До сих пор развитие гнойно-некротического процесса на фоне диабетической стопы более чем в 50-75% случаев приводит к ампутациям.
 | В нашей клинике применяются самые современные малоинвазивные методы рентгенангиохирургического, эндовазального лечения синдрома диабетической стопы. Баллонная дилатация пораженных диабетом артерий голени позволяет остановить инфекционный процесс, заживить язвы и избежать диабетической гангрены и ампутации на 1-3 стадиях заболевания. Восстановление проходимости артерий голени у больных с уже начавшейся диабетической гангреной (4-5 стадии) дает возможность ограничить объём операции удалением только необратимо пораженных тканей стопы (чаще всего — одного или двух пальцев), избежать «высокой» ампутации и сохранить ногу. |
У вас диабетическая стопа? Начальная стадия – возможность быстро излечиться!
Лечение диабетической стопы
Лечение диабетической стопы нередко начинают уже на далеко зашедших стадиях болезни, а ведь это тяжелое осложнение сахарного диабета при своевременном начале лечения вполне можно обратить вспять.
Но для этого следует вовремя обратиться к опытным врачам, таким, какие трудятся в центре Д.В. Матвеева. Наши специалисты способны распознать заболевание на ранней стадии и не позволить ему прогрессировать.
Для тщательной диагностики в нашем распоряжении имеется самое современное оборудование, которое позволяет максимально точно определить состояние сосудов, нервов, костей и выбрать наиболее подходящий конкретном пациенту способ лечения. Мы стараемся использовать самые малотравматичные методики, такие как рентген-эндоваскулярная, «внутрисосудистая» хирургия (баллонная ангиопластика, стентирование).
Лечение диабетической стопы не будет эффективным без терапии основного заболевания – сахарного диабета, поэтому участие эндокринолога обязательно. Он сможет нормализовать углеводный обмен и помочь ангиохирургам побороть нарушение кровоснабжения, восстановить функциональность артерий.
Наша цель – сохранение конечности, ее опорной функции, и скорейшее заживление язв и ран.
Диабетическая остеоартропатия
Что такое стопа Шарко? В чем трудность диагностики диабетической остеоартропатии? Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) — редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимо
Что такое стопа Шарко?
В чем трудность диагностики диабетической остеоартропатии?
Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) — редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимой инвалидизации. Это осложнение можно назвать одной из самых загадочных форм синдрома диабетической стопы, так как предсказать развитие ОАП и выделить группы риска среди пациентов с сахарным диабетом крайне трудно. С этим осложнением диабета встречаются врачи разных специальностей — хирурги, эндокринологи, ортопеды, но далеко не всегда оно вовремя распознается.
Современное определение диабетической остеоартропатии — «деструкция кости и сустава неинфекционного характера, вызванная диабетической нейропатией» [1].
Деструктивная остеоартропатия была описана в ХIХ веке французским неврологом Шарко [2], но не при сахарном диабете (в доинсулиновую эру поздние осложнения диабета практически не встречались), а при сифилитическом поражении проводящих путей спинного мозга (tаbеs dоrsаlis). Впоследствии было установлено, что подобные изменения суставов стоп также встречаются при различных заболеваниях, приводящих к нарушению иннервации нижних конечностей (сирингомиелии, диабетической полинейропатии и др.). В настоящее время наиболее частой формой остеоартропатии является диабетическая.
Распространенность данного осложнения среди больных сахарным диабетом составляет менее 1% [3], хотя в литературе встречаются данные о поражении костной ткани стоп у 0,1-55% больных [4]. Такая противоречивость сведений, очевидно, связана с различиями в методике обследования и разными критериями диагностики остеоартропатии.
Локализация поражений
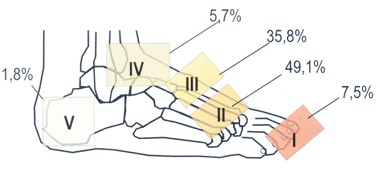
В подавляющем большинстве случаев ОАП поражает кости и суставы стоп. В 1991 году была предложена классификация ОАП [3] в зависимости от локализации процесса (рис. 1). У 20-25% пациентов ОАП поражает обе стопы, но обычно не одновременно. Встречаются случаи ОАП с поражением других суставов: коленного и даже локтевого.
 |
| Рисунок 1. |
Этиология, патогенез и естественное течение ОАП
Остеоартропатия — это по сути поражение костной ткани в отличие от типичных форм остеопороза, имеющих исключительно локальный характер. Причиной такого поражения кости является нарушение иннервации нижних конечностей вследствие диабетической нейропатии.
Длительное время развитие ОАП рассматривалось в основном с позиций нейротравматической и нейроваскулярной [5]. Согласно первой, моторная и сенсорная (посредством утраты проприоцептивных рефлексов) формы нейропатии приводят к нарушениям биомеханики стопы. Результатом этого является аномальная нагрузка на отдельные суставы стопы при ходьбе, приводящая через некоторое время к их деструкции. Альтернативная теория основана на обнаружении при ОАП признаков артериовенозного шунтирования крови через сосудистое русло костной ткани, в связи с чем было сделано заключение о ведущей роли аномального усиления кровотока в костной ткани в развитии локальной остеопении [6]. В 1989 году ученые выдвинули предположение о том, что в развитии ОАП определенную роль играют как рецидивирующая травма стоп, так и усиление кровотока в костной ткани. Таким образом оба этих патологических процесса нашли отражение в «синтетической» теории [7].
Известно, что ОАП не развивается у пациентов с нарушениями кровоснабжения нижних конечностей. Это объясняется тем, что при ишемической и нейроишемической формах синдрома диабетической стопы невозможно аномальное усиление кровотока в костной ткани.
Несмотря на то что факт развития ОАП лишь при тяжелой диабетической нейропатии хорошо известен, предсказать развитие ОАП практически невозможно, так как это осложнение возникает далеко не у всех больных даже с выраженной нейропатией. В связи с этим было высказано предположение, что ОАП вызывает не любая форма, а лишь определенные «подвиды» нейропатии. В 1992 году британские исследователи выдвинули гипотезу (впоследствии подтвержденную в ряде работ), что к ОАП приводит особая форма диабетической нейропатии с преимущественным поражением миелиновых нервных волокон и относительной сохранностью безмиелиновых, что вызывает нарушение тонуса микрососудов, которое влечет за собой усиление кровотока в костной ткани [8].
Эти патологические процессы служат предпосылкой, своего рода фоном для манифестации ОАП — остеопороза дистальных отделов нижних конечностей, снижающего устойчивость кости к повреждающим воздействиям. В этой ситуации провоцирующий фактор (минимальная травма при ходьбе или хирургическое вмешательство на стопе) приводит к повреждению кости или усилению в ней кровотока, активации остеокластов и «запускает» бурный и безостановочный процесс остеолиза, в отсутствие лечения приводящий к разрушению скелета стопы.
После манифестации ОАП процесс проходит четыре стадии [4].
 |
| Рисунок 2. |
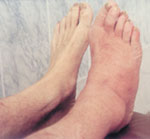
Первая (острая) стадия характеризуется отеком стопы, умеренной гиперемией и местной гипертермией (рис. 2). Боли и лихорадка нехарактерны. Рентгенография может не выявлять деструктивных изменений (на этой стадии они представлены лишь микропереломами); обнаруживается остеопороз костей стоп.
 |
| Рисунок 3. |
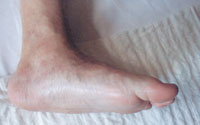
Вторая (подострая): фрагментация костей и начало деформации стопы. В типичных случаях происходит уплощение свода стопы на пораженной стороне (рис. 3). Отек и воспалительные явления в этой стадии уменьшаются. Рентгенологически определяются фрагментации костных структур.
 |
| Рисунок 4. |
 |
| Рисунок 5а. |
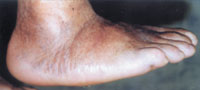
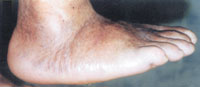
Третья (хроническая): выраженная деформация стопы, наличие спонтанных переломов и вывихов. Вид деформации зависит от локализации поражения. В типичных случаях нагрузки на стопу при ходьбе приводят к деформации по типу «пресс-папье» или «стопы-качалки» (рис. 4). Это сопровождается вальгусной деформацией внутреннего края стопы в области предплюсны, клювовидной деформацией пальцев. Рентгенологически — фрагментация костей, выраженная деформация скелета, периостальное и параоссальное обызвествление (рис. 6). Функция скелета стопы полностью нарушается, в тяжелых случаях стопу можно образно сравнить с «мешком с костями».
 |
| Рисунок 5б. |
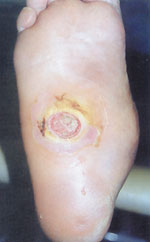
Четвертая (стадия осложнений): перегрузка отдельных участков деформированной стопы приводит к образованию язвенных дефектов (рис. 5); при их инфицировании возможно развитие флегмоны стопы, остеомиелита, гангрены.
Диагностика
Из-за сложности лечения ОАП, а также в связи с тем, что в популяции это состояние встречается достаточно редко, пациентов с подозрением на ОАП для диагностики и лечения следует направлять в специализированные отделения (центры) «Диабетическая стопа».
 |
| Рисунок 6. |
ОАП диагностируется на основании клинической картины, анамнеза (небольшая травма, хирургическое вмешательство) и рентгенологических признаков, соответствующих той или иной стадии. Очень часто из-за недостаточной информированности врачей общей практики об ОАП это осложнение ошибочно диагностируется как лимфостаз, тромбофлебит, флегмона стопы и др.
Наиболее затруднен дифференциальный диагноз в острой стадии, когда несвоевременное начало адекватного лечения приводит к необратимой инвалидизации.
 |
| Рисунок 7. |
Дифференциальная диагностика ОАП в острой фазе включает два основных вопроса:
Для решения первого вопроса необходимы данные рентгенографии стоп (хотя в острой фазе могут присутствовать лишь неспецифические изменения в виде остеопороза). Магнитно-резонансная томография и сцинтиграфия скелета стопы выявляют микропереломы, воспалительные изменения, усиление кровотока в пораженных костях.
Возможна оценка биохимических маркеров распада костной ткани (гидроксипролина, дезоксипиридинолина, фрагментов коллагена и др.). С аналогичной целью могут использоваться и маркеры перестройки костной ткани, отражающие активность остеобластов (то есть остеосинтеза), — костный изофермент щелочной фосфатазы и др. Но уровень этих веществ во многом зависит от активности процессов распада костной ткани в скелете в целом.
Очевидно, что изменения, характерные для других заболеваний: признаки острого тромбофлебита при УЗДГ венозной системы, типичная клиника подагрического артрита (с болевым синдромом и лихорадкой, соответствующей рентгенологической и биохимической картиной) и прочие — делают диагноз ОАП менее вероятным.
Для остальных случаев наиболее приемлемым на сегодняшний день алгоритмом диагностики ОАП в острой фазе можно считать следующий [9]:
При возникновении у больного сахарным диабетом одностороннего отека стопы (особенно при неповрежденной коже) следует обязательно исключить возможность ОАП. При подозрении на ОАП и при повышенном риске ее развития (длительное течение сахарного диабета, выраженная диабетическая нейропатия) целесообразнее назначить лечение сразу, чем через несколько месяцев наблюдать необратимую деформацию стопы.
Второй вопрос чаще возникает при наличии трофической язвы стопы или в послеоперационном периоде после ампутации в пределах стопы или другого оперативного вмешательства. Это связано с тем, что остеомиелит при синдроме диабетической стопы чаще всего вторичный, являющийся осложнением трофической язвы или раневого процесса. В решении этого вопроса помогают данные анализа крови: нейтрофильный лейкоцитоз характерен (хотя и необязателен) для остеомиелита, но не для ОАП. Об остеомиелите свидетельствуют также некоторые рентгенологические признаки (реакция надкостницы), а также наличие свища, зондирование костных структур в дне раны. Эффективный, но малодоступный метод исследования — сцинтиграфия скелета с введением лейкоцитов с радиоактивной меткой. «Золотым стандартом» в определении природы деструкции костной ткани является биопсия кости.
Лечение ОАП
В острой фазе цель лечения — остановка процессов остеолиза, предотвращение патологических переломов или их консолидация.
Наиболее частая ошибка — назначение вазоактивных препаратов. Эти средства показаны далеко не при всех формах синдрома диабетической стопы (только при ишемической и нейроишемической), а при ОАП способны усилить и без того избыточный кровоток в костной ткани.
Основой лечения ОАП в острой стадии является полная разгрузка конечности до исчезновения признаков воспаления (отека, локальной гипертермии). Адекватная разгрузка обеспечивает консолидацию костных отломков и более важна, чем медикаментозное лечение [3]. Если разгрузка не проводится, наиболее вероятны смещение костных отломков и развитие прогрессирующей деформации стопы, представленной на рис. 2-5. В первые дни и недели заболевания показан строгий постельный режим. В дальнейшем возможна ходьба, но только в специально изготовленном ортезе, переносящем значительную часть нагрузки со стопы на голень. Временная разгрузка в период изготовления ортеза может выполняться с помощью тутора, который отличается от ортеза стандартной формой (продается в готовом виде) и менее плотной фиксацией конечности.
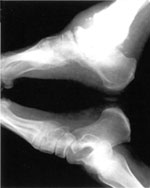
После разрешения отека (обычно через 4 месяца) от ношения ортеза постепенно отказываются, а пациенту разрешают ходить в индивидуально изготовленной ортопедической обуви (рис. 7).
Стандартным методом разгрузки конечности при ОАП в большинстве зарубежных стран, особенно англоязычных (США, Великобритания, Австралия и др.), является применение фиксирующих повязок из полимерных материалов, по свойствам аналогичных гипсу (Тоtаl Соntасt Саst). Но даже при наличии высококвалифицированного персонала, проводящего эту процедуру, метод чреват развитием повреждений кожи (пролежней) под иммобилизирующей повязкой в 10% случаев.
В острой фазе ОАП применяются лекарственные препараты, влияющие на метаболизм костной ткани.
Тормозят процесс резорбции костной ткани бифосфонаты и кальцитонин.
Отечественный бифосфонат первого поколения ксидифон (этидронат) отличается доступной ценой. Назначается по 15-25 мл готового раствора натощак прерывистыми курсами (например, первые 10 дней каждого месяца), так как постоянный его прием создает риск остеомаляции. Современные бифосфонаты — фосамакс (алендронат) и другие — применяются в постоянном режиме и более эффективны. Доза фосамакса — 10,0 мг (одна таблетка) натощак ежедневно. Имеются сообщения о внутривенном применении бифосфонатов [бонефос (клодронат)] при ОАП.
Кальцитонин (миакальцик) применяется подкожно или внутримышечно по 100 МЕ один раз в день (обычно 1-2 недели), далее — в виде назального аэрозоля по 200 МЕ ежедневно.
Образование костной ткани стимулируют активные метаболиты витамина Д3 (альфа Д3-Тева и др.) и анаболические стероиды.
Альфа Д3-Тева применяется по 0,5-1 мкг/сут (2-4 капсулы) после еды. Альфа Д3-Тева способствует улучшению абсорбции кальция в кишечнике и активации процессов костного ремоделирования, обладает способностью подавлять повышенный уровень паратиреоидного гормона, усиливать нервно-мышечную проводимость, уменьшая проявления миопатии. Длительная терапия Альфа Д3-Тева способствует уменьшению болевого синдрома, повышению мышечной силы, координации движений, снижению риска падений и переломов костей. Частота побочных реакций на фоне длительной терапии Альфа Д3-Тева остается низкой.
Анаболические стероиды (ретаболил, неробол) назначают в виде инъекций один раз в неделю в течение 3-4 недель.
Препараты кальция самостоятельного действия на метаболизм костной ткани не оказывают, поскольку включение кальция в состав костной ткани регулируется соответствующими гормонами. Эти препараты применяются как вспомогательные для обеспечения достаточного потребления кальция при лечении патологии костной ткани (которое должно составлять с учетом всех пищевых продуктов 1000-1500 мг/сут). Наибольшей биодоступностью обладают лактат и карбонат кальция. Они входят в состав препаратов кальций-Сандоз форте, витрум-кальциум и кальций-Д3-Никомед, которые можно назначать по одной таблетке в день (около 500 мг элементарного кальция). Последний из названных препаратов содержит также витамин Д3, но в профилактических дозах, поэтому это средство следует рассматривать в первую очередь как источник кальция. Препараты кальция принимают во второй половине дня, так как именно в это время происходит их максимальное усвоение. Глюконат кальция (таблетки по 100 мг) стоит недорого, но отличается низкой биодоступностью, из-за чего необходимая суточная доза препарата составляет 10 таблеток.
Кальцитонин и бифосфонаты способны вызывать гипокальциемию, витамин Д3 и препараты кальция — повышать уровень кальция в крови. Поэтому необходимо определение уровня ионизированного кальция до начала лечения и ежемесячно на его фоне (в современных лабораториях этот показатель определяется в капиллярной крови). Обычно применяется комбинация какого-либо из ингибиторов резорбции, витамина Д3 и препаратов кальция. В зависимости от уровня ионизированного кальция дозы тех или иных препаратов увеличиваются или уменьшаются. Продолжительность лечения составляет 4-6 месяцев.
Вспомогательные средства (НПВС, эластичное бинтование конечности, иногда диуретики) применяются в целях устранения отека.
Рентгенотерапия пораженных суставов позволяет достаточно быстро купировать воспалительные явления. Однако, по данным ряда плацебо-контролируемых исследований, факт улучшения прогноза течения ОАП после рентгеновского облучения не подтвердился. Поэтому рентгенотерапию следует применять только в сочетании с адекватной разгрузкой конечности.
Оптимальным результатом лечения, начатого в острой фазе, является предотвращение переломов или консолидация отломков. О результатах лечения позволяют судить изменения клинической картины и контрольная рентгенография через 4-6 месяцев от манифестации заболевания.
После стихания воспалительных явлений сохраняется повышенный риск ОАП (в этой же или других зонах). Помимо общих профилактических мер (см. ниже) целесообразно носить ортопедическую обувь, уменьшающую нагрузку на суставы стопы (в первую очередь, предплюсны) при ходьбе.
В том случае, если процесс находится на второй или третьей стадии, основной целью лечения становится предотвращение осложнений ОАП. При наличии деформаций стопы необходима сложная ортопедическая обувь с внутренним рельефом, повторяющим аномальную форму стопы. Ригидная подошва с так называемым перекатом — приподнятой передней частью — препятствует дальнейшему смещению костных отломков при ходьбе. Постоянное ношение качественной ортопедической обуви предотвращает развитие трофических язв в местах повышенного давления. Попытки ортопедической коррекции деформаций при ОАП (супинаторы и т. п.) бесперспективны и чреваты быстрым развитием язв.
Методы хирургического восстановления скелета стопы при ОАП
Предложен ряд методов оперативного вмешательства, направленных на коррекцию деформации стопы при ОАП (артродез, резекция костных структур, создающих повышенное давление на подошвенную поверхность и приводящих к образованию незаживающей язвы), но в России опыт их применения невелик. Несомненным условием использования этих методов является полное стихание воспалительного процесса и остеолиза (так как в противном случае оперативное вмешательство может способствовать появлению новых очагов деструкции). Вероятно, лечение препаратами, укрепляющими костную ткань, создает более благоприятные условия для проведения операции. Однако вопрос о показаниях к хирургическому лечению и его безопасности при ОАП по-прежнему остается спорным. Чаще всего показанием к такому лечению служит тяжелая деформация стопы, делающая невозможным изготовление адекватной ортопедической обуви. В любом случае после оперативного вмешательства необходимо обеспечить полную 3-месячную разгрузку пораженной конечности (постельный режим, далее — Total Contact Cast или его аналог) [3].
Профилактика ОАП
Вопрос о методах профилактики в группах риска окончательно не решен. Своевременное выявление остеопении в дистальных отделах конечностей позволило бы восстанавливать костную плотность с помощью соответствующих препаратов. Однако остеопороз скелета стоп при рентгенографии у больных диабетом встречается в десятки раз чаще, чем ОАП, в связи с чем группа пациентов, имеющих показания для профилактического лечения, становится неоправданно большой. Кроме того, недостаточно разработаны методы количественной оценки костной плотности (денситометрии) скелета стоп, без которых невозможно составить представление об изменениях плотности костной ткани на фоне лечения, а также выбрать наиболее эффективные препараты и т. п.
Следовательно, основой профилактики ОАП остается адекватное лечение сахарного диабета, подобранное с учетом современных рекомендаций: обучение больных методам самоконтроля, поддержание гликемии на уровне, близком к «недиабетическому», и своевременное назначение инсулина при СД 2-го типа.
Артроз суставов на фоне диабета: симптомы, лечение, операции
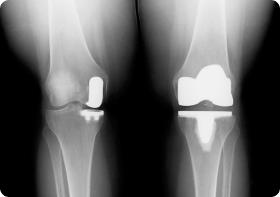
Диабетическая остеоартропатия представляет собой деструктивное поражение костной и хрящевой суставной ткани на фоне сахарного диабета. При длительном повышенном уровне сахара в крови возникает метаболическая патология, при которой происходит прогрессирующее и нередко безболезненное разрушение суставов. Отсутствие боли связано с иннервацией сочленения – повреждением нервных окончаний из-за заболевания. В основном поражаются стопы, плюсневые и предплюсневые кости (90%), но патологический процесс может охватить любые суставы (коленный, тазобедренный), хотя и гораздо реже. В 20% случаев наблюдается двустороннее поражение. Вероятность развития диабетической остеоартропатии повышается, если человек болен диабетом более 8 лет и лечение не осуществлялось либо проводилось неэффективно.
Поражение костной системы наблюдается у 58% больных диабетом 1 типа, у 24% с диабетом 2-го типа. Рентген показывает нарушения только после того, как 20-40% костной ткани уже утрачено. КТ более информативна, поскольку позволяет выявить содержание минеральных веществ как в трубчатой, так и в компактной костной ткани. Своевременное распознавание первых признаков позволит эффективно остановить разрушение и избежать инвалидизации, которой часто заканчивается поражение суставов на фоне диабета.
Механизм поражения суставов
Причинами поражения суставов при диабете называют нарушение иннервации и аномально ускоренный кровоток в костной ткани, приводящий к остеопении локального масштаба. Также провоцирующую роль играют рецидивирующие травмы: даже самые незначительные способны запустить процесс остеолиза, разрушающий сустав. Протеингликановый состав костной, а также хрящевой ткани изменяется при дефиците инсулина. Основным механизмом, формирующим патологические нарушения в костях и сосудах, является гликирование белков.
На первой стадии наблюдается отек, умеренная гиперемия. Боль и лихорадка отсутствуют. Рентгенологическое исследование не выявляет деструктивных изменений. Наблюдается остеопороз.
На второй стадии рентген выявляет нарушения в виде:
Нарушение чувствительности провоцирует растяжение связочного аппарата, от чего сустав расшатывается. На третьей стадии начинается выраженная деформация, вывихи, возможны спонтанные переломы костей. Сустав буквально распадается на части, остается только заменить его на искусственный. Другими способами подвижность не восстановить.
Лечение
Основой терапии при сахарном диабете является постоянный контроль над уровнем сахара. Для этого существуют специальные приборы, позволяющие быстро определить его уровень. Только при условии нормализации сахара можно рассчитывать на результат при лечении суставов, если степень их разрушения еще позволяет проводить консервативную терапию.
Больному необходимо регулярно заниматься гимнастикой, проводить сеансы массажа и самомассажа, а также использовать аппаратную физиотерапию для восстановления чувствительности.
Хондропротекторы при выраженных дегенеративных процессах в суставе не помогут, поэтому их использование в большинстве случаев бессмысленно. Для снятия боли назначаются противовоспалительные и обезболивающие средства, с их помощью спадает отечность и немного улучшается подвижность. Применяются кортикостероидные препараты путем инъекционного введения непосредственно в сустав.
Хирургическое лечение
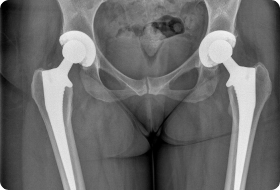
Хирургическое вмешательство при сахарном диабете возможно только при нормализации уровня сахара. Если диабет скомпенсирован и противопоказаний со стороны сердечно-сосудистой системы и внутренних органов не выявлено, то можно проводить замену сустава. Заключение дает эндокринолог по результатам обследования. При нормализации уровня сахара все процессы заживления у больных диабетом происходят также, как и у здоровых людей, но контроль очень важен не только перед операцией, но и сразу же после нее.
Есть риск отторжения, если у пациента преклонный возраст, заболевание продолжается более 10 лет. Однако современные технологии позволяют свести его к минимуму. Эндопротезирование производится при помощи фиксации на цемент, в котором содержится антибиотик (например, цифуроксим). Частота осложнений при введении данного метода существенно сократилась.
Существенно осложняет процедуру эндопротезирования лишний вес, который часто превышает все нормы при сахарном диабете. Это может стать противопоказанием к операции, поскольку не только затрудняется доступ к суставу, УЗИ-навигация и последующее закрытие тканей, но и ухудшается приживаемость из-за высокой нагрузки. Часты случаи развития ранних инфекций и смещения эндопротеза, велика вероятность, что произойдет перипротезный перелом, повредятся связки сустава, может развиться тромбоз конечности, тромбоэмболия, асептическая нестабильность, вывих головки имплантата.
Успех операции по замене сустава тучному человеку с диагнозом «сахарный диабет» во многом зависит от опыта врача, наличия необходимого оборудования для точной установки эндопротеза, правильного подбора имплантата. Важно проведение грамотной предоперационной профилактики тромбообразования и инфицирования.
В России есть клиники, в которых возможно обеспечить все необходимые условия для максимально успешного эндопротезирования таких больных, но попасть туда зачастую сложно. Единственной возможностью заменить сустав с минимальным риском осложнений является поездка в Германию или Израиль. Но многих останавливает высокая стоимость. Компания «Артусмед» предлагает организовать лечение опорно-двигательного аппарата для пациентов из РФ в специализированных клиниках Чехии, где цены существенно ниже, а качество на высоком европейском уровне.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 36 лет.
Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [1]
Главная причина ДС — это Сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «Сахарный диабет» должен помнить о таком грозном возможном осложнении.
СДС развивается в разной степени и разных формах:
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-«мозолью» в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую патологическую последовательность:
Таки образом, при СДС происходит повреждение всех тканей нижней конечности.
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Диабетическая остеоартропатия
Что такое стопа Шарко? В чем трудность диагностики диабетической остеоартропатии? Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) — редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимо
Что такое стопа Шарко?
В чем трудность диагностики диабетической остеоартропатии?
Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) — редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимой инвалидизации. Это осложнение можно назвать одной из самых загадочных форм синдрома диабетической стопы, так как предсказать развитие ОАП и выделить группы риска среди пациентов с сахарным диабетом крайне трудно. С этим осложнением диабета встречаются врачи разных специальностей — хирурги, эндокринологи, ортопеды, но далеко не всегда оно вовремя распознается.
Современное определение диабетической остеоартропатии — «деструкция кости и сустава неинфекционного характера, вызванная диабетической нейропатией» [1].
Деструктивная остеоартропатия была описана в ХIХ веке французским неврологом Шарко [2], но не при сахарном диабете (в доинсулиновую эру поздние осложнения диабета практически не встречались), а при сифилитическом поражении проводящих путей спинного мозга (tаbеs dоrsаlis). Впоследствии было установлено, что подобные изменения суставов стоп также встречаются при различных заболеваниях, приводящих к нарушению иннервации нижних конечностей (сирингомиелии, диабетической полинейропатии и др.). В настоящее время наиболее частой формой остеоартропатии является диабетическая.
Распространенность данного осложнения среди больных сахарным диабетом составляет менее 1% [3], хотя в литературе встречаются данные о поражении костной ткани стоп у 0,1-55% больных [4]. Такая противоречивость сведений, очевидно, связана с различиями в методике обследования и разными критериями диагностики остеоартропатии.
Локализация поражений
В подавляющем большинстве случаев ОАП поражает кости и суставы стоп. В 1991 году была предложена классификация ОАП [3] в зависимости от локализации процесса (рис. 1). У 20-25% пациентов ОАП поражает обе стопы, но обычно не одновременно. Встречаются случаи ОАП с поражением других суставов: коленного и даже локтевого.
 |
| Рисунок 1. |
Этиология, патогенез и естественное течение ОАП
Остеоартропатия — это по сути поражение костной ткани в отличие от типичных форм остеопороза, имеющих исключительно локальный характер. Причиной такого поражения кости является нарушение иннервации нижних конечностей вследствие диабетической нейропатии.
Длительное время развитие ОАП рассматривалось в основном с позиций нейротравматической и нейроваскулярной [5]. Согласно первой, моторная и сенсорная (посредством утраты проприоцептивных рефлексов) формы нейропатии приводят к нарушениям биомеханики стопы. Результатом этого является аномальная нагрузка на отдельные суставы стопы при ходьбе, приводящая через некоторое время к их деструкции. Альтернативная теория основана на обнаружении при ОАП признаков артериовенозного шунтирования крови через сосудистое русло костной ткани, в связи с чем было сделано заключение о ведущей роли аномального усиления кровотока в костной ткани в развитии локальной остеопении [6]. В 1989 году ученые выдвинули предположение о том, что в развитии ОАП определенную роль играют как рецидивирующая травма стоп, так и усиление кровотока в костной ткани. Таким образом оба этих патологических процесса нашли отражение в «синтетической» теории [7].
Известно, что ОАП не развивается у пациентов с нарушениями кровоснабжения нижних конечностей. Это объясняется тем, что при ишемической и нейроишемической формах синдрома диабетической стопы невозможно аномальное усиление кровотока в костной ткани.
Несмотря на то что факт развития ОАП лишь при тяжелой диабетической нейропатии хорошо известен, предсказать развитие ОАП практически невозможно, так как это осложнение возникает далеко не у всех больных даже с выраженной нейропатией. В связи с этим было высказано предположение, что ОАП вызывает не любая форма, а лишь определенные «подвиды» нейропатии. В 1992 году британские исследователи выдвинули гипотезу (впоследствии подтвержденную в ряде работ), что к ОАП приводит особая форма диабетической нейропатии с преимущественным поражением миелиновых нервных волокон и относительной сохранностью безмиелиновых, что вызывает нарушение тонуса микрососудов, которое влечет за собой усиление кровотока в костной ткани [8].
Эти патологические процессы служат предпосылкой, своего рода фоном для манифестации ОАП — остеопороза дистальных отделов нижних конечностей, снижающего устойчивость кости к повреждающим воздействиям. В этой ситуации провоцирующий фактор (минимальная травма при ходьбе или хирургическое вмешательство на стопе) приводит к повреждению кости или усилению в ней кровотока, активации остеокластов и «запускает» бурный и безостановочный процесс остеолиза, в отсутствие лечения приводящий к разрушению скелета стопы.
После манифестации ОАП процесс проходит четыре стадии [4].
 |
| Рисунок 2. |
Первая (острая) стадия характеризуется отеком стопы, умеренной гиперемией и местной гипертермией (рис. 2). Боли и лихорадка нехарактерны. Рентгенография может не выявлять деструктивных изменений (на этой стадии они представлены лишь микропереломами); обнаруживается остеопороз костей стоп.
 |
| Рисунок 3. |
Вторая (подострая): фрагментация костей и начало деформации стопы. В типичных случаях происходит уплощение свода стопы на пораженной стороне (рис. 3). Отек и воспалительные явления в этой стадии уменьшаются. Рентгенологически определяются фрагментации костных структур.
 |
| Рисунок 4. |
 |
| Рисунок 5а. |
Третья (хроническая): выраженная деформация стопы, наличие спонтанных переломов и вывихов. Вид деформации зависит от локализации поражения. В типичных случаях нагрузки на стопу при ходьбе приводят к деформации по типу «пресс-папье» или «стопы-качалки» (рис. 4). Это сопровождается вальгусной деформацией внутреннего края стопы в области предплюсны, клювовидной деформацией пальцев. Рентгенологически — фрагментация костей, выраженная деформация скелета, периостальное и параоссальное обызвествление (рис. 6). Функция скелета стопы полностью нарушается, в тяжелых случаях стопу можно образно сравнить с «мешком с костями».
 |
| Рисунок 5б. |
Четвертая (стадия осложнений): перегрузка отдельных участков деформированной стопы приводит к образованию язвенных дефектов (рис. 5); при их инфицировании возможно развитие флегмоны стопы, остеомиелита, гангрены.
Диагностика
Из-за сложности лечения ОАП, а также в связи с тем, что в популяции это состояние встречается достаточно редко, пациентов с подозрением на ОАП для диагностики и лечения следует направлять в специализированные отделения (центры) «Диабетическая стопа».
 |
| Рисунок 6. |
ОАП диагностируется на основании клинической картины, анамнеза (небольшая травма, хирургическое вмешательство) и рентгенологических признаков, соответствующих той или иной стадии. Очень часто из-за недостаточной информированности врачей общей практики об ОАП это осложнение ошибочно диагностируется как лимфостаз, тромбофлебит, флегмона стопы и др.
Наиболее затруднен дифференциальный диагноз в острой стадии, когда несвоевременное начало адекватного лечения приводит к необратимой инвалидизации.
 |
| Рисунок 7. |
Дифференциальная диагностика ОАП в острой фазе включает два основных вопроса:
Для решения первого вопроса необходимы данные рентгенографии стоп (хотя в острой фазе могут присутствовать лишь неспецифические изменения в виде остеопороза). Магнитно-резонансная томография и сцинтиграфия скелета стопы выявляют микропереломы, воспалительные изменения, усиление кровотока в пораженных костях.
Возможна оценка биохимических маркеров распада костной ткани (гидроксипролина, дезоксипиридинолина, фрагментов коллагена и др.). С аналогичной целью могут использоваться и маркеры перестройки костной ткани, отражающие активность остеобластов (то есть остеосинтеза), — костный изофермент щелочной фосфатазы и др. Но уровень этих веществ во многом зависит от активности процессов распада костной ткани в скелете в целом.
Очевидно, что изменения, характерные для других заболеваний: признаки острого тромбофлебита при УЗДГ венозной системы, типичная клиника подагрического артрита (с болевым синдромом и лихорадкой, соответствующей рентгенологической и биохимической картиной) и прочие — делают диагноз ОАП менее вероятным.
Для остальных случаев наиболее приемлемым на сегодняшний день алгоритмом диагностики ОАП в острой фазе можно считать следующий [9]:
При возникновении у больного сахарным диабетом одностороннего отека стопы (особенно при неповрежденной коже) следует обязательно исключить возможность ОАП. При подозрении на ОАП и при повышенном риске ее развития (длительное течение сахарного диабета, выраженная диабетическая нейропатия) целесообразнее назначить лечение сразу, чем через несколько месяцев наблюдать необратимую деформацию стопы.
Второй вопрос чаще возникает при наличии трофической язвы стопы или в послеоперационном периоде после ампутации в пределах стопы или другого оперативного вмешательства. Это связано с тем, что остеомиелит при синдроме диабетической стопы чаще всего вторичный, являющийся осложнением трофической язвы или раневого процесса. В решении этого вопроса помогают данные анализа крови: нейтрофильный лейкоцитоз характерен (хотя и необязателен) для остеомиелита, но не для ОАП. Об остеомиелите свидетельствуют также некоторые рентгенологические признаки (реакция надкостницы), а также наличие свища, зондирование костных структур в дне раны. Эффективный, но малодоступный метод исследования — сцинтиграфия скелета с введением лейкоцитов с радиоактивной меткой. «Золотым стандартом» в определении природы деструкции костной ткани является биопсия кости.
Лечение ОАП
В острой фазе цель лечения — остановка процессов остеолиза, предотвращение патологических переломов или их консолидация.
Наиболее частая ошибка — назначение вазоактивных препаратов. Эти средства показаны далеко не при всех формах синдрома диабетической стопы (только при ишемической и нейроишемической), а при ОАП способны усилить и без того избыточный кровоток в костной ткани.
Основой лечения ОАП в острой стадии является полная разгрузка конечности до исчезновения признаков воспаления (отека, локальной гипертермии). Адекватная разгрузка обеспечивает консолидацию костных отломков и более важна, чем медикаментозное лечение [3]. Если разгрузка не проводится, наиболее вероятны смещение костных отломков и развитие прогрессирующей деформации стопы, представленной на рис. 2-5. В первые дни и недели заболевания показан строгий постельный режим. В дальнейшем возможна ходьба, но только в специально изготовленном ортезе, переносящем значительную часть нагрузки со стопы на голень. Временная разгрузка в период изготовления ортеза может выполняться с помощью тутора, который отличается от ортеза стандартной формой (продается в готовом виде) и менее плотной фиксацией конечности.
После разрешения отека (обычно через 4 месяца) от ношения ортеза постепенно отказываются, а пациенту разрешают ходить в индивидуально изготовленной ортопедической обуви (рис. 7).
Стандартным методом разгрузки конечности при ОАП в большинстве зарубежных стран, особенно англоязычных (США, Великобритания, Австралия и др.), является применение фиксирующих повязок из полимерных материалов, по свойствам аналогичных гипсу (Тоtаl Соntасt Саst). Но даже при наличии высококвалифицированного персонала, проводящего эту процедуру, метод чреват развитием повреждений кожи (пролежней) под иммобилизирующей повязкой в 10% случаев.
В острой фазе ОАП применяются лекарственные препараты, влияющие на метаболизм костной ткани.
Тормозят процесс резорбции костной ткани бифосфонаты и кальцитонин.
Отечественный бифосфонат первого поколения ксидифон (этидронат) отличается доступной ценой. Назначается по 15-25 мл готового раствора натощак прерывистыми курсами (например, первые 10 дней каждого месяца), так как постоянный его прием создает риск остеомаляции. Современные бифосфонаты — фосамакс (алендронат) и другие — применяются в постоянном режиме и более эффективны. Доза фосамакса — 10,0 мг (одна таблетка) натощак ежедневно. Имеются сообщения о внутривенном применении бифосфонатов [бонефос (клодронат)] при ОАП.
Кальцитонин (миакальцик) применяется подкожно или внутримышечно по 100 МЕ один раз в день (обычно 1-2 недели), далее — в виде назального аэрозоля по 200 МЕ ежедневно.
Образование костной ткани стимулируют активные метаболиты витамина Д3 (альфа Д3-Тева и др.) и анаболические стероиды.
Альфа Д3-Тева применяется по 0,5-1 мкг/сут (2-4 капсулы) после еды. Альфа Д3-Тева способствует улучшению абсорбции кальция в кишечнике и активации процессов костного ремоделирования, обладает способностью подавлять повышенный уровень паратиреоидного гормона, усиливать нервно-мышечную проводимость, уменьшая проявления миопатии. Длительная терапия Альфа Д3-Тева способствует уменьшению болевого синдрома, повышению мышечной силы, координации движений, снижению риска падений и переломов костей. Частота побочных реакций на фоне длительной терапии Альфа Д3-Тева остается низкой.
Анаболические стероиды (ретаболил, неробол) назначают в виде инъекций один раз в неделю в течение 3-4 недель.
Препараты кальция самостоятельного действия на метаболизм костной ткани не оказывают, поскольку включение кальция в состав костной ткани регулируется соответствующими гормонами. Эти препараты применяются как вспомогательные для обеспечения достаточного потребления кальция при лечении патологии костной ткани (которое должно составлять с учетом всех пищевых продуктов 1000-1500 мг/сут). Наибольшей биодоступностью обладают лактат и карбонат кальция. Они входят в состав препаратов кальций-Сандоз форте, витрум-кальциум и кальций-Д3-Никомед, которые можно назначать по одной таблетке в день (около 500 мг элементарного кальция). Последний из названных препаратов содержит также витамин Д3, но в профилактических дозах, поэтому это средство следует рассматривать в первую очередь как источник кальция. Препараты кальция принимают во второй половине дня, так как именно в это время происходит их максимальное усвоение. Глюконат кальция (таблетки по 100 мг) стоит недорого, но отличается низкой биодоступностью, из-за чего необходимая суточная доза препарата составляет 10 таблеток.
Кальцитонин и бифосфонаты способны вызывать гипокальциемию, витамин Д3 и препараты кальция — повышать уровень кальция в крови. Поэтому необходимо определение уровня ионизированного кальция до начала лечения и ежемесячно на его фоне (в современных лабораториях этот показатель определяется в капиллярной крови). Обычно применяется комбинация какого-либо из ингибиторов резорбции, витамина Д3 и препаратов кальция. В зависимости от уровня ионизированного кальция дозы тех или иных препаратов увеличиваются или уменьшаются. Продолжительность лечения составляет 4-6 месяцев.
Вспомогательные средства (НПВС, эластичное бинтование конечности, иногда диуретики) применяются в целях устранения отека.
Рентгенотерапия пораженных суставов позволяет достаточно быстро купировать воспалительные явления. Однако, по данным ряда плацебо-контролируемых исследований, факт улучшения прогноза течения ОАП после рентгеновского облучения не подтвердился. Поэтому рентгенотерапию следует применять только в сочетании с адекватной разгрузкой конечности.
Оптимальным результатом лечения, начатого в острой фазе, является предотвращение переломов или консолидация отломков. О результатах лечения позволяют судить изменения клинической картины и контрольная рентгенография через 4-6 месяцев от манифестации заболевания.
После стихания воспалительных явлений сохраняется повышенный риск ОАП (в этой же или других зонах). Помимо общих профилактических мер (см. ниже) целесообразно носить ортопедическую обувь, уменьшающую нагрузку на суставы стопы (в первую очередь, предплюсны) при ходьбе.
В том случае, если процесс находится на второй или третьей стадии, основной целью лечения становится предотвращение осложнений ОАП. При наличии деформаций стопы необходима сложная ортопедическая обувь с внутренним рельефом, повторяющим аномальную форму стопы. Ригидная подошва с так называемым перекатом — приподнятой передней частью — препятствует дальнейшему смещению костных отломков при ходьбе. Постоянное ношение качественной ортопедической обуви предотвращает развитие трофических язв в местах повышенного давления. Попытки ортопедической коррекции деформаций при ОАП (супинаторы и т. п.) бесперспективны и чреваты быстрым развитием язв.
Методы хирургического восстановления скелета стопы при ОАП
Предложен ряд методов оперативного вмешательства, направленных на коррекцию деформации стопы при ОАП (артродез, резекция костных структур, создающих повышенное давление на подошвенную поверхность и приводящих к образованию незаживающей язвы), но в России опыт их применения невелик. Несомненным условием использования этих методов является полное стихание воспалительного процесса и остеолиза (так как в противном случае оперативное вмешательство может способствовать появлению новых очагов деструкции). Вероятно, лечение препаратами, укрепляющими костную ткань, создает более благоприятные условия для проведения операции. Однако вопрос о показаниях к хирургическому лечению и его безопасности при ОАП по-прежнему остается спорным. Чаще всего показанием к такому лечению служит тяжелая деформация стопы, делающая невозможным изготовление адекватной ортопедической обуви. В любом случае после оперативного вмешательства необходимо обеспечить полную 3-месячную разгрузку пораженной конечности (постельный режим, далее — Total Contact Cast или его аналог) [3].
Профилактика ОАП
Вопрос о методах профилактики в группах риска окончательно не решен. Своевременное выявление остеопении в дистальных отделах конечностей позволило бы восстанавливать костную плотность с помощью соответствующих препаратов. Однако остеопороз скелета стоп при рентгенографии у больных диабетом встречается в десятки раз чаще, чем ОАП, в связи с чем группа пациентов, имеющих показания для профилактического лечения, становится неоправданно большой. Кроме того, недостаточно разработаны методы количественной оценки костной плотности (денситометрии) скелета стоп, без которых невозможно составить представление об изменениях плотности костной ткани на фоне лечения, а также выбрать наиболее эффективные препараты и т. п.
Следовательно, основой профилактики ОАП остается адекватное лечение сахарного диабета, подобранное с учетом современных рекомендаций: обучение больных методам самоконтроля, поддержание гликемии на уровне, близком к «недиабетическому», и своевременное назначение инсулина при СД 2-го типа.