Чем лечить хеликобактер пилори в желудке
Хеликобактер пилори: особенности, патогенность, что купить для лечения
Один из самых загадочных микробов, о существовании которого ничего не было известно до конца 20 века. Лишь в 1994 году была признан «вклад» бактерии Helicobacter pylori в различие воспалительных заболеваний желудка и тонкого кишечника. Тогда же протоколы лечения гастритов и язв были принципиально изменены.
Что такое Helicobacter pylori
Биологически микроб представляет бактерию из ада грамотрицательных, способных развиваться при мизерном содержании кислорода в окружающей среде. Обитает в складках полости желудка и 12-перстной кишки. Спиралевидная форма и органеллы движения — несколько пар жгутиков обеспечивают бактерии возможность быстро передвигаться и прочно цепляться к стенкам слизистых оболочек.
Уникальное свойство патогена — нечувствительность к желудочному соку, насыщенному агрессивной для микробов соляной кислотой. Данные, полученные при изучении микроба, позволяют считать его провокатором самых распространенных болезней:
гастритов, в том числе атрофических и с повышенной кислотностью;
Выяснено, что Хеликобактер способна действовать как канцероген, поддерживая механизм злокачественного перерождения клеток.
Пути заражения Хеликобактер пилори
Микроб проникает в ЖКТ орально-оральным и орально-фекальным каналами:
при использовании обсемененных предметов личной гигиены: зубных щеток, ложек, вилок;
с загрязненных рук;
Учитывая легкость, с которой распространяется и приживается внутри организма бактерия, можно предположить зараженность ей большую часть населения всего мира. Практически это — часть условно-патогенной микрофлоры, которая активируется и наносит вред здоровью при снижении защитных сил.
Как действует бактерия в желудке
Проникая внутрь желудка микроб свободно циркулирует в гелеобразной жидкости, покрывающей его стенки и укрывается в толще эпителия слизистой. Белки и полисахариды Хеликобактер продуцируют фермент уреазу, который производит защищающую от кислоты пленку и аммиак. В результате их активности естественная кислотность желудочной среды снижается, а протективный слизистый слой на поверхности стенок постепенно истончается и растворяется.
Чтобы выровнять кислотный баланс железы продуцируют больше гастрина, пепсина и соляной кислоты. Запускается разрушающий процесс:
агрессивные соединения повреждают желудочные стенки, они воспаляются, отекают;
формируется и прогрессирует гастрит;
в тяжелых случаях возникают глубокие эрозированные очаги и изъязвления.
Нездоровый образ жизни, избыток вредной пищи, жареных и острых продуктов ускоряют развитие болезней.
Изредка активность Helicobacter pylori приводит к кожным проявлениям: папулезной розоватой сыпи на щеках, подбородке. Это следствие иммунной реакции организма на чужеродный микроб.
Устойчивость Хеликобактер к воздействию желудочного сока повышает способность принимать шаровидную форму, пряча жгутики под покрытое защитной пленкой тело.
Симптомы Helicobacter pylori
Колонии бактерий могут ничем не выдавать своего присутствия в желудке всю жизнь. Но у части носителей они вызывают хронические заболевания, которые с трудом поддаются терапии. Явные признаки заражения неспецифичны, связаны с нарушением функций желудка:
неприятный привкус во рту;
режущие боли в эпигастрии;
вздутие живота после еды.
Применение прогрессирования симптомы нарастают. При запущенных формах язвенной болезни повышается риск перфорации стенок и развития внутренних кровотечений.
Диагностика
Заподозрить активность патогенов врач может при жалобах пациента на характерные боли в области желудка, тошноту, отрыжку и другие симптомы гастрита. Специфическая диагностика Helicobacter pylori проводится несколькими методами:
Определение титра антител к бактерии в лабораторных условиях: исследуются пробы крови и кала.
Дыхательные тесты: больному предлагают выпить раствор мочевины, который провоцирует патогены вырабатывать аммиачные соединения. Их фиксируют в выдыхаемом воздухе специальными газоанализаторами.
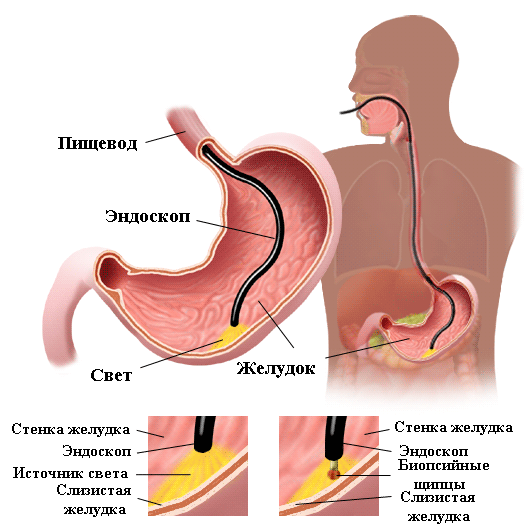
Гистологический анализ биоптата. Инвазивный и самый информативный метод, выявляет колонии бактерий в организме с точностью до 100%. Небольшие фрагменты слизистой из полости желудка забирают во время гастроскопии под местной анестезией. Обследование выявляет также присутствующие онкомаркеры.
Факт наличия в желудке Хеликобактер пилори не означает, что носитель обязательно заболеет гастритом или язвой. Она — лишь один из факторов пищеварительных патологий. Диагностика помогает подобрать адекватную этиотропную терапию при начавшемся воспалительном процессе, предотвратить обострение при развившемся хроническом заболевании.
Как лечат патологии, вызванные Helicobacter pylori
Применение антацидных препаратов, нейтрализующих соляную кислоту желудочного сока, при гастрите и язве считается устаревшим методом. Такие средства ненадолго устраняют изжогу, не влияя на причины болезни.
Современный подход к терапии — комплексное применение антибактериальных средств и ингибиторов протонной помпы.
Эффективно подавляют патогены медикаменты из группы цефалоспоринов, фторхинолоны, Азитромицин, Метронидазол, Левофлоксацин. Так как Хеликобактер быстро адаптируется к лекарствам, важно не прерывать лечение на полпути.
Для ускорения регенерации назначают трикалия дицитрат. В аптеках его можно купить под торговым названием Де-Нол. Препарат подавляет активность патогена и защищает слизистую от разрушения.
Ингибиторы протонной помпы влияют на синтез соляной кислоты до выделения ее в полость желудка. Применяют Омепразол, Контролок, Нольпазу, Рабепразол.
Для эффективного подавления бактерии требуется купить и принимать не менее двух медикаментов из разных фармацевтических групп. Какие именно, врач рекомендует по изучении лабораторных анализов и результатов гастроскопии. Благодаря адекватной терапии удается избегать рецидивирующих обострений заболеваний в течение многих лет.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Что предлагает медицина для борьбы с Helicobacter pylori
Хеликобактерная инфекция является одной из потенциальных причин развития гастрита и язвенной болезни желудка. Роль инфекционного фактора в развитии данных заболеваний была клинически доказана. Любая терапия воспалительного процесса в области желудка окажется неэффективной без использования средств, губительно воздействующих на данный микроорганизм. Консервативная медицина использует различные схемы эрадикации хеликобактер пилори, при этом каждая схема имеет свои особенности, преимущества и недостатки.
Что такое эрадикация
Эрадикация helicobacter pylori объединяет несколько стандартных лечебных режимов, направленных на подавление жизнедеятельности данного микроорганизма. После уничтожения хеликобактерной инфекции, в слизистой оболочке желудка создаются благоприятные условия для купирования воспалительного процесса и заживление эрозивно-язвенных очагов. Любая из схем эрадикации helicobacter pylori может быть использована в том случае, если оно соответствует таким критериям:
Говоря о том, что это такое эрадикация, нельзя не упомянуть, что этот процесс даже с возможностями современной медицины является продолжительным и не всегда обеспечивает нужный результат.
Разновидности схем
Для лечения хеликобактерной инфекции используются препараты 1 и 2 линии, при этом каждая схема может иметь трехкомпонентный или четырехкомпонентный состав.
Первая линия
Трехкомпонентная схема лечения при эрадикации хеликобактер пилори, включает прием таких медикаментов:
Эффективность трехкомпонентной схемы эрадикации может быть усилена за счёт увеличения её продолжительности до 10-14 дней.
Вторая линия
Выбор схемы эрадикационной терапии при хеликобактер пилори проводится индивидуально, на основании результатов медицинского обследования.
Несмотря на то, что традиционная медицина продолжает использовать стандартные методики эрадикации хеликобактерной инфекции, этот вариант лечения продолжает находиться под сомнением, так как антибактериальные средства не только частично уничтожают бактерию, но и провоцируют ряд побочных реакций.
Полноценной альтернативой стандартным схемам лечения хеликобактерной инфекции, является метапребиотик Стимбифид Плюс, который помогает ускорить процесс эрадикации бактериальной инфекции, восстановить структуру слизистой оболочки желудка и побороть воспалительный процесс. Биодобавка одинаково эффективна при гастрите как с повышенной, так и со сниженной кислотностью.
Стандартная эрадикационная терапия хеликобактерной инфекции основана на внешнем воздействии на бактерию. Клинически доказано, что этот метод лечения является тупиковым и не гарантирует полное уничтожение микроорганизма. Принципиально новым способом является так называемое эндогенное воздействие на хеликобактер пилори посредством увеличения популяции собственной микробиоты желудка. Инновационный путь эрадикации был успешно испытан на людях-добровольцах. Метапребиотик Стимбифид Плюс помогает избавиться от хеликобактерной инфекции посредством таких механизмов:
Биодобавка одинаково эффективна как при остром, так и при хроническом течении воспалительного процесса в области желудка. Продолжительность терапии метапребиотиком Стимбифид Плюс составляет от 12 до 28 дней. В ходе клинических испытаний, спустя 30 дней после начала приёма метапребиотика, был проведён контрольный анализ на определение хеликобактерной инфекции. В 100% случаев отмечалась полная эрадикация бактерии.
Метапребиотик используется в качестве монотерапии, при этом отсутствует необходимость в дополнительном приёме препаратов из стандартных схем эрадикации. Важно помнить, что хеликобактерная инфекция является одним из потенциальных факторов развития не только гастрита и язвенной болезни желудка, но и онкологии данного органа.
Своевременная эрадикация бактериальной инфекции помогает снизить риск до минимума. При использовании стандартных методик, эрадикация хеликобактер пилори + схема лечения должна регулярно согласовываться с лечащим врачом. Используя метапребиотик Стимбифид Плюс, человек может самостоятельно проводить терапию в домашних условиях, принимая только одно средство.
К основным преимуществам использования метапребиотика Стимбифид Плюс при гастрите, ассоциированном с хеликобактер пилори можно отнести:
Бактерия хеликобактер пилори
7 февраля 2018
Многие желают узнать, как передается и лечится хеликобактер пилори – опасная бактерия, живущая в желудке, виновница хронического гастрита, эрозий, язв и даже рака желудка.
Что это за бактерия?
Как же воздействует хеликобактер на желудок? Уничтожает париетальные (пристеночные) клетки слизистой (внутренней) оболочки желудка, выбрасывая ядовитые продукты – токсины. Защитные клетки крови – нейтрофилы, лимфоциты и другие, преследуют вредителя, пытаясь уничтожить и его, и измененные париетальные клетки – возникает воспаление. Количество защитной слизи на участке пребывания бактерии заметно снижается, на измененный участок стремительно воздействует соляная кислота, усугубляя неизменное воспаление слизистой. Это проявляется болью в желудке «под ложечкой», изжогой, отрыжкой, налетом на языке, неприятным запахом изо рта, постоянной тошнотой, то есть симптомами хронического гастрита. Хроническое длительное воспаление слизистой оболочки желудка приводит к изменению ее клеток, вплоть до развития рака желудка.
Так что же теперь и в кафе со своей посудой ходить? К счастью, хеликобактер не устойчивая бактерия и обработки посуды в посудомоечной машине достаточно, чтобы ее уничтожить. Хорошие рестораны и кафе конечно оборудованы такими машинами, и посещать их можно без риска заражения.
Как узнать, есть ли у меня инфекция хеликобактер пилори?
У меня выявлен хеликобактер пилори – что делать?
При выявлении положительного анализа на хеликобактер пилори нужно обратиться за консультацией к гастроэнтерологу или терапевту. В лечении инфекции используются антибиотики, и назначает их только врач.
Можно ли вылечить хеликобактер приемом препарата де-нол, как показывают в рекламе, или народными средствами? Полностью избавиться от инфекции хеликобактер пилори можно только определенными антибиотиками.
Нужно ли мне травить себя антибиотиками, если меня ничего не беспокоит, а результат анализа на хеликобактер положительный? Инфекция может и не беспокоить, в 70% случаев так и происходит, гастрит годами протекает «молча», но через несколько лет вследствие вялотекущего воспаления возникает атрофия слизистой оболочки и нельзя исключить ее переход в рак желудка. В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
Инфекция хеликобактер пилори очень распространена среди населения, есть ли смысл в лечении, если потом можно повторно заразиться? Да, повторное инфицирование возможно, но происходит не часто – примерно 6 человек из 100 пролеченных приобретают инфекцию вновь при несоблюдении правил профилактики. Они очень просты – мыть руки перед едой, не пробовать чужую еду, не есть в сомнительных забегаловках, где нет уверенности в правильной обработке посуды, не целовать не очень близких людей. Важно также при выявлении инфекции хеликобактер пилори проверить на нее всех членов семьи, начиная с подросткового возраста, и в идеале – пролечиться одновременно всем инфицированным. Детей, если ничего не беспокоит, лечат с подросткового возраста – с 12-13 лет. Если ребенок жалуется на боли в животе или тошноту, то обследование и лечение проводят по показаниям в более раннем возрасте.
Люди очень часто жалуются на обострение гастрита. А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
Лечение заболеваний, ассоциированных с инфекцией Helicobacter pylori
Необходимость установления единого подхода к диагностике и терапии инфекции Helicobacter pylori (HP-инфекции), основанного на опыте лучших европейских исследователей, привела к созыву в г. Маастрихт (Нидерланды) в феврале 1996 г. конференции, организованн
Необходимость установления единого подхода к диагностике и терапии инфекции Helicobacter pylori (HP-инфекции), основанного на опыте лучших европейских исследователей, привела к созыву в г. Маастрихт (Нидерланды) в феврале 1996 г. конференции, организованной Европейской группой по изучению H. pylori. На конференции был обсужден и принят документ под названием «Current European Concepts in the Management of Helicobacter pylori Infection — The Maastricht Consensus Report» (Маастрихт-1). В этом первом соглашении были установлены основные показания к эрадикации и рекомендованы оптимальные схемы лечения. Второй Консенсус (Маастрихт-2) был принят в 2000 г., показания были подразделены на обязательные и целесообразные (табл. 1А и табл.1Б).
В 2005 г. во Флоренции был принят последний, третий Консенсус (Маастрихт-3) по ведению HP-инфекции. Целью его была выработка глобального подхода и анализ ключевых вопросов, в частности, показаний к эрадикации, стратегии и тактики ведения пациентов. Учитывая высокий уровень доказательности необходимости эрадикации Н. pylori в первой группе показаний (обязательных), принятых Консенсусом Маастрихт-2, они не подвергались повторному пересмотру. При выработке последнего Консенсуса Маастрихт-3 участники вернулись к обсуждению и принятию только тех показаний, которые значились как целесообразные (ГЭРБ, функциональная диспепсия, прием НПВС). На основании анализа последних научных данных была признана необходимость проведения эрадикации Н. pilory при функциональной диспепсии, поскольку морфологически при наличии НР-инфекции практически в 100% обнаруживается хронический гастрит, который является прогрессирующим заболеванием с определенным риском последующего язвообразования и малигнизации.
Проведенные рандомизированные исследования показали, что после эрадикации Н. pylori улучшение состояния больных наблюдается в 50%, а полное исчезновение симптомов — у 30%. В то же время при персистировании инфекции улучшение отмечается лишь у 38%, а исчезновение — у 18% [1]. Показания к эрадикации Н. pylori при ГЭРБ были обоснованы тем, что НР-инфекция сопровождается гиперхлоргидрией у большинства пациентов, а после эрадикации секреторная функция нормализуется. Эрадикация Н. pylori не повышает риск развития ГЭРБ в сравнении с терапией ингибиторами протонной помпы (ИПП). Напротив, монотерапия ИПП, снижая желудочную секрецию, способствует распространению Н. pylori и заселению им тела желудка, что сопровождается развитием фундального гастрита с более высоким риском атрофии. Целесообразность эрадикации Н. pylori при необходимости приема НПВС была аргументирована повышением риска язвообразования при сочетании двух ульцерогенных факторов (Н. pylori и НПВС). Так, по данным C. O’Morein [2], эрозивно-язвенное поражение гастродуоденальной зоны при наличии этих двух факторов выявляются у 55% больных, при отмене НПВС уменьшаются в два раза, а при эрадикации Н. pylori — в пять раз. Таким образом, повторный пересмотр целесообразных рекомендаций подтвердил необходимость проведения эрадикации Н. pylori при функциональной диспепсии, ГЭРБ и приеме НПВС.
Консенсус Маастрихт-3 впервые включил показания к эрадикации Н. pylori при двух внежелудочных состояниях: железодефицитной анемии (ЖДА) и идиопатической тромбоцитопенической пурпуре (ИТП). Роль Н. pylori в развитии ЖДА была доказана на основании выявления дефицита железа вследствие потребления его микроорганизмом, а также восстановлением показателей после эрадикации Н. pylori. Целесообразность эрадикационной терапии при ИТП была доказана снижением уровня антитромбоцитарных антител у больных после эрадикации Н. pylori.
Таким образом, в соответствии с рекомендациями Консенсуса Маастрихт-3, показаниями к эрадикации Н. pylori являются:
Педиатрические аспекты инфекции Н. pylori впервые обсуждались в 1997 г. в г. Эшторил (Португалия) по инициативе Европейской группы по изучению Н. pylori, затем обсуждение было продолжено на состоявшихся в Будапеште второй (1998 г.) и в Хельсинки третьей (1999 г.) встречах педиатров-экспертов [3, 4]. Итогом работы явилось формирование рабочего алгоритма обследования и лечения детей, включающего следующие этапы:
Принятые в Риме в 1999 г. рекомендации ESPGHAN по ведению инфекции Н. pylori предусматривают простой алгоритм показаний к эрадикации:
Педиатрические аспекты инфекции Н. pylori обсуждались и при принятии Консенсуса Маастрихт-3, в частности, были подчеркнуты следующие положения:
Важные требования к эрадикационной терапии HР-инфекции были опубликованы в «Рекомендациях по диагностике и лечению инфекции Н. pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» Российской гастроэнтерологической ассоциации и Российской группы по изучению Н. pylori [5]:
В отличие от других микроорганизмов Н. pylori in vitro чувствителен к большинству антимикробных препаратов. Еще в 1988 г. в исследованиях McNulty C. A. M. и Dent J. C. [6] показали его чувствительность к 21 антибактериальному агенту.
Н. pylori чувствителен к подавляющему большинству антибиотиков пенициллинового ряда и большинству цефалоспоринов (цефуроксиму, цефокситину, цефалексину), причем их минимальная подавляющая концентрация для 90% бактерий (МПК-90) не превышает 0,5 мг/л. Макролиды и фторхинолоны in vitro также проявляют достаточно высокую активность в отношении Н. pylori, их МПК-90 ниже 0,5 мг/л. Весьма эффективны и антибиотики других групп (нитрофураны, гентамицин, тетрациклин, рифампицин). Метронидазол обладает активностью средней степени. Н. pylori устойчив к ванкомицину, цефсулодину, триметоприму и сульфаниламидам, поэтому эти антибактериальные средства используют при его культивировании для подавления конкурентной флоры. Среди противоязвенных средств ни одно не обладает существенной активностью против H. pylori in vitro, кроме солей висмута: трикалия дицитрата (Де-нола), субсалицилата, субгаллата.
Несмотря на активность in vitro, при назначении in vivo вышеперечисленные антибактериальные препараты отнюдь не отличаются столь же высокой эффективностью. Одной из причин этого является снижение их активности в кислой среде желудка. Исследования, проведенные МсNulty C. A. M. [7], показали, что активность пенициллина и ампициллина в условиях кислой среды снижается более чем в 10 раз, цефалексина — в 16 раз, ципрофлоксацина — в 10 раз, а эритромицина — более чем в 100 раз. Макролиды последнего поколения (кларитромицин, Вильпрафен® Солютаб), в отличие от эритромицина, гораздо более устойчивы в кислой среде [8]. Незначительное изменение активности наблюдается у тетрациклина и фуразолидона. Активность же метронидазола и Де-нола не изменяется при кислых значениях рН [9], поэтому они успешно применяются в лечении НР-инфекции.
Другой причиной снижения эффективности антибактериальных препаратов in vivo является неспособность некоторых их них накапливаться в слизи, покрывающей желудочный эпителий. Неионизированные молекулы эритромицина и ципрофлоксацина из слизистой оболочки быстро диффундируют в просвет желудка. При меньших значениях рН возможен их переход в ионизированную форму и задержка в слизистом слое, но снижение рН само по себе приводит к их почти полному разрушению. Поэтому эритромицин практически не эффективен при лечении НР-инфекции. В отличие от эритромицина, кларитромицин и рокситромицин отличаются хорошим проникновением в ткани и слизистый слой [10]. Ципрофлоксацин и другие фторхинолоны не применяются в терапии Н. pylori еще и потому, что при их назначении очень быстро формируются резистентные штаммы ко всей группе хиноловых препаратов [11].
Амоксициллин (Флемоксин Солютаб®) — один из наиболее эффективных антибиотиков, применяемых при лечении Н. pylori-ассоциированных заболеваний. Препарат относится к группе бета-лактамных антибиотиков, подгруппе аминопенициллинов. При низких значениях рН амоксициллин сохраняет высокую активность. Максимальную активность проявляет при нейтральных значениях рН [12]. Является амфотерным соединением и при рН 3–6 проникает в ткани несколько хуже, тогда как в слизь, которая на 90% состоит из воды, способен проникать в большей степени [13], что позволяет добиться высокой его концентрации в слизистой желудка (вплоть до собственной пластинки слизистой оболочки) и в желудочном содержимом.
Солютаб — это особая технология производства препарата, при которой каждая таблетка состоит из отдельных микросфер, заключенных в наполнитель. Под воздействием любой жидкости таблетка начинает распадаться на микросферы, которая становится проницаемой только при воздействии бикарбонатов в кишечнике. Таким образом, действующее вещество высвобождается в зоне максимального всасывания. Это в свою очередь обеспечивает более равномерное и максимально полное всасывание активных компонентов препаратов, произведенных по указанной технологии, по сравнению с аналогами. Форма Солютаб также обеспечивает минимальную остаточную концентрацию действующего вещества в кишечнике, что гарантирует как предсказуемую эффективность, так и благоприятный профиль безопасности вследствие минимального влияния препарата на микрофлору кишечника и минимального раздражающего действия.
Таблетки Солютаб можно как проглотить целиком, так и растворить в воде с образованием сиропа или суспензии с приятным вкусом, который с удовольствием пьют как дети, так и взрослые.
Механизм воздействия амоксициллина на Н. pylori заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллин-связывающих белков (ПСБ) — ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма — пептидогликана [14]. Это приводит к нарушению синтеза клеточных оболочек и лишает микробную клетку способности противостоять осмотическому градиенту, в результате чего стенки набухают и разрушаются. Таким образом, амоксициллин оказывает бактерицидное действие, тогда как подавляющее большинство других бета-лактамов являются бактериостатиками. Данное обстоятельство объясняет нецелесообразность применения для лечения Н. pylori других антибиотиков данной группы (в том числе и родственного ампициллина).
Побочными эффектами, характерными для амоксициллина, являются: диарея, аллергическая реакция и псевдомембранозный колит. При проведении антихеликобактерной терапии детям рекомендуется суточная доза 60 мг/кг в сутки дважды в день во время или после еды. При приеме амоксициллина до еды его местное антибактериальное действие усиливается.
Н. pylori весьма чувствителен к тетрациклину, который ингибирует бактериальный синтез белка и подобно амоксициллину проявляет интралюминальную активность, причем даже при низких значениях рН [15]. В литературе нет сообщений о резистентности Н. pylori к тетрациклину, но этот препарат дает довольно большое количество побочных реакций: гепатотоксическое действие, тошноту, а также стойкое повреждение растущих зубов, вследствие чего не рекомендуется для использования в педиатрической практике.
Эффективность другой группы антибиотиков — макролидов в отношении Н. pylori была доказана во многих исследованиях [16]. Основу химической структуры макролидов составляет макроциклическое лактонное кольцо. Все они обладают противовоспалительным и иммуномодулирующим действием, накапливаясь в клетках организма (в том числе и в полиморфно-ядерных лейкоцитах) и влияя на миграцию нейтрофилов, окислительные реакции в фагоцитах и продукцию многих цитокинов. Механизм действия макролидов состоит в торможении синтеза белка в микробных клетках при их размножении путем связывания с каталитическим пептидилтрансферазным центром рибосомальной 50S-субъединицы. Это приводит к торможению реакции транслокации и транспептидации и нарушению процесса формирования и наращивания (элонгации) пептидной цепи. Обладают преимущественно бактериостатическим действием. Поскольку макролиды являются слабыми основаниями, их активность возрастает при рН 5,5–8,5.
Наиболее активным в отношении Н. pylori является кларитромицин. В отличие от других макролидов, которые в кислой среде подвергаются усиленному гидролизу, кларитромицин устойчив в кислоте желудочного сока. По данным Miki и соавторов (2003) [17], монотерапия кларитромицином приводит к уничтожению Н. pylori в 54% случаев, а согласно исследованиям Gisbert — в 15% случаев, что, тем не менее, является впечатляющим результатом.
Другие представители макролидов, в частности, джозамицин и рокситромицин мало уступают кларитромицину в клинической эффективности, но в меньшей степени вступают во взаимодействие с другими лекарственными препаратами, реже вызывают побочные эффекты и поэтому могут являться альтернативой кларитромицину [18].
Одним из основных препаратов, входящих в схемы антихеликобактерной терапии, является трикалия дицитрат висмута (ТДВ, Де-нол). При рН менее 5 ТДВ образует преципитаты в виде двух солей висмута — оксихлорида и цитрата, оптимум рН составляет 3,5 [19]. В области дна язвы препарат создает защитную пленку, образуя агрегаты с белками плазмы [20]. Он также способен образовывать кристаллы различной формы в зависимости от рН среды, которые, в частности, могут адгезироваться в местах некроза эпителиальных клеток [21].
ТДВ оказывает влияние на плотность и проницаемость слоя желудочной слизи, образуя комплекс висмут–протеогликан и замедляя диффузию Н+, но не влияя на диффузию других ионов [22]. ТДВ обладает также антипепсиновой активностью — вероятно, за счет связывания пепсина [23], а при кислых значениях рН способен связывать желчные кислоты [24]. ТДВ достоверно увеличивает секрецию простагландинов [25] и бикарбонатов [26] в желудке и двенадцатиперстной кишке.
Одним из основных свойств ТДВ является его бактерицидное действие на Н. pylori. Оно незначительно превосходит аналогичное действие других солей висмута in vitro, но многократно — in vivo. Это объясняется наибольшей растворимостью ТДВ в желудочном соке и слизи в самом широком диапазоне рН, что позволяет препарату легко проникать в слизистый слой и желудочные ямки. ТДВ препятствует адгезии Н. pylori к желудочному эпителию, приводит к повреждению и фрагментации мембраны бактериальной клетки, вакуолизации ее [27]. Он ингибирует ферменты Н. pylori: уреазу, каталазу, фосфолипазу и его протеолитическую активность [28]. В результате всего комплекса воздействий ТДВ наступает лизис бактериальной клетки в непосредственной близости от эпителия желудка. Очень важно, что препарат способен воздействовать как на вегетативные, так и на кокковые формы Н. pylori. Несмотря на различные механизмы действия, он обладает синергизмом с антибиотиками, поэтому может быть эффективно использован в сочетании с ними. К препарату не развивается резистентность. Более того, согласно данным Williamson R., Pipkin G. A. [29], ТДВ предотвращает развитие первичной и вторичной резистентности к антибиотикам.
Многочисленные исследования оценки эффективности терапии Де-нолом НР-инфекции показали, что после курса монотерапии у большинства больных удается добиться подавления инфекции и стойкого клинического улучшения [30], однако в дальнейшем восстанавливается прежняя степень обсемененности слизистой оболочки. То есть Де-нол в качестве монотерапии не в состоянии стойко подавить Н. pylori, поэтому используется комбинированная терапия. ТДВ, а также некоторые другие соли висмута: субсалицилат и, реже, субгаллат, в сочетании с антибиотиками широко используются в комплексной терапии НР-инфекции [31].
Хотя действие этих препаратов реализуется местно, все же незначительные концентрации висмута обнаруживаются в крови и моче в процессе лечения и достигают стабильных значений спустя четыре недели от его начала [32]. В экспериментах на животных было показано, что высокие дозы висмута могут вызвать побочные реакции со стороны ЦНС (т. н. «висмутовая энцефалопатия»). Пороговыми концентрациями висмута в крови у человека считаются 50–100 мг/л, однако в реальных условиях при назначении обычных доз Де-нола (8 мг/кг у детей, 480 мг/сут у взрослых) такие концентрации никогда не регистрируются и никаких побочных реакций со стороны ЦНС не возникает [33]. Исследование П. Л. Щербакова [34], проведенное у детей, показало, что на фоне стандартной антихеликобактерной терапии, включавшей обычные дозы Де-нола, концентрация висмута в крови у детей не превышала 55 мг/л, что соответствует нижней границе нормы пороговых значений и 10-кратно ниже концентраций, наблюдаемых при висмутовой энцефалопатии.
То есть Де-нол является безопасным и эффективным антихеликобактерным препаратом и может быть без опасений назначен детям. Однако, поскольку висмут медленно выводится из организма, его не рекомендуют назначать пациентам с почечной недостаточностью [35]. Кроме вышеописанных, из побочных действий препаратов висмута обычно наблюдается почернение стула вследствие образования в кишечнике сульфида висмута, в литературе имеется несколько сообщений о возникновении диареи, описаны редкие случаи аллергии на препарат в виде кожных сыпей [36]. В желудке препарат может связываться с пищей и антацидными препаратами, терапевтическое его действие в этом случае становится невозможным. Поэтому препарат рекомендуют принимать за 30 мин до еды и на ночь, не ранее чем через 2 часа после последнего приема пищи, и не сочетают с приемом антацидов. В детской практике рекомендуется назначать Де-нол детям старше 5 лет в дозе 8 мг/кг/с в 2 приема за 30 мин до еды.
В соответствии с рекомендациями ESPGHAN и NASPGHAN (2000 г.), оптимальными схемами для эрадикационной терапии хеликобактериоза являются следующие [37]:
В соответствии с рекомендациями ESPGHAN и NASPGHAN [77], оптимальными дозами препаратов, входящих в стандартные схемы, являются следующие: омепразол — 1 мг/кг до 20 мг 2 раза, амоксициллин 50 мг/кг до 1 г 2 раза, кларитромицин, джозамицин, рокситромицин 15 мг/кг до 500 мг 2 раза, метронидазол 20 мг/кг до 500 мг 2 раза, тетрациклин (с 12 лет) 50 мг/кг до 1 г 2 раза, трикалия дицитрат висмута (КСВ) 120 мг 3–4 раза.
В соответствии с этими рекомендациями и Консенсусом Маастрихт-2, в качестве 7-дневных схем эрадикации первой линии рекомендована схема, включающая ИПП, кларитромицин (джозамицин или другой представитель макролидов) и амоксициллин (ИКА), и в меньшей степени — схема, в которой вместо амоксициллина применяется метронидазол (ИКМ) [38]. Поскольку компоненты первой схемы были наиболее удачно сбалансированы по эффективности и минимальны по побочным действиям, она получила название «стандартной тройной терапии». Уровень эрадикации при использовании этой комбинации препаратов составил 78–91% [39]. По результатам G. M. Buzas, J. Jozan (2004) [40] эффективность схемы, включающей кларитромицин и амоксициллин, составила 79,6%, кларитромицин и нитроимидазол — 84,1%, амоксициллин с нитроимидазолом — 72,5%. В аналогичном исследовании, проведенном в Южной Корее и включавшем 352 пациента с дуоденальной язвой и неязвенной диспепсией, сравнивали комбинацию омепразола (20 мг 2 раза в сутки), кларитромицина (500 мг 2 раза в сутки) и амоксициллина (1,0 г 2 раза в сутки) или тинидазола (500 мг 2 раза в сутки), эффективность оказалась одинаковой (65,7% и 64,8%) [41]. К важному выводу о целесообразности включения в режим эрадикации кларитромицина пришли исследователи, которые сравнивали комбинацию лансопразола (30 г 2 раза в сутки), амоксициллина (1,0 г 2 раза в сутки) и метронидазола (400 мг 3 раза в сутки) с режимом, включавшим лансопразол и амоксициллин в той же дозе, но с заменой метронидазола на кларитромицин (500 мг 2 раза в сутки). Эффективность последнего варианта оказалась значительно более высокой (91% и 78%) [42].
В 1999–2002 гг. в Европе было проведено проспективное мультицентровое исследование, включавшее 16 педиатрических центров в 14 странах. Всего было обследовано 1233 пациента, 41% которых были родом из Африки и Ближнего Востока. Исследовалась как первичная (до лечения), так и вторичная (при неудачном лечении) резистентность. Первичная резистентность к кларитромицину была выявлена у 20% детей, вторичная — у 42%. Первичная резистентность к кларитромицину была достоверно выше у детей до 6 лет, чем у подростков старше 12 лет, и преобладала у жителей Южной Европы по сравнению с Северной. Эти различия легко объяснимы более частым назначением макролидов для лечения внежелудочных (в основном, респираторных) заболеваний у детей раннего возраста и существованием определенных ограничений в назначении препаратов этой группы в североевропейских странах. В Восточной Европе отдельные исследования также показали высокую резистентность к кларитромицину у детей. Так, в Болгарии она составила 12,4%, а в Польше — 23,5% [43].
Основной причиной роста резистентности Н. pylori к кларитромицину является не столько предшествующая неэффективная эрадикационная терапия, сколько широкое использование макролидов при лечении других заболеваний. Поскольку дети чаще получают препараты этой группы, то и распространенность устойчивых штаммов Н. pylori среди них существенно выше, чем у взрослых. Так, исследование, проведенное в японских семьях, показало, что хотя члены одной семьи обычно заражены идентичными штаммами Н. pylori, резистентность к кларитромицину выше у детей [44]. В целом резистентность Н. pylori к кларитромицину возрастает пропорционально его потреблению в данном регионе [45].
В странах Восточной Европы с невысоким уровнем жизни (в том числе и в странах СНГ) первично-резистентные к нитроимидазолу штаммы Н. pylori составляют 20–40%; в России в 1998 году резистентность к метронидазолу составила почти 30%, в Москве — 36% [46]. В странах Западной Европы, по данным Европейского многоцентрового исследования, средний уровень первичной резистентности Н. pylori к метронидазолу составляет 25,6% [47].
В 1997 г. впервые сообщалось о появлении резистентных к амоксициллину штаммов Н. pylori, составивших 1,4–7% в развитых странах [48]. Устойчивость Н. pylori к бета-лактамам определяется модификацией ПСБ микроорганизмов. Описаны модификации (результат мутаций) в ПСБ-1а и ПСБ-4; поскольку гены ПСБ локализованы в бактериальной хромосоме, устойчивость в популяции Н. pylori происходит, вероятно, по клональному типу. Если за период с 1985 по 1996 год в Японии не было выявлено ни одного резистентного штамма, то в 1997 г. их доля составила 1,1%, а в 2003 г. — 1,5% [49].
В 2005 году F. Megraud [50] представил данные о резистентности Н. pylori к антибактериальным препаратам, определившие последующий выбор тех или иных схем эрадикации. Так, показатели резистентности штаммов микроорганизма к метронидазолу находятся в пределах 19–42% в странах Европы и 33–37% — в США, 9–12% — в Японии, 53% — в Бразилии и 77% — в Мексике. В отношении кларитромицина эти показатели составляют в США и Японии около 13%. В европейских странах они колеблются в широких пределах: сравнительно низки в странах Северной (4,4%) и Центральной (8,7%) Европы и, напротив, очень высокие (24%) — в странах Южной Европы. В нашей стране к 2003 г. количество штаммов Н. pylori, резистентных к метронидазолу, достигло 55,5%. Опасной можно назвать тенденцию к росту доли полирезистентных штаммов — 11,1% [50].
Исследование эффективности схемы, рекомендованной в качестве стандартной Консенсусом Маастрихт-3 в Европе (эзомепразол + кларитромицин + метронидазол) в рекомендуемых дозах продолжительностью 10 дней, проведенное нами у 20 детей с Н. pylori-ассоциированными гастродуоденальными заболеваниями, показало низкую эффективность — 14,3%. Столь низкий результат объясняется высоким уровнем резистентности Н. pylori как к кларитромицину, так и к метронидазолу. В связи с полученными неутешительными результатами, мы не можем рекомендовать эту стандартную схему к использованию в России.
С учетом локальных особенностей штаммов Н. pylori, Консенсус Маастрихт-3 внес одну очень важную поправку: если устойчивость Н. pylori к кларитромицину в популяции конкретного региона превышает 15–20%, а к метронидазолу выше 40%, эти антибактериальные препараты не должны применяться в схемах эрадикации.
При высокой эффективности квадротерапии, не является ли целесообразным ее назначение в качестве терапии первой линии, особенно в условиях высокой антибиотикорезистентности? На этот вопрос позволяет ответить метаанализ 102 исследований эрадикации, включающий 398 вариантов и 25 644 пациента, не выявивший преимуществ квадротерапии по сравнению с тройной (эффективность 80,4% и 81,1% соответственно). Аналогичные результаты были получены в североамериканском исследовании, включавшем 275 пациентов. В данном исследовании сравнивали тройную терапию: омепразол (20 мг 2 раза в сутки) + кларитромицин (500 мг 2 раза в сутки) + амоксициллин (1,0 г 2 раза в сутки), с квадротерапией: омепразол (20 мг 2 раза в сутки) + висмута бискальцитрат (120 мг 4 раза в сутки) + метронидазол (375 мг 4 раза в сутки) + тетрациклин (375 мг 4 раза в сутки). Эффективность этих схем оказалась практически одинаковой (83,2% и 87,7% соответственно). Тройные (омепразол + амоксициллин + кларитромицин) и квадротерапия (омепразол + висмут + тетрациклин + метронидазол), используемые в качестве терапии первой линии, оказались эффективными в равной степени (87% vs 86%).
Согласно нашим данным, эффективность тройной терапии с амоксициллином (омепразол + амоксициллин + метронидазол) составляет 73%, а сходной квадротерапии (омепразол + амоксициллин + метронидазол + Де-нол) — 76%. Однако совсем другие результаты были получены при использовании схем с кларитромицином. Эффективность стандартной схемы, рекомендованной Консенсусом Маастрихт-3 (эзомепразол + кларитромицин + метронидазол), составила всего 14,3%, дополнение этой же схемы Де-нолом повысило эффективность до 65%. Полученные нами данные согласуются с результатами европейского исследования, проведенного Williamson R., Pipkin G. A. [32], по мнению которых Де-нол способен преодолевать как первичную, так и вторичную антибиотикорезистентность Н. pylori. Это позволяет рекомендовать Де-нол в схемах эрадикации Н. pylori и делает целесообразным назначение этого препарата уже в ходе первой линии терапии.
В случае неэффективности схем эрадикации первой и второй линии Консенсус Маастрихт-3 предлагает практическому врачу несколько приемлемых вариантов дальнейшей терапии. Поскольку к амоксициллину в процессе его применения не вырабатывается устойчивость штаммов Н. pylori, возможно назначение его высоких доз (0,75 г 4 раза в сутки в течение 14 дней) в комбинации с высокими (4-кратными) дозами ИПП в виде двойной терапии, однако, по нашему мнению, мегадозы этих препаратов могут обернуться значительным увеличением числа побочных реакций. Другим вариантом может быть замена метронидазола в схеме квадротерапии на нитрофураны. Согласно последним российским исследованиям, наиболее приемлемы нифурател (Макмирор 15 мг/кг/сут) или нифуроксазид (Энтерофурил 200 мг 2 раза в день). Альтернативой служит применение комбинации ИПП с амоксициллином и рифабутином (300 мг в сутки) или левофлоксацином (500 мг в сутки). Попытки замены кларитромицина на другие макролидные антибиотики также предпринималась. В исследовании, проведенном в США, сравнивалась эффективность квадротерапии, включающей ИПП (лансопразол), препараты висмута, амоксициллин и кларитромицин/азитромицин. В первом случае частота эрадикации равнялась 84,6%, во втором — 55,5%. То есть по эффективности азитромицин уступает кларитромицину.
Таким образом, в России, в условиях высокой резистентности Н. pylori к кларитромицину и метронидазолу, в качестве эрадикационной терапии первой линии могут быть рекомендованы следующие схемы:
Контроль эффективности терапии (достижение эрадикации) следует проводить через 4–6 недель после окончания лечения. Для контроля целесообразно использовать неинвазивные методы, прежде всего, дыхательные (С13-углеродный тест или Хелик-тест). При отрицательном результате теста (эрадикации Н. pylori) дальнейшего лечения не требуется. При положительном результате повторная терапия проводится по другой схеме с использованием других антибиотиков, в частности, может быть назначена классическая схема второй линии — квадротерапия, включающая ИПП + Де-нол + тетрациклин (с 12 лет) + метронидазол. Если при проведении терапии первой линии не использовались нитрофураны, то вместо метронидазола оптимально назначение нифуратела или нифуроксазида.
Эрадикационную терапию как первой, так и второй линии следует дополнять назначением современных пробиотиков. Исследования, проведенные как в России, так и за рубежом, показали повышение эффективности лечения и уменьшение побочных реакций при параллельном назначении пробиотиков. В работе П. Л. Щербакова с соавт. было показано повышение процента эрадикации Н. pylori с 84% при назначении стандартной тройной схемы до 92% при параллельном приеме Линекса. Нами были изучены показатели местного и общего иммунного статуса и результативность стандартной тройной терапии (ИПП + амоксициллин + метронидазол) при параллельном назначении Бифиформа. Исследование показало повышение эффективности лечения с 73% до 84%, уменьшение побочных реакций и дисбиотических отклонений в кале. Лечение пробиотиком сопровождалось повышением уровня секреторного IgA, фагоцитарной активности, а также снижением уровня IgE в крови. В литературе имеются данные об антихеликобактерной эффективности Saccharomyces boulardii и некоторых штаммов лактобацилл На основании этого с целью профилактики хеликобактериоза можно рекомендовать йогурты с лактобациллами определенных штаммов.
Литература
За остальным списком литературы обращайтесь в редакцию.
П. Л. Щербаков*, доктор медицинских наук, профессор
В. С. Кашников**, кандидат медицинских наук
Е. А. Корниенко***, доктор медицинских наук, профессор
*Центральный НИИ гастроэнтерологии, Москва
**Ставропольская детская клиническая больница, Ставрополь
***СПбГПМА, Санкт-Петербург
Контактная информация об авторах для переписки: petersh@su29.ru.