Чем лечить хеликобактерную инфекцию
Хеликобактер пилори: когда язва желудка «заразна»
Гастритом сегодня «не удивить». Да и язва желудка – не редкость. Однако не все знают, что эти болезни бывают «заразны», если в процессе виновна бактерия. Но неужели заражаются все? И насколько это опасно? А также, чем лечить «желудочную» хеликобактер пилори?
Почему хеликобактер опасна
Хеликобактер пилори – бактерия особого класса, способная не только выживать, но и «процветать» в условиях агрессивной кислотной среды. При этом, провоцируя развитие гастрита, язвы и даже рака.
Но давайте по порядку.
В образовании эррозий и язв «виновны» ферменты бактерии:
Уреаза
обеспечивает синтез аммиака из белковой пищи. А последний, как щелочное соединение, разбавляет «желудочную» кислоту до нейтрального pH 6-7 (при исходной кислотности 1,5-2), тем самым создавая безопасную среду для «проживания» бактерии.
Однако накопление нужной концентрации аммиака, разумеется, не происходит в «одночасье». И в это время бактерия, казалось бы, должна быть беззащитна. Но здесь у возбудителя есть другой способ защиты.
Липаза, муциназа и протеаза
создают дыры в густом слое «антикислотной» слизи желудка, позволяя бактерии проникать «под» него и надежно «скрываться» от действия кислоты.
Чем больше площадь и количество таких «дыр», тем больше участков желудка оказываются оголены и подвержены «разъеданию» кислотой. При этом, логично предположить, что по мере накопления аммиака, кислотность должна бы снижаться. А вместе с ней и риск язвенных поражений.
Однако на деле продукция кислоты, наоборот, возрастает, в попытке вернуть должный желудочный pH. И оголенные участки подвергаются еще большему поражению, глубина которого может варьировать от минимальных эррозий до обширных язв и даже «сквозных дыр».
Но и это не вся опасность бактерии.
Экзотоксин VacA и особые cagA-эффекторные белки
хеликобактер оказывают влияние на геном желудочных клеток, изменяя их функции и искажая деление, чем провоцируют развитие рака. Присутствие бактерии на слизистой желудка приводит к хроническому воспалению, в слизистую приходят иммунные клетки – лимфоциты, происходит атрофия желудочных желез и нарушение созревания клеток поверхностных слоев желудка.
Связь хеликобактерной инфекции, гастрита с атрофией желез и рака желудка доказана не одним научным исследованием. И, к примеру, в Японии, где инфицированность бактерией повсеместна, даже существует национальная бесплатная программа по эррадикации (излечиванию) хеликобактер пилори. Позволившая значительно снизить заболеваемость раком желудка.
При этом, по какому «сценарию» пойдет хеликобактерная инфекция заранее предугадать невозможно. И у одних заражение протекает без последствий, а у других – заканчивается язвой или раком желудка.
Как передается бактерия
На сегодняшний день хеликобактер пилори считается одной из самых распространенных бактерий в мире.
И ввиду ее «места обитания», основными путями передачи приняты:
А источником всегда служит больной человек.
При этом, ранее считалось, что заражение может произойти через общую посуда или предметы личной гигиены.
Однако сегодня орально-оральный путь подлежит пересмотру.
Дело в том, что по данным некоторых исследований, в слюне зараженных не было обнаружено маркеров бактерии. Тогда как анализ кала, крови и/или уреазный дыхательный тест – все же демонстрировали инфицирование.
Таким образом, предполагается, что основным путем передачи все же является фекально-оральный (через «грязные» руки). Однако и орально-орально путь пока «никто не отменял».
Признаки заражения
А поводом для обследования служат любые проявления «желудочных» нарушений. А также наследственная предрасположенность к язве или раку.
Обследование строится на основании стадии процесса.
И в стадии обострения наибольшую информативность демонстрирует:
основан на способности бактерии образовывать аммиак. А последний вступает в реакцию с кислотой, с выделением углекислого газа, уровень которого и замеряется в процессе анализа.
Однако СО2, как известно, образуется и в процессе дыхания. Поэтому дыхательный тест подразумевает подсчет не обычного углекислого газа, а особого, содержащего меченые атомы углерода. Чтобы получить такие «метки», пациенту предлагается выпить специальный раствор мочевины (CH4N2O), содержащий те самые меченые атомы углерода ( 13 С). И, если хеликобактер присутствует в желудке, она «расщепит» мочевину до аммиака с образованием меченого углекислого газа.
Раствор не имеет ни вкуса, ни запаха. А также абсолютно безопасен и широко разрешен к применению у детей (старше 14 лет).
Подготовка к исследованию требует только прийти на голодный желудок (не менее 6 часов голода) и выпить 200 мл апельсинового или грейпфрутового сока за 10-15 минут до анализа. Чтобы немного замедлит продвижение желудочного содержимого, тем самым повышая интенсивность всасывания меченого углекислого газа в кровоток.
А замеры проводятся путем выдыхания воздуха в специальный «пакет» и не требуют взятия крови или иных материалов.
признан «золотым стандартом» диагностики хеликобактерной инфекции. Но, как уже было отмечено, показателе только в период обострения «желудочных» симптомов.
можно использовать в стадии ремиссии или в целях профилактического обследования.
Повышение уровня поможет подтвердить сам факт заражения. Однако результаты исследования сильно зависят от исходного состояния иммунитета.
Кислотность желудка
также может говорить о наличии атрофического гастрита, вызванного бактерией, правда по косвенным признакам.
А помочь в выявлении «кислотных» нарушений желудка призван комплексный анализ крови «Гастропанель».
Тест включает определение гастрина-17, пепсиногена I и II. Что позволяет своевременно выявлять риск атрофического гастрита, язвы и предраковых состояний без проведения гастроскопии («глотание лампочки»). Ввиду достоверной связи бактерии хеликобактер с указанными процессами, исследование также включает определение IgG к бактерии.
Как избавиться от бактерии
Эррадикация (полное уничтожение) хеликобактер пилори требует обязательного многокомпонентного подхода.
В составе терапии обязательно присутствуют:
Длительность приема антибиотиков в среднем составляет 14 дней, «антикислотной» терапии – до 4 недель, в зависимости от исходной степени нарушения.
А проверка эффективности лечения проводится с помощью уреазного теста или анализа кала на антигены бактерии. Причем не ранее, чем через 4 недели после окончания приема антибиотиков и висмута. И не ранее, чем через 2 недели – после последнего приема ингибиторов протонной помпы.
Инфекция Helicobacter pylori
Helicobacter pylori – это бактерия, которая паразитирует на слизистой оболочке желудка человека. Эти бактерии способны продуцировать и высвобождать большое количество ферментов и токсинов, которые способствуют повреждению клеток слизистой оболочки, что может приводить к развитию воспалительных и язвенных заболеваний желудка и двенадцатиперстной кишки. При этом известно, что почти 60% населения земного шара инфицированы Helicobacter pylori. Следовательно, далеко не каждый инфицированный человек заболевает язвенной болезнью, однако среди заболевших у большинства выявляется данная инфекция. В настоящее время доказано, что наличие инфекции Helicobacter pylori при воспалительных заболеваниях желудка и двенадцатиперстной кишки является показанием к назначению антибактериальной терапии.
Причины заболевания
Helicobacter pylori обитает только в желудке человека. Заражение происходит при контакте с инфицированным человеком. Передача инфекции может происходить орально-оральным путем при поцелуях или использовании одной посуды, а также через предметы гигиены. Как правило, все члены семьи бывают инфицированы одним штаммом Helicobacter pylori, что доказывает контактно-бытовой путь передачи.
Симптомы заболевания
Во многих случаях инфекция может протекать бессимптомно. Выявление Helicobacter pylori в отсутствие воспалительных заболеваний желудка или кишечника не является показанием к назначению антибактериальной терапии.
При развитии на фоне инфекции Helicobacter pylori воспалительных заболеваний (язва желудка или двенадцатиперстной кишки, эрозивный гастрит, гастродуоденит) клиническая картина будет соответствовать заболеванию.
Диагностика
Диагностика инфекции Нelicobacter pylori возможна при использовании целого ряда методов, которые позволяют выявить сам микроорганизм, признаки его жизнедеятельности или иммунологический ответ организма на инфекцию (антитела в сыворотке крови). Как правило, пациента направляют на исследование при обнаружении активного воспалительного процесса в желудке или двенадцатперстной кишке.
Лечение
Диагностикой и лечением этой инфекции занимается врач-гастроэнтеролог.
Выявление инфекции Helicobacter pylori в отсутствие воспалительных заболеваний желудочно-кишечного тракта не является показанием к терапии.
Для лечения хеликобактерной инфекции разработано несколько терапевтических схем, включающих один, два или три антибактериальных препарата (амоксициллин, кларитромицин, фуразолидон и др.), антисекреторные средства (омепразол, ранитидин) и препараты висмута.
Контроль за эрадикацией (уничтожением) Helicobacter pylori осуществляют через 2-6 недель после проведенного лечения как минимум двумя методами диагностики из приведенных выше.
Бактерия Хеликобактер Пилори
Что такое Хеликобактер Пилори?
Хеликобактер Пилори (Helicobacter Pylori) – это микроаэрофильный, грамотрицательный микроорганизм, паразитирующий в желудке человека, тем самым вызывая развитие болезней пищеварительной системы.
При попадании в организм эта бактерия начинает провоцировать различные опасные патологии. Это происходит потому, что на Хеликобактер Пилори не влияет соляная кислота, и поэтому ничего не мешает этой бактерии проникать вглубь слизистой оболочки желудка и нарушать ее защитную функцию.
Какие заболевания вызывает бактерия?
Хеликобактер приводит к развитию следующих заболеваний:
Факторы риска заражения Хеликобактер Пилори
Пути проникновения Хеликобактер Пилори в организм на сегодняшний день до конца не изучены.
Выделяется несколько возможных механизмов попадания этой бактерии в желудок:
Симптомы Хеликобактер Пилори
Выделяется латентная форма развития заболевания, при которой Хеликобактер может не проявляться годами.
Бактерия может долго находиться в неактивной форме, дожидаясь благоприятных условий для активизации, однако даже при отсутствии симптомов происходит нарушение функционирования желудка и поджелудочной железы.
Симптомы Хеликобактер Пилори могут наблюдаться следующие:
Диагностика и лечение Хеликобактер Пилори
Диагностика
Диагностика Хеликобактер Пилори в клинике А-Медия проводится современными методиками, среди которых выделяются:
Лечение
Обычно при диагностировании у пациента Хеликобактер лечение проводится антибиотиками. Все препараты наш опытный врач подбирает индивидуально для каждого пациента в зависимости от особенностей его организма.
Продолжительность курса терапии, как правило, составляет две недели.
При лечении Хеликобактер Пилори пациент обязательно должен полностью отказаться от употребления алкоголя и, желательно, курения. Также специалист нашей клиники поможет ему скорректировать питание.
В случаях, если бактерия уже спровоцировала какое-либо заболевание, наш врач назначит комплексную терапию, направленную на лечение возникшей патологии и устранение Хеликобактер Пилори.
Профилактика Хеликобактер Пилори
Придерживаясь простых рекомендаций, можно избежать заражения таким коварным микроорганизмом, как Хеликобактер:
Пройдите обследование на Хеликобактер Пилори в клинике А-Медия, и вы получите точную информацию, касающуюся присутствия этой бактерии в вашем организме.
При подтверждении диагноза или наличии других заболеваний ЖКТ, рекомендуется записаться к врачу гастроэнтерологу.
Хеликобактер пилори: найти и обезвредить
Поделиться:
Эта бактерия — возбудитель одной из самых распространенных в мире хронических инфекций, поражающей примерно половину популяции.
Около 90% зараженных не испытывают никакого дискомфорта, существуя с ней в мире и согласии.
Однако остальные 10% в полной мере ощущают коварство хеликобактера и часто нуждаются в неотложном лечении связанных с ним заболеваний — гастрита, язвенной болезни или даже рака желудка.
Можно ли предупредить заражение и что же делать тем, у кого анализы выявили инфекцию?
От человека – человеку
Считается, что заражение хеликобактером может происходить тремя основными путями: фекально-оральным (к примеру, при несоблюдении правил гигиены, питье неочищенной воды), орально-оральным (со слюной) и при проведении медицинских манипуляций необработанными инструментами, такими как эндоскоп. Бактерии выделяют из различных сред организма —фекалий, желудочного сока, слюны.
Чаще всего инфицирование происходит в раннем детстве, преимущественно на первом-втором году жизни. Предполагается, что источником инфекции для малыша обычно становится зараженная мать.
Грудное вскармливание, по всей видимости, не только не защищает ребенка от хеликобактера, а, напротив, в какой-то мере предрасполагает.
Кормящая мама нередко не моет руки перед кормлением, что резко повышает риск инфицирования ребенка. Выходит, чем дольше малыша кормить грудью, тем выше вероятность заразить его опасной бактерией, разумеется, если мать является ее носителем.
Читайте также:
Язва желудка: как будем лечить?
В подавляющем большинстве случаев инфекция не имеет клинических признаков. Но настораживающая статистика связанных с ней рисков для здоровья не может оставлять равнодушными даже бессимптомных носителей.
Хеликобактер в фактах и цифрах
Helicobacter pylori признана одним из ключевых факторов развития множества желудочно-кишечных заболеваний. Ее выявляют у 90-100% больных язвенной болезнью двенадцатиперстной кишки и 60-100% пациентов с язвой желудка. Успешное лечение инфекции в таких случаях обеспечивает полное исцеление от язвы и снижает риск ее повторного появления до 10%.
Хеликобактер стала первым официально признанным бактериальным канцерогеном — она тесно связана с аденокарциномой и низкодифференицируемой лимфомой. До 90% случаев рака желудка развиваются вследствие инфекции Helicobacter pylori.
Риски еще более увеличиваются у тех, кто ест много соли и/или курит.
И наоборот: после успешного излечения от инфекции вероятность злокачественных заболеваний желудка снижается как минимум на 34%.
Кроме того, именно с хеликобактером связаны диагнозы хронического и атрофического гастрита. Поэтому при появлении проблем с желудком очень важно провести качественную диагностику.
Тернии диагностики
Самый простой способ выявить инфекцию открывается перед теми, кто проходит гастроскопию. Во время процедуры врач может провести быстрый уреазный тест. Он очень простой и эффективный: его чувствительность достигает 40%, а результат можно получить уже через несколько минут.
Но если выявить инфекцию нужно, а гастроскопию делать необходимости нет, используют другие методы. К относятся ним исследование кала для определения антигена бактерии и дыхательный тест.
Все перечисленные методики могут дать неверный результат, если накануне их проведения принимать препараты, которые блокируют выработку соляной кислоты в желудке, — ингибиторы протонной помпы (например, омепразол, пантопрозол, рабепразол и так далее).
Исказить результаты исследования могут также антибиотики и препараты, содержащие соли висмута (висмута трикалия дицитрат).
Чтобы выявить бактерию наверняка, следует не менее чем за 4 недели отменить антибиотики и препараты висмута, а за 2 недели до анализов перестать пить ингибиторы протонной помпы.
А вот при проведении исследования крови принимаемые накануне лекарства не оказывают влияния на результат, позволяя выявить инфекцию или проследить эффективность терапии.
Лечить или не лечить?
С одной стороны, если есть инфекция в организме, ее нужно лечить. Тем более такую коварную, как хеликобактерная.
Но с другой стороны, для 9 из 10 инфицированных бактерия не представляет опасности. К тому же она настолько распространена, что каждый пятый успешно пролеченный заболевает вновь.
В то же время лечение довольно сложное, и должно проводиться только по показаниям, чтобы избежать развития устойчивости бактерии к антибиотикам. Поэтому назначают его, как правило, в следующих случаях:
• Выявленное поражение желудка и/или двенадцатиперстной кишки — гастрит, язвенная болезнь и так далее.
• Нарушение пищеварения, которое не сопровождается изменениями в состоянии органов ЖКТ (функциональная диспепсия), — боль в животе, отрыжка, метеоризм, вздутие и другие.
• Семейная история рака желудка, например, в случаях, когда это заболевание было выявлено у родителей, братьев или сестер.
Бессимптомно протекающую инфекцию, не подпадающую под эти три категории, обычно не лечат. Впрочем, если сам зараженный очень хочет избавиться от близкого «соседства» с хеликобактером, доктор может-таки назначить эрадикационную терапию.
Возможности профилактики
Конечно, любую инфекцию легче предупредить, чем лечить, хотя в случае с хеликобактером это очень проблематично.
Поскольку большинство инфицированных заражается в раннем детстве, профилактика должна ложиться на плечи родителей. Ее основной принцип — соблюдение правил гигиены: не пользоваться одной посудой с малышом, не облизывать пустышки и не дегустировать детское питание. Достичь этого на самом деле сложно, и это легко подтвердит любая мама.
Поэтому профилактика хеликобактера — понятие скорее гипотетическое, чем практическое. В отличие от диагностики и лечения, эффективность которых приближается к 100%, вселяя надежду и внушая оптимизм.
Точка зрения автора может не совпадать с точкой зрения редакции
Антигеликобактерная эрадикационная терапия – выход из тупика или движение вглубь лабиринта?
К настоящему времени установлено, что эрадикация Helicobacter pylori может ускорить сроки рубцевания язвы, улучшить качество жизни пациента и уменьшить частоту рецидивов, но не позволяет ликвидировать заболевание. Это связано с тем, что Helicobacter pylori является не облигатно-патогенным, а условно-патогенным микробом. Соответствен но, стратегия эрадикационной терапии при заболеваниях, ассоциированных с условно-патогенной микрофлорой, в том числе с Helicobacter pylori, как минимум является ошибочной.
Уровень развития современной медицины, как и любого другого направления в науке, зависит от объема знаний и навыков, накопленных многими десятками предшествующих поколений. В то же время следует признать, что мы, как и современники Гиппократа, двигаемся вперед путем совершения проб и ошибок. Можно согласиться с тем, что число этих ошибок уменьшилось, но в целом оно еще очень велико. Достаточно упомянуть тот факт, что в нас тоящее время в каждом разделе медицины с периодичностью 3-5 лет происходит пересмотр рекомендаций по вопросам диагностики и лечения различных заболеваний. Ранее же ревизия сложившихся представлений занимала столетия и даже тысячелетия.
Открытие антибиотиков без преувеличения является одним из величайших достижений медицины, поскольку их использование позволило радикально сократить смертность от инфекционных заболеваний во всем мире. В конце ХХ века на слизистой оболочке желудка и двенадцатиперстной кишки пациентов с язвенной болезнью были выявлены грамотрицательные, неспорообразующие бак терии – Helicobacter pylori. Включение в программу лечения гастродуоденальных язв антибиотиков, обладающих антигеликобактерной активностью, в комбинации с блокаторами протонной помпы, позволило добиться максимального сокращения сроков рубцевания язвы, которое почти в 100% случаев сопровождалось эрадикацией бактерии. Данный факт послужил основанием для вывода о том, что H. pylori в сочетании с гиперхлоргидрией являются главными причинами язвенной болезни. Таким образом, о язвенной болезни стали говорить как об инфекционном заболевании. Однако лечением таких пациентов по-прежнему за ни маются не инфекционисты, а гастроэнтерологи. Поскольку выздоровлению пациентов инфекционных отделений всегда предшествует эрадикация инфекционного агента – виновника заболевания, данный подход был распространен и на пациентов с язвенной болезнью.
Длительное время существовало стойкое убеждение, что с эрадикацией H. pylori будет ликвидирована и язвенная болезнь. Прошло более 30 лет с момента открытия микроорганизма, в связи с чем появилась возможность подвести определенные итоги. Воздержимся пока от собственных оценок и обратимся к высказыванию И.В. Маева – одного из ревностных приверженцев версии о главной роли H. pylori в патогенезе язвенной болезни. «Несмотря на уже многолетнюю активную борьбу … с H. pylori-инфекцией, распространенность язвенной болезни как в нашей стране, так и в большинстве стран мира не снижается. Стабильно высокой (на уровне 10%) остается и частота ее грозных осложнений (перфорации, пенетрации, кровотечения и др.)» [1].
Приведенная фраза фактически является авторитетным признанием того, что утверждение о ведущей роли H. pylori в патогенезе язвенной болезни является ошибочным. Действи тельно, в значительной части случаев язвенная болезнь развивается без всякого участия H. pylori (H. pylori-негативные формы болезни). В США частота язвенной болезни, не ассоциированной с H. pylori, варьируется от 39 до 52%, а в Австралии достигает 45% [2,3]. Представленные данные наглядно демонстрируют, что роль H. pylori без достаточных оснований чрезмерно демонизирована.
Поскольку принципы лечения гастродуоденальных язв тесно увязаны с представлением о роли H. pylori, возникает вопрос, отразилось ли это на алгоритме антибактериальной терапии больных? На данный вопрос в целом можно ответить утвердительно. Корректировка схем лечения действительно осуществляется каждые несколько лет. Последние рекомендации сформулированы в Маастрихт-V-Флорентийском консенсусе [4]. Значительная часть всех пяти вариантов Мааст рихт ского консенсуса посвящена рассмотрению вопроса: что делать, если неэффективна та или иная схема терапии? Соответственно, в последнем варианте, как и в четырех предыдущих изданиях, преимущественно обсуждается тактика преодоления резистентности H. pylori к используемым антибиотикам. При этом стратегический вопрос о целесообразности обязательного достижения эрадикации H. pylori даже не возникает, он автоматически, в течение более 30 лет, переносится из одних рекомендаций в другие, хотя, как уже отмечалось, заболеваемость язвенной болезнью на планете за данный период не снижается. Более того, в новых рекомендациях без достаточных оснований расширяется круг заболеваний и синдромов, при которых рекомендуется проводить эрадикационную терапию.
Недавно, на страницах данного журнала Я.С. Цим мерман опубликовал дискуссионную статью, в которой привел целый ряд фактов, заставляющих усомниться в гипертрофированной роли H. pylori и в адекватности стратегии консервативной терапии гастродуоденальных язв. С учетом собственного опыта мы целиком разделяем точку зрения Я.С. Циммермана о том, что авторысоставители «Маастрихтских консенсусов» по существу монополизировали право определять показания к эрадикации H. pylori и методику проведения эрадикационной терапии, провозгласив стратегию на тотальную ликвидацию H. pylori (test and treat strategy: выявлять и уничтожать!), что научно бездоказательно и практически неосуществимо [5]. Твердо убеждены, что подобный подход является однобоким, ошибочным и требует учета альтернативных фактов. С учетом изложенного в предлагаемой статье мы постараемся более подробно остановиться на дискуссионных моментах, касающихся вопросов стратегии антигеликобактерной эрадикационной терапии.
В противовес утверждению о главной роли H. pylori в патогенезе гастродуоденальных язв считаем необходимым напомнить хорошо известный факт, установленный еще В.Х. Василенко (1970 г.) – «Язвы заживают при лечении, без лечения и вопреки лечению» [6]. С учетом того, что у значительной части больных возникновение заболевания возможно и при отсутствии H. py lori, данное наблюдение убедительно свидетельствует о существовании причин, которые играют более важную роль в патогенезе гастродуоденальных язв, чем наличие микроба. Считаем, что в патогенезе гастродуоденальных язв среди многочисленных факторов риска ведущими являются «немодифицируемые»: наследственность, пол и возраст человека. Непосредственная же реализация их роли осуществляется за счет имеющейся врожденной или приобретенной локальной гипоплазии сосудов в двенадцатиперстной кишке или желудке, которая также относится к категории немодифицируемых факторов [7]. Помимо немодифицируемых, в патогенезе гастродуоденальных язв важную вспомогательную роль играет огромное количество факторов, которые считаются «модифицируемыми»; к их числу относится и H. pylori. С учетом выраженного положительного ответа на антигеликобактерную терапию есть основание сделать вывод, что среди модифицируемых факторов H. pylori играет одну из главных ролей.
Опыт последних тридцати с лишним лет показал, что эрадикация геликобактера, сокращая сроки рубцевания язв, одновременно ведет к снижению соотношения гастродуоденальных язв, ассоциированных и не ассоциированных с H. pylori, но при этом, вопреки ожиданиям, не ведет к ликвидации язвенной болезни [8]. Большой интерес представляют наблюдения хирургов, установивших, что частота рецидивов после успешно выполненных органосберегающих операций (стволовой ваготомии с экономной резекцией язвы) составляет 0% в течение более 25 лет после вмешательства. При этом положительный H. pylori-статус у оперированных больных выявляют с той же частотой, что и в популяции [9,10]. Важно отметить рост смертности от осложнений длительно не рубцующихся гастродуоденальных язв, что дает повод провести переоценку показаний к проведению планового оперативного лечения при указанных состояниях. Приведенные примеры наглядно демонстрируют, что в значительном числе случаев успешное хирургическое устранение части стенки желудка или двенадцатиперстной кишки, включающей участок локальной гипоплазии сосудов, является гораздо более эффективной мерой, чем эрадикация H. pylori.
Негативный парадокс обсуждаемой проблемы заключается в том, что к настоящему времени данный микроб без достаточных оснований рассматривается в качестве главной причины возникновения уже целого ряда других заболеваний. Показания к их эрадикационной терапии были сформулированы еще консенсусом «Маастрихт II». В последующих согласительных документах дополнительно указывался ряд новых патологических состояний, при которых также рекомендовалось проведение эрадикационной терапии. К настоящему времени показаниями к диагностике и лечению H. pylori служат следующие [4,11]:
При этом игнорируется тот факт, что данный подход находится в противоречии с представлениями о патогенезе, особенностях течения, лечения и исходов классических облигатно- и условно-патогенных инфекций [12]. Известно, что биомасса микробов, заселяющих желудочно-кишечный тракт взрослого человека, составляет 2,5–3 кг и более и включает в себя до 450–500 видов. Около 90% данного микробиоценоза представлено облигатной (обязательной) нормальной микрофлорой, выполняющей множество жизненно важных функций [13]. Без преувеличения, значение данной микрофлоры сопоставимо с ролью такого важного органа, как печень. Остальная часть микробиоценоза представлена факультативной (возможной, необязательной) микрофлорой, часто встречающейся у здоровых людей и являющейся условно-патогенной [14]. Условно-патогенными считают микроорганизмы, представляющие собой большую группу грибов, бактерий, простейших и вирусов. Они являются нормальными обитателями кожи и слизистых оболочек, мирно сосуществующими с организмом человека, что свидетельствует о том, что иммунная система хозяина не воспринимает их как угрозу и ведет себя нейтрально. При этом они способны долгое время существовать в окружающей среде.
H. pylori относится к категории условно-патогенных инфекций. Особенностью микроорганизмов данного типа является то, что они многие годы и даже всю жизнь могут находиться в организме человека, не проявляя признаков какой-либо агрессии. Агрессивные свойства данные инфекционные агенты проявляют лишь в условиях пассивного проникновения во внутреннюю среду в больших количествах и (или) резкого снижения общего и местного иммунитета человека (нарушение целостности покровов, бактерицидной активности секретов, подавление фагоцитарной реакции, снижение числа микробов-антагонистов и др.). Это связано с тем, что условно-патогенные микробы, в отличие от облигатно-патогенных, не обладают факторами активного проникновения во внутреннюю среду, подавления защитных сил организма, не выделяют экзотоксины. Патогенное влияние на организм они оказывают с помощью эндотоксина и ферментов-токсинов [12].
Данные больные являются заразными, поэтому они нуждаются в изоляции от окружающих и соблюдении требований противоэпидемического режима и должны получать лечение в специализированных инфекционных отделениях. В подобных случаях убедительным и вполне обоснованным выглядит требование добиваться, в обязательном порядке, эрадикации инфекционных агентов, вызвавших данное заболевание.
Таким образом, в возникновении перечисленных патологических состояний H. pylori играет роль важного модифицируемого, но не главного фактора риска. В этой связи, утверждение, что при всех перечисленных состояниях антигеликобактерная терапия должна быть эрадикационной, вызывает большие сомнения. Накоп ленный мировой опыт допускает эмпирическое использование антибактериальных препаратов сразу после установления диагноза при заболеваниях, ассоциированных с условно-патогенной флорой (пневмонии, инфекции желчевыводящих, мочевыводящих путей и др.). При этом учитываются результаты предшествующих эпидемиологических исследований по региону, лечение пациентов данной категории осуществляется вне инфекционного стационара – в общетерапевтических, хирургических и других отделениях. Часто в результате лечения удается достичь и эрадикации агента, причастного к возникновению пневмонии или другого подобного заболевания, однако задача обязательного достижения подобной цели не стоит. Более того, прием антибиотиков прекращается задолго до того, как ликвидированы пневмоническая инфильтрация и основные лабораторные и клинические прояв ления. Таким образом, главной целью лечения заболеваний, ассоциированных с условно-патогенной флорой, является не эрадикация условно-патогенных бактерий, а достижение клинического выздоровления при острой болезни или ремиссии хронического заболевания. Принципиальным является тот факт, что после выздоровления не ставится задача контроля степени эрадикации возбудителя заболевания, более того, после успешного завершения лечения возбудитель часто так и остается неизвестным [17].
Отсутствие убедительных доказательств целесообразности эрадикации H. pylori при гастродуоденальных язвах делает еще менее обоснованным утверждение о необходимости добиваться той же цели при прочих перечисленных выше заболеваниях. Обсуждения заслуживают, прежде всего, хронический гастрит и функциональная диспепсия, ассоциированные с H. pylori, и рак желудка. Считается, что при естественном течении H. pylori-ассоциированнного хронического гастрита у 1-2% больных нарушается стройная система клеточного обновления слизистой оболочки желудка. Это ведет к атрофии и прогрессированию морфологических изменений в слизистой оболочке, что способствует формированию рака желудка («каскад Correa») [18].
Заболеваемость раком желудка характеризуется примерно 10-кратными географическими колебаниями, что может свидетельствовать о более важной роли этнической и наследственной предрасположенности. Рак желудка очень часто встречается в странах Восточной Азии (Японии и Корее), Южной Америке и Восточной Европе и значительно реже в Южной Азии, Северной Америке, Северной и Восточной Африке, Австралии, Новой Зеландии [19,20]. Особый интерес представляет тот факт, что в африканской популяции, где отмечается максимальная распространенность H. pylori (до 97%), рак желудка распространен в минимальной степени, а в Японии, где распространенность H. pylori составляет около 43%, заболеваемость раком этой локализации высокая. С учетом изложенного, трудно согласиться с утверждением, что инфекция H. pylori является канцерогеном 1 группы для человека [21]. Сомнение в обоснованности данного утверждения усиливается еще более, если обратиться к статистике распространенности рака желудка в России за период 2005-2015 гг. (рис. 1) [22].
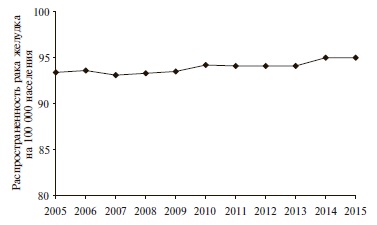
Приведенные данные наглядно свидетельствуют о том, что внедрение в практику эрадикационной стратегии не способствует снижению распространенности рака желудка в России. Более того, отмечается его статистически недостоверный, но неуклонный рост за период 2005-2010 гг., что делает сомнительным утверждение о целесообразности проведения эрадикационной терапии с целью профилактики возникновения данного вида онкопатологии.
Большой интерес представляет исследование, которое в течение около 7,5 лет проводилось в китайской провинции, где отмечается высокая заболеваемость раком желудка. Пациенты с сопоставимым риском возникновения рака желудка были распределены на две группы и получали плацебо (n=813) или эрадикационную терапию (n=817). В первые 5 лет кумулятивная заболеваемость раком желудка была выше в группе плацебо, однако к концу исследования частота его в сравниваемых группах достоверно не различалась [23]. Приведенные данные наглядно свидетельствуют о том, что эрадикационная терапия может на несколько лет замедлить скорость прогрессирования рака желудка, но не способна его предотвратить. В литературе приводятся данные о том, что эрадикационная терапия является эффективным элементом профилактики рака лишь в тех случаях, когда ее назначают до развития преднеопластических состояний. Установлено, что III и IV стадии атрофического гастрита по системе OLGA ассоциируются с повышенным риском развития рака желудка [24]. Эрадикационная терапия у пациентов с кишечной метаплазией не приводит к обратному развитию последней, она может лишь замедлить прогрессирование метаплазии до неоплазии.
Все схемы эрадикационной терапии, сформулированные в пяти Маастрихтских рекомендациях, предлагаются не в качестве рекомендаций, возможных к использованию, а вменяются в виде обязательств, непременных к исполнению. В этой связи представляет интерес наблюдение о распространенности язвенной болезни у лиц, занятых в производстве антибиотиков. При этом установлено, что средний возраст больных с дуоденальными язвами (39,8 лет), занятых в производстве антибиотиков, соответствовал таковому больных с язвами двенадцатиперстной кишки контрольной группы, работа которых не была связана с данным производством. В то же время, средний возраст пациентов с язвами желудка в основной группе (38,7 лет) был ниже возраста, характерного для лиц с язвами данной локализации (40-50 лет) в контроле. Это дает основание говорить о том, что продолжительный контакт человека с антибиотиком ведет к росту резистентности условнопатогенной флоры, что, в конечном счете, способствует более раннему возникновению язвы желудка у лиц, работа которых связана с производством антибиотиков [25].
Суммарная распространенность хронического гаст рита и функциональной диспепсии сопоставима с распространенностью H. pylori в популяции (не менееполовины населения). Известно, что при естественном течении хронического гастрита 1-2 из 100 человек могут умереть от рака желудка. При III и IV стадии атрофического гастрита эрадикационная терапия бесполезна. Требование о необходимости проведения эрадикации на более ранних стадиях означает, что в программу лечения следует включать не менее 50% населения планеты. В то же время, ранее приведенные примеры свидетельствуют о том, что, во-первых, эрадикационная терапия не остановит прогрессирования ни хронического гастрита, ни функциональной диспепсии. Во-вторых, у 1-2 из 100 человек с хроническим гастритом опухоль может развиться на несколько лет позже, чем при естественном течении заболевания, но умрут они, в любом случае, от рака желудка. Что касается остальных 98-99 пациентов, то они, фактически, превращаются в «живой термостат-инкубатор» для выращивания огромного количества новых штаммов бактерий, резистентных к новым антибиотикам.
Завершая обсуждение роли H. pylori в патогенезе и лечении H. pylori-ассоциированных заболеваний, можно сделать ряд выводов, которые дают основание усом ниться в достаточной обоснованности и целесообразности стратегии эрадикационной терапии при отмеченных заболеваниях. Если ориентироваться на распространенность H. pylori и ассоциированных с ним заболеваний, ситуацию в целом можно рассматривать как грозную пандемию, охватившую территорию всей планеты. Однако при более близком рассмотрении становится ясно, что сравнение с пандемией носит исключительно формальный характер. Как известно, классическим примером пандемии является «черная смерть», или эпидемия чумы, которая наблюдалась в Европе в XIV веке. Она почти одновременно буйствовала на территории Африки и Евразии. Последствия инфекции были ужасны: Европа опустела, потеряв по некоторым подсчетам до 40% населения, на территории Китая и Индии вымерли несколько сотен городов и деревень, количество мертвых в Африке и вовсе не подлежит подсчету. Таким образом, одной из главных особенностей пандемии является не только высокая распространенность инфекции в популяции, но и исключительно высокий риск смерти при заражении. При этом абсолютное большинство лиц с H. pylo riассоциированными заболеваниями представлено пациентами с хроническим гастритом, которые даже не знают о существовании у них ни гастрита, ни H. pylori. Сам же гастрит представляет угрозу для жизни лишь у 1-2 из 100 человек. С учетом представленных фактов термин пандемия для данной ситуации не подходит.
Следующая особенность состоит в том, что возбудители пандемических заболеваний все без исключения относятся к категории облигатно-патогенных, в то время как H. pylori является условно-патогенным. Важно подчеркнуть, что у выздоровевших после заразных болезней людей иммунная система вырабатывает барьер от определенного возбудителя: стойкий, нестойкий или пожизненный. При этом далеко не у всех переболевших классическим инфекционным заболеванием, вызванным облигатно-патогенным возбудителем, вырабатывается пожизненный иммунитет. Например, к числу болезней, после которых образуется стойкий иммунитет на всю жизнь, относят краснуху, эпидемический паротит, гепатит А, дифтерию, корь, полиомиелит, ветряную оспу. Нестойкий или кратковременный иммунитет формируется после таких заболеваний, как коклюш, гепатит В, грипп, туберкулез, брюшной тиф, дизентерия. К условно-патогенным возбудителям иммунная система относится нейтрально, поэтому нет оснований отрицать, что H. pylori после эрадикации может неоднократно возвращаться к одному и тому же человеку.
Эрадикация облигатно-патогенного возбудителя тож дественна полному выздоровлению инфекционного больного, эрадикация же H. pylori, как показало время, ведет лишь к сокращению сроков рубцевания язвы и к более продолжительной ремиссии, но не к ликвидации самого заболевания. Распространенность рака желудка, как отмечено ранее, не только не снижается, но продолжает расти. С учетом изложенного при остром возникновении или рецидиве гастродуоденальных язв проведение антигеликобактерной терапии следует признать целесообразным. При этом главным критерием эффективности лечения следует считать достижение ремиссии заболевания (купирование клинических проявлений, рубцевание язвы). Однако, поскольку эрадикация не является гарантией предотвращения рецидива заражения H. pylori и не сопровождается ликвидацией «H. рylori-ассоциированных заболеваний», лечебную стратегию, предписывающую обязательно добиваться эрадикации геликобактера, следует считать ошибочной.
 Читайте также:
Читайте также: 
