Чем лечить цистит после лучевой терапии
Статьи
Международные стандарты лечения рака предстательной железы (РПЖ) рекомендуют применение дистанционной лучевой терапии в качестве альтернативы хирургическому методу, который подразумевает радикальное удаление простаты. Современные виды лучевой терапии позволяют максимально ограничить здоровые ткани от неблагоприятного воздействия ионизирующего излучения.
Тем не менее, примерно у половины пациентов, прошедших курс такого лечения, развиваются осложнения, связанные с мочеполовой системой, одним из которых является ноктурия. Данное состояние характеризуется учащением мочеиспускания преимущественно в ночное время, из-за чего нарушается сон, появляется усталость в дневное время, развиваются симптомы депрессии, что в итоге снижает качество жизни. Поэтому ученые поставили задачу выяснить, почему у пациентов с РПЖ после проведения лучевой терапии у развивается ноктурия.
В ходе исследования было установлено, что данное осложнение развивается в результате повреждения защитного слоя слизистой оболочки мочевого пузыря, который образован гликозаминогликанами. В качестве лечения была предложена методика, которая подразумевает восстановление данного слоя при помощи лекарственных препаратов, которые содержат гиалуронат натрия и хондроитин сульфат. Чтобы оценить эффективность такой терапии, было проведено исследование, подробности которого будут описаны ниже.
Выбор группы пациентов
В исследовании принимали участие мужчины с постлучевым циститом и отрицательными посевами мочи после внешней лучевой терапии. Из выборки были исключены те пациенты, у которых в прошлом уже проводилась катетеризация мочевого пузыря, были выявлены инфекции мочеполовых путей, камни мочевого пузыря или другие злокачественные опухоли, помимо рака предстательной железы. У каждого мужчины врачи регистрировали возраст, наличие или отсутствие сопутствующих заболеваний, концентрацию ПСА в крови, сумму баллов по Глиссону и дозу полученного излучения в ходе проведенной лучевой терапии.
Препараты, содержащие гиалуронат натрия и хондроитин сульфат, вводились непосредственно в мочевой пузырь через катетер. Оценка частоты ночного мочеиспускания и наличие симптомов нижних мочевых путей проводилась с помощью специально разработанных и утвержденных опросников. Пациенты были проинформированы о ходе исследования и дали свое письменное согласие на его проведение.
Введение препаратов, содержащих гиалуронат натрия и хондроитин сульфат, и оценка результатов
Препараты применялись в соответствии с инструкцией фирмы-изготовителя. Через три месяца после проведения лучевой терапии выполнялось введение гиалуроната натрия и хондроитин сульфата непосредственно в мочевой пузырь по следующей схеме:
· В первые 4 недели – один раз в неделю.
· Один раз на 6 неделе.
· Один раз на 8 неделе.
· Один раз на 12 неделе.
Препараты предварительно разводились в 50 мл физраствора и вводились через катетер, после чего, минимум через час, мочевой пузырь опорожнялся.
Перед началом исследования и по его завершению пациенты заполняли опросник, который позволял оценить симптомы нарушений мочеиспускания, в том числе и ноктурию. Данный опросник содержал вопросы, которые оценивались баллами. Чем больше баллов, тем более выраженными являются симптомы. После завершения исследования, данные были статистически проанализированы и результаты подтвердили свою достоверность.
Результаты
В исследовании принимало участие 23 пациента, из которых у 18 отмечалась ноктурия, а у 5 данный симптом отсутствовал. После лечения препаратами, содержащими гиалуронат натрия и хондроитин сульфат, было отмечено уменьшение количества ночных посещений туалета, ни один пациент не сообщил об ухудшении. Итоговые результаты отражены в таблице:
Базовая частота ночного мочеиспускания
Лечение лучевого цистита
Причины заболевания
При проведении облучения могут развиться осложнения в виде радиационно-индуцированного фиброза. Это происходит в несколько этапов [41]:
Из-за этих процессов развивается ишемия слизистой, повреждается уротелий, прогрессирует подслизистый фиброз и усиливается боль. Если пациенту наряду с облучением назначают химиотерапию, повышается риск появления лучевых повреждений.
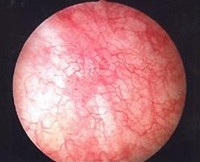
Одним из ведущих методов диагностики, который используется перед назначением лечения лучевого цистита у женщин, является цистоскопия, она позволяет установить степень повреждения и его локализацию. С ее помощью врачи могут определить наличие органических изменений в слизистой, присутствие камней.
Лучевой цистит у женщин: симптомы и лечение
Лучевые циститы делятся на ранние (развиваются в период 3-12 месяцев после облучения) или поздние (проявляются через 1-10 лет после окончания лечения).
В первом случае проявляются следующие симптомы [41]:
Во втором случае возможны следующие признаки [41]:
При лучевом цистите самостоятельное лечение лекарственными препаратами крайне не рекомендуется. Необходимо обратиться к врачу, который проведет диагностику и назначит терапию.
Как лечить лучевой цистит?
Лечить повреждения мочевого пузыря из-за облучения сложно, так как выражено угнетение способности тканей к репарации и регенерации. Также присутствует дисфункция уротелия (эпителия мочевого пузыря), вторичная инфекция, снижена сопротивляемость организма. В первую очередь врачи назначают терапию, нацеленную на восстановление функций уротелия и уменьшения симптомов со стороны нижних мочевых путей. [41]
В каких случаях лечение цистита у женщин можно проводить фитопрепаратами?
Фитопрепараты, как правило, могут применяться в комплексном лечении бактериального цистита [7]. Их назначают наряду с антибиотиками [7]. Одним из лекарственных средств, которые могут применяться, является паста Фитолизин® [7]. Этот препарат для лечения цистита содержит 9 экстрактов лекарственных растений и 4 эфирных масла п применяется в комплексной терапии [6]. На основе пасты необходимо приготовить суспензию, из которой, согласно исследованиям, активные компоненты всасываются и доставляются в очаг воспаления быстрее, чем из таблеток [6, 2]. Паста Фитолизин® оказывает диуретическое, противовоспалительное, спазмолитическое действия [6].
Для врачей
Известно, что в последнее время злокачественные новообразования органов малого таза стали встречаться значительно чаще, причем возраст онкологических больных снизился. Пациенты, страдающие злокачественными новообразованиями шейки матки, мочевого пузыря, прямой кишки, предстательной железы, нередко подвергаются лучевой и / или химиотерапии.
Хорошо известным осложнением лучевой терапии является лучевой геморрагический цистит, представляющий собой реакцию эпителия мочевого пузыря и уретры на облучение [1].
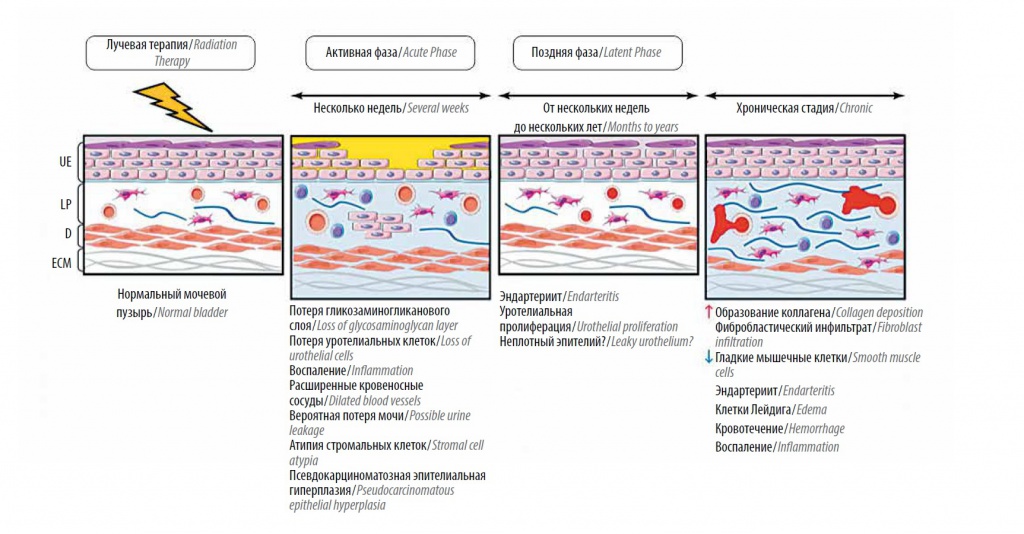
При лучевом цистите микроскопически определяется первичный дефект защитного гликозаминогликанового (ГАГ) слоя уротелия [2]. В норме ГАГ-слой представляет собой защитный барьер, предохраняющий уротелий от повреждения вследствие воздействия микроорганизмов, токсичных компонентов мочи и нервные окончания в lamina propria – от деполяризации из‑за контакта с ионами калия.
Таким образом, разрушение ГАГ-слоя вследствие радиации приводит к воздействию на уротелий агрессивных компонентов мочи, а также ионов калия, что в свою очередь ведет к возникновению симптомов, характерных для лучевого цистита, подобно интерстициальному [3].
Разрушение ГАГ-слоя уротелия при лучевом цистите подтверждается патоморфологически. Кроме того, определяется прогрессирующая облитерация кровеносных сосудов, приводящая к ишемии уротелия.
Следствие данного процесса – возникновение язвенных дефектов слизистой оболочки мочевого пузыря. В качестве ответа на гипоксию в пораженных участках индуцируется неоангиогенез, однако новые артериолы и капилляры более хрупкие, и при наполнении мочевого пузыря возникают геморрагические явления, которые проявляются подслизистыми кровоизлияниями и микро- или макрогематурией [4] (рис. 1).
Рис. 1. Патогенез лучевого цистита
0. Отсутствие изменений.
1. Слабо выраженная атрофия эпителия, незначительные телеангиэктазии, микрогематурия.
2. Выраженная поллакиурия, генерализованные телеангиэктазии, интермиттирующая макрогематурия.
3. Резко выраженная поллакиурия и дизурия, значительные генерализованные телеангиэктазии, часто с петехиальными кровоизлияниями, частая
макрогематурия, снижение емкости мочевого пузыря Принять
Лучевой цистит
Лучевой цистит – это реакция тканей мочевого пузыря на ионизирующее облучение, проводимое в рамках лечения злокачественных опухолей малого таза. Симптомы зависят от полученной лучевой нагрузки, варьируются от незначительного дискомфорта при мочеиспускании, частых позывов и микрогематурии до выраженных болей, появления рецидивирующего кровотечения, угрожающего жизни. Диагноз подтверждают с помощью общего анализа мочи, цистоскопии. Лечение пострадиационного цистита определяется степенью выраженности поражения, может быть консервативным или оперативным с выполнением цистэктомии, решением вопроса с отведением мочи.
МКБ-10
Общие сведения
Лучевой цистит регистрируют у 5-21% пациентов как осложнение лучевой терапии. Наиболее часто симптомы появляются после лечения рака мочевого пузыря (18%), простаты (14%), шейки матки (5%). Патология развивается в среднем через 32 недели после лечения, у мужчин чаще, чем у женщин (2,8:1). Конформная лучевая терапия, брахитерапия сопряжены с меньшей вероятностью возникновения пострадиационного цистита по сравнению с обычной. Но даже при таком лечении случайное облучение близлежащих тканей неизбежно из-за проникновения новообразования в окружающие органы или из-за близости рака к соседним структурам таза.
Причины
Во время лучевой терапии происходит передача энергии ионизирующего излучения молекулам опухолевых клеток и тканям соседних органов, в частности – мочевому пузырю, прямой кишке. В результате альтерации нарушается трофика, кровоснабжение, позднее развиваются фиброзно-склерозирующие изменения. Пострадиационный цистит вызывает прохождение лучевой терапии по поводу опухолей:
Определенное значение имеют локализация новообразования, стадия болезни, ежедневная и суммарная доза облучения (количество сеансов), тип лучевой терапии. К способствующим циститу факторам относятся:
Патогенез
Радиация взаимодействует с внутриклеточной жидкостью, в результате высвобождаются свободные радикалы, нарушающие синтез ДНК, что приводит к гибели клеток. На фоне терапии повреждаются мембраны как раковых, так и здоровых клеток, изменения затрагивают сосуды. Субэндотелиальная пролиферация, отек постепенно истощают кровоснабжение облученной зоны. Неоваскуляризация, неадекватная регенерация провоцируют формирование хрупких поверхностных сосудов, ответственных за макрогематурию при геморрагическом цистите.
Отложение коллагена запускает процессы рубцевания, способствует дальнейшей облитерации кровеносных сосудов, вследствие чего развивается гипоксия, некроз. В мочевом пузыре на фоне ишемии слизистой оболочки повреждается уротелий, что вызывает подслизистый фиброз, поскольку субэпителиальные ткани подвергаются едкому воздействию мочи. Образование язв, поражение нервов, пострадиационный фиброз обеспечивают появление развернутой клинической симптоматики.
Классификация
Лучевой цистит может быть ранним, возникающим в течение 4 недель или 6-12 месяцев после терапии, и поздним, с появлением симптомов спустя год или позже. Выделяют острое и хроническое течение пострадиационного воспаления. Специалисты в сфере онкоурологии используют в работе специальную шкалу для оценки степени выраженности изменений мочевого пузыря, подвергшегося лучевому воздействию:
Симптомы лучевого цистита
Сразу или через несколько недель после одномоментного получения значительной дозы радиации развивается острый воспалительный процесс. Как правило, ранний цистит является самоограниченным, симптомы аналогичны острому инфекционному воспалению, включают рези при учащенном мочеиспускании и после, боли внизу живота, ургентные позывы на мочевыделение. Может присутствовать кровь в моче, но более типична микрогематурия. Отмечается хороший ответ на терапию.
Лучевой цистит, возникший спустя несколько месяцев либо лет после лечения, может проявляться постоянной дизурией, сильной болью, позывами к мочеиспусканию через каждые 10-15 минут из-за формирования микроциста, выделением урины с кровью, стойкой инконтиненцией. Макрогематурия приобретает рецидивирующий характер, обнаруживается значительная кровопотеря. Повышение температуры свидетельствует о вторичном бактериальном инфицировании.
Осложнения
Лучевой цистит осложняется присоединением инфекции с развитием бактериального воспалительного процесса в почках (пиелонефрит в 20%), прогрессирующим уменьшением емкости или рубцовым сморщиванием органа и неоплазией (менее 2%), образованием свища (2%), контрактуры шейки (3-5%). При выраженном пострадиационном воспалении возникает некупируемый хронический болевой синдром, значительно ухудшающий качество жизни.
Кровотечению из видоизмененных сосудов (геморрагический цистит в 3-5%) нередко сопутствует анемия, иногда частота и выраженность кровотечения настолько значительна, что требуется проведение цистэктомии, поскольку неоднократные коагуляции лишь усугубляют фиброзно-склеротический процесс. Гематурия может сопровождаться образованием сгустков, которые приводят к острой задержке мочеиспускания за счет гемотампонады уретры.
Диагностика
Прохождение лечения с использованием ионизирующего облучения с отсроченным появлением типичных жалоб – основной критерий, на основании которого врач-уролог выставляет предварительный диагноз лучевого цистита. Учитывая то, что данные симптомы могут свидетельствовать о ряде других патологических процессов, показано прохождение углубленного клинико-урологического обследования, которое включает:
Дифференциацию осуществляют между уроцистолитиазом, распространением опухоли из малого таза в пузырь, прогрессированием рака, сопровождающегося кровотечением, болевым синдромом. КТ и МРТ становятся основными диагностическими процедурами в данной клинической ситуации.
Лечение лучевого цистита
Терапевтические мероприятия зависят от выраженности процесса, в каждом случае определяются индивидуально. Первая и вторая степени цистита после облучения требуют активной тактики только при наличии жалоб. Цистэктомия рассматривается как крайний вариант для лечения постлучевого цистита, выполняется при безуспешности консервативной терапии.
Медикаментозное лечение
Радиационно-индуцированная гематурия может быть легкой или опасной для жизни, во втором случае прибегают к реанимационным мероприятиям, переливанию компонентов крови. Перечень препаратов для лечения включает:
Инстилляции в мочевой пузырь
Вливание растворов – следующий этап лечения при неэффективности пероральной терапии лучевого цистита и налаженной системы орошения. Используют следующие препараты:
Хирургическое лечение
Если консервативная терапия и внутрипузырные инстилляции не могут остановить кровотечение, прибегают к различным эндоскопическим или чрескожным вмешательствам. Цистоскопия с фульгурацией проблемных участков, эвакуация кровяного сгустка, выполнение электрокоагуляции являются разумными шагами в дальнейшей тактике. Виды вмешательств при лучевом цистите:
Физиотерапия
Гипербарическая кислородная терапия (оксигенация) способствует нормализации ангиогенеза, мобилизации стволовых клеток, остановке кровотечения за счет активации процессов фибринолиза, разрешению ишемии. Используется как дополнительный способ лечения лучевого цистита. Проведение оксигенобаротерапии не имеет каких-либо неблагоприятных последствий.
Прогноз и профилактика
Лучевой цистит, развившийся через 4-6 недель от начала сеансов ЛТ, имеет более благоприятный прогноз. Улучшение наступает примерно через 1,5 месяца, но у 5-20% процесс переходит в стойкую форму с рецидивирующими клиническими проявлениями через несколько месяцев или даже 10-20 лет. Хронические формы менее благоприятны.
Профилактика подразумевает выбор типа лучевой терапии с максимальным воздействием на опухоль, но не на соседние ткани, выполнение инстилляций на основе гиалуроновой кислоты с превентивной целью, прием растительных диуретиков. Исследования показали уменьшение симптомов цистита при использовании добавок, содержащих клюквенный экстракт.
Лечение поздних лучевых повреждений мочевого пузыря
В настоящее время лучевая терапия является одним из основных методов лечения злокачественных новообразований органов малого таза. При отсутствии метастазов в регионарные лимфоузлы применение лучевой терапии позволяет добиться полной или частичной регрессии опухоли (рак тела и шейки матки, рак предстательной железы, в меньшей степени рак мочевого пузыря и прямой кишки) в среднем в 70–75% случаев. При этом продолжительность жизни после окончания курса лечебных мероприятий остается относительно высокой и составляет около четырех-пяти лет [1–3].
К сожалению, у части таких больных (10–15%) формируются лучевые повреждения органов малого таза: мочевого пузыря, прямой кишки и внутритазовой клетчатки [4, 5]. Оценивая данные литературы, можно констатировать неудовлетворительные результаты диагностики и лечения лучевых повреждений органов малого таза. Это выражается в частых рецидивах цистита с исходом в сморщивание мочевого пузыря, внутритазовом лучевом фиброзе со сдавлением интрамурального и юкставезикального отделов мочеточников и развитии хронической почечной недостаточности [7–8].
Проведение лучевой терапии может осложниться развитием радиационно-индуцированного фиброза, выраженность которого прямо пропорциональна величине суммарной поглощенной дозы, режиму фракционирования и времени после проведения лучевой терапии. Микроскопическое исследование тканей с радиационно-индуцированным фиброзом показало, что его формирование сопровождается развитием каркаса в подслизистом слое стенки мочевого пузыря, в сетях которого фиксируются стенки мелких артерий и вен. Происходит лучевое повреждение и самой сосудистой стенки, особенно ее адвентиции, что приводит к потере сосудами эластичности и появлению ломкости. Клинически это обнаруживается различной степенью гематурии, вплоть до профузного кровотечения. Развитие в последующем лучевого фиброза всей стенки мочевого пузыря значительно отягощает клинические симптомы и выраженность лучевого цистита [9–11].
В диагностике лучевых циститов важное значение имеют общеклинические, рентгенологические и инструментальные методы исследования. Ведущим методом исследования мочевого пузыря остается цистоскопия, позволяющая достоверно установить локализацию и степень выраженности лучевого повреждения, то есть выявить органические изменения слизистой оболочки, наличие камней и видимых опухолевых элементов, оценить состояние устьев мочеточников.
В настоящей работе проведено исследование эффективности новых методов местного лечения осложненных и неосложненных лучевых циститов. 139 больных были разделены на три группы. Первую группу составили 49 пациентов (17 с неосложненными циститами и 32 – с осложненными). Они получали традиционное местное лечение: Димексид, Колларгол, синтезоновая эмульсия и облепиховое масло. Во вторую группу вошли 52 больных (26 с неосложненными циститами и 26 – с осложненными), у которых для местного лечения использовался препарат УРО-ГИАЛ. В местной терапии третьей группы – 38 пациентов (13 с неосложненными циститами и 25 – с осложненными) – применялась супероксиддисмутаза (препарат Рексод). Кроме того, всем пациентам была назначена антибактериальная, антикоагулянтная, вазоактивная, симптоматическая и иммунная терапия.
Местное лечение больных первой группы начиналось с инстилляций 10%-ного Димексида в объеме 20 мл. Применение этого препарата патогенетически обосновано, поскольку он обладает выраженным противовоспалительным, противоотечным и обезболивающим эффектом. В связи с тем что Димексид является органическим растворителем и легко проникает в ткани, в раствор добавлялись антибиотики (гентамицин, амикацин), фибролизирующие (Лидаза) и противовоспалительные препараты (преднизолон). Инстилляции проводились ежедневно по 20 мл (от 10 до 15 процедур). У больных с микрогематурией или неинтенсивной примесью крови в моче для инстилляций мочевого пузыря дополнительно применялся 3%-ный Колларгол 20 мл на одно введение. При неэффективности монотерапии Колларголом для усиления гемостатического эффекта его чередовали с охлажденной аминокапроновой кислотой. После стихания воспалительных процессов внутрипузырно в подогретом виде один раз в сутки в течение 10–15 дней вводились синтезоновая эмульсия и облепиховое масло. Действие этих препаратов направлено на усиление репараторных процессов в стенке мочевого пузыря. Благодаря жировой основе они оказывают выраженное обволакивающее и обезболивающее действие.
Местное лечение больных второй группы подразумевало применение препарата на основе гиалуроновой кислоты УРО-ГИАЛ. УРО-ГИАЛ – вязкоэластичный протектор межклеточного вещества уротелия мочевого пузыря и уретры. УРО-ГИАЛ позволяет создать вязкоэластичную пленку на слизистой, тем самым защищая ее от агрессивного воздействия мочи и препятствуя адгезии микробов к поврежденной поверхности. Инстилляции УРО-ГИАЛА проводились через день в течение 12–15 дней, затем в режиме одно введение в неделю.
В третьей группе пациентам назначался препарат супероксиддисмутазы Рексод. Рексод прямо инактивирует свободные радикалы, блокирует реакцию перекисных радикалов с арахидоновой кислотой, ослабляет активное действие лейкотриена В4, ингибирует хемотаксис лейкоцитов, значительно уменьшает синтез коллагена фибробластами (способствует регрессии радиационно-индуцированного фиброза). Рексод вводился внутрь мочевого пузыря, при этом содержимое флакона растворяли непосредственно перед введением в 10 мл стерильного физиологического раствора. Инстилляции проводились один раз в сутки на протяжении 15–20 дней.
Результаты и обсуждение
Результаты лечения больных первой группы представлены в таблице 1. Приведенные данные свидетельствуют о значительном уменьшении частоты ночного мочеиспускания и снижении бактериурии у большинства больных как с осложненными, так и с неосложненными циститами. Несмотря на по-прежнему высокий уровень лейкоцитурии, она носила менее выраженный характер. Макрогематурия после лечения не выявлялась у пациентов с неосложненными циститами, но сохранялась у 18% пациентов с осложненными циститами.
Сравнительный анализ УЗИ-признаков лучевых циститов у больных первой группы продемонстрировал, что внутрипузырное применение Димексида позволило очистить мочевой пузырь от солевой инкрустации более чем в 50% случаев. К сожалению, основные УЗИ-признаки воспаления (взвесь в просвете мочевого пузыря и утолщение его стенок) были купированы у незначительного числа пациентов.
Динамика выраженности цистоскопических признаков лучевых циститов у больных первой группы до и после лечения продемонстрирована в таблице 2. У пациентов как с неосложненными, так и осложненными циститами сохранялись воспаление (гиперемия и отек) и телеангиоэктазии. Таким образом, внутрипузырное применение Димексида было наиболее эффективным у пациентов с выраженным болевым синдромом и инкрустированной формой лучевого цистита.
Результаты лечения больных второй группы представлены в таблице 3. Следует отметить выраженное противовоспалительное действие УРО-ГИАЛА. Так, частота ночного мочеиспускания сократилась в два раза более чем у 56% пациентов с неосложненными циститами и у 59% с осложненными циститами. Лейкоцитурия уменьшилась в два раза у больных с осложненными циститами и практически не выявлялась у пациентов с неосложненными циститами (12%), а бактериурия сохранилась только у 27 и 25% больных в обеих подгруппах соответственно.
Основные УЗИ-признаки воспаления (взвесь в просвете мочевого пузыря и утолщение его стенок) исчезли у подавляющего числа больных. Однако УРО-ГИАЛ практически не оказал действия на инкрустированные циститы, особенно у больных со сниженным объемом мочевого пузыря.
Характеристика цистоскопических признаков лучевых циститов у больных второй группы до и после лечения продемонстрирована в таблице 4. Гиперемия и отек беспокоили менее чем 25% больных как с неосложненной, так и осложненной формой цистита. Частота эрозии у пациентов с неосложненными циститами уменьшилась в четыре раза. Однако более чем у 70% пациентов сохранились телеангиоэктазии. Язва мочевого пузыря у больных с осложненными циститами уменьшилась в размерах и очистилась от фибрина.
Можно сделать вывод, что применяемая схема лечения – инстилляции УРО-ГИАЛА – наиболее эффективна у пациентов с выраженным воспалительным процессом и болевым синдромом, связанным с воспалением стенок мочевого пузыря, и может применяться у больных с любой формой лучевого цистита, осложненного бактериальной инфекцией.
Результаты лечения больных третьей группы представлены в таблице 5. Почти у половины больных с неосложненными и осложненными циститами в два раза уменьшилась частота ночного мочеиспускания. У 75 и 90% пациентов соответственно сохранилась лейкоцитурия. Однако бактериурия почти у половины больных в обеих подгруппах не определялась, а макрогематурия исчезла у всех пациентов.
Сравнительная характеристика УЗИ-признаков лучевых циститов у больных третьей группы продемонстрировала достоверное увеличение объема мочевого пузыря у пациентов с микроцистисом, однако в меньшей степени Рексод оказал положительное действие на инкрустацию стенок мочевого пузыря и наличие взвеси в его просвете.
Что касается выраженности цистоскопических признаков лучевых циститов у больных третьей группы (табл. 6), то в результате лечения язва мочевого пузыря исчезла у всех больных, однако более чем у 60% пациентов с осложненными циститами сохранялись признаки воспаления (гиперемия и отек). Таким образом, Рексод можно рекомендовать больным с геморрагическим синдромом, при язвенном лучевом цистите и сниженном объеме мочевого пузыря.
Следует отметить, что используемые препараты (Димексид, УРО-ГИАЛ и Рексод) имеют разную направленность действия. В частности, при выраженном фиброзе стенки мочевого пузыря предпочтение следует отдавать применению инстилляций раствора Димексида. При выраженном воспалительном процессе, сопровождающемся поверхностным нарушением слизистой мочевого пузыря, а также атрофии слизистой наиболее эффективным оказалось применение УРО-ГИАЛА. У больных с гематурией и глубокими нарушениями целостности слизистой мочевого пузыря (язвенно-некротический цистит) наиболее высокие результаты продемонстрировало применение супероксиддисмутазы. Выбор метода лечения должен основываться на данных субъективных жалоб и объективных методов исследования.