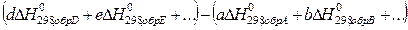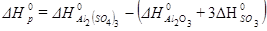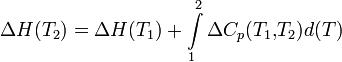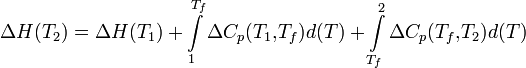Чем меньше энтальпия образования тем устойчивее соединение
Энтальпия образования химических соединений
Для расчетов тепловых эффектов используют величину, называемую энтальпией.
Энтальпией (теплотой) образования химического соединения ∆ HT называется изменение энтальпии в процессе получения 1 моля этого соединения из простых веществ (элементов) при постоянном давлении.
Так, например, энтальпией образования этилового спирта C2H5OH называется изменение энтальпии при реакции углерода, кислорода и водорода при постоянном давлении
И наоборот, реакции
не являются реакциями ”образования” спирта, хотя и приводят к синтезу этилового спирта.
Важным термодинамическим представлением является понятие о стандартном состоянии вещества, под которым понимается его реальное состояние при 298 К и атмосферном давлении (или p = 101 кПа).
Стандартной энтальпией (теплотой) образования химического соединения 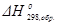
Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения. Если стандартная энтальпия образования отрицательна, то соединение более устойчиво, чем элементы, из которых оно состоит, или наоборот, если она положительна, то соединение менее устойчиво. Из различных молекул более устойчивы те, энтальпии, образования которых меньше.
Термохимические расчеты. Значения энтальпий образования позволяет определить изменения энтальпии, сопровождающие реакции, не прибегая к прямым измерениям.
В основе большинства термохимических расчетов лежит следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ.
Так, для уравнения вида
Тепловой эффект ∆ H определяется равенством
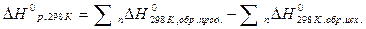
При этом следует иметь в виду, что при алгебраическом суммировании следует учитывать стехиометрические коэффициенты в уравнении реакции (а, в, d, e).
Приведенное уравнение позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
В настоящее время энтальпии образования известны примерно для четырех тысяч веществ, и это позволяет расчётным путем установить тепловые эффекты самых разнообразных реакций.
Пример 1. Расчет теплового эффекта реакции по стандартным энтальпиям образования веществ.
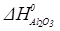
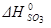
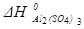
Тепловой эффект реакции 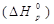
После подстановки значений стандартных энтальпий
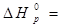
Видно, что 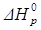
Дата добавления: 2016-12-09 ; просмотров: 6920 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
Энтальпия образования
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции – отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Содержание
Стандартная энтальпия образования (стандартная теплота образования)
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв) 0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж) 0 = 22 кДж/моль. Энтальпии образования простых веществ при стандатных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиемя выделением тепла в окружащию среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Температурная зависимость теплового эффекта (энтальпии) реакции
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):
Если в данном интервале температур происходят фазовые превращения, то при расчете необходимо учесть теплоты соответствующих превращений, а так же изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:
Стандартная энтальпия сгорания
Стандартная энтальпия растворения
Стандартная энтальпия нейтрализации
Стандартная энтальпия нейтрализации – ΔHнейтр о энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях:
Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствии измения значения ΔHгидратации° ионов при разбавлении.
Чем меньше энтальпия образования тем устойчивее соединение
Энтальпией (теплотой) образования химического соединения 
Важным термодинамическим представлением является понятие о стандартном состоянии вещества. Стандартным состоянием вещества, находящегося в конденсированной фазе (твердой или жидкой), называется его реальное состояние при данной температуре и давлении 101 кПа.
Стандартным состоянием газообразного вещества при данной температуре является состояние газа, давление которого 101 кПа, при условии, что газ обладает свойствами, присущими ему при той же температуре и бесконечно малом давлении.
Стандартным состоянием растворенного вещества при данной температуре будет его состояние, отвечающее концентрации 
он имел бы при той же температуре и бесконечно большом разбавлении. В стандартном состоянии вещество может быть при любой температуре.
Стандартной энтальпией (теплотой) образования химического соединения 
Таблица IV.1. Стандартные энтальпии образования некоторых простых веществ и соединений при 298,16 К
Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях. Так, например, нулю равны стандартные теплоты образования жидкого брома (а не газообразного) и графита (а не алмаза). Стандартная энтальпия образования соединения — мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения. Эта термодинамическая функция характеризуется периодичностью и может быть ориентировочно оценена для какого-либо соединения так же, как и любое другое свойство. На рис. IV. 1 представлена взаимосвязь между стандартными
Рис. IV. 1. Взаимосвязь между стандартными энтальпиями образования оксидов и сульфидов элементов подгруппы цннка при 298 К
энтальпиями образования оксидов и сульфидов элементов подгруппы цинка при 298 К. Прямая на рис. IV.I четко указывает на закономерное изменение стандартных энтальпий образования оксидов и сульфидов в ряду
Термохимические расчеты.
В основе большинства термохимических расчетов лежит следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ.
Используя при термохимических расчетах следствие из закона Гесса, надо иметь в виду, что при алгебраическом суммировании следует учитывать стехиометрические коэффициенты в уравнении реакции. Так, для уравнения реакции 

Уравнение (IV. 12) позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
Пример. I. Рассчитайте стандартный тепловой эффект реакции 
Решение. На основании следствия из закона Гесса (IV. 12) можно записать
Подставив значения стандартных энтальпий образования веществ с учетом их агрегатных состояний, получим для 1 моль
Следовательно, термохимическое уравнение реакции имеет вид
Пример 2. Стандартный тепловой эффект реакции 

Решение. На основании следствия из закона Гесса (IV. 12) для рассматриваемой реакции имеем
Подставив в это выражение значения 
Тепловой эффект химической реакции является энергетическим эффектом процесса, протекающего при постоянной температуре. Пользуясь справочными данными, которые относятся к
298 К, можно рассчитать тепловые эффекты реакций, протекающих при этой температуре.
Энтальпия есть возрастающая функция температуры, непрерывная во всей области изменения последней, когда существует данная фаза. Зависимость теплот химических реакций от температуры была изучена Кирхгофом. Если известен стандартный тепловой эффект реакции, то 
где 


Расчеты по уравнению Кирхгофа показывают, что в том интервале температур, который может иметь практическое значение, изменение величины теплового эффекта реакции невелико. Так, например, тепловой эффект реакции Си 

Тепловой эффект процесса 



Энтальпия образования химических соединений.
Энтальпией (теплотой) образования химического соединения DНТ называется изменение энтальпии в процессе получения одного моля этого соединения из простых веществ, устойчивых при данной температуре.
Стандартной энтальпией (теплотой) образования химического соединения DН 
Стандартные энтальпии образования простых веществ принимаются равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях. Так, например, нулю равны стандартная теплота образования жидкого брома (а не газообразного) и графита (а не алмаза).
Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения.
Термохимические расчеты.В основе большинства термохимических расчетов лежит следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ с учетом их стехиометрических коэффициентов в уравнении реакции.
Уравнение (9) позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
Тепловой эффект химической реакции является энергетическим эффектом процесса, протекающего при постоянной температуре. Пользуясь справочными данными, которые относятся к 298 К, можно рассчитать тепловые эффекты реакций, протекающих при этой температуре. Однако при выполнении термохимических расчетов, допуская обычно незначительную ошибку, можно пользоваться стандартными значениями теплот образования даже тогда, когда условия протекания процесса отличаются от стандартных.
Тепловые эффекты фазовых превращений.Фазовые превращения часто сопутствуют химическим реакциям. Однако тепловые эффекты фазовых превращений, как правило, меньше тепловых эффектов химических реакций. Ниже приведены примеры термохимических уравнений некоторых фазовых превращений:
Н2О(ж) ® Н2О(г), DH 
Н2О(к) ® Н2О(ж), DH 
I2(к) ® I2(г), DH 
Исходя из выше приведенных данных можно отметить, что фазовый переход из более в менее конденсированное состояние ведет к повышению энтальпии системы (тепло поглощается – процесс эндотермический).
Т 

Переход вещества из аморфного состояния в кристаллическое всегда сопровождается выделением теплоты (DH
Самопроизвольный процесс не может протекать в обратном направлении так же самопроизвольно, как в прямом. Так, вода не может сама по себе перетекать вверх по наклонному желобу, а теплота не может сама по себе переходить от холодного тела к горячему. Чтобы перекачать воду наверх или передать теплоту от холодной части системы к горячей, необходимо совершить работу над системой. К процессам, обратным по отношению к самопроизвольным, применяется термин «несамопроизвольные».
При изучении химических взаимодействий очень важно оценить возможность или невозможность их самопроизвольного протекания при заданных условиях, выяснить химическое сродство веществ. Должен быть критерий, с помощью которого можно было бы установить принципиальную осуществимость, направление и пределы самопроизвольного течения реакции при тех или иных температурах и давлениях. Первый закон термодинамики такого критерия не дает. Тепловой эффект реакции не определяет направления процесса: самопроизвольно могут протекать как экзотермические, так и эндотермические реакции.
Критерий самопроизвольного протекания процесса в изолированных системах дает второй закон термодинамики. Прежде чем перейти к рассмотрению этого закона, введем представление о термодинамической функции состояния системы, называемой энтропией.
Энтропия.Для характеристики состояния некоторого количества вещества, являющегося совокупностью очень большого числа молекул, можно или указать температуру, давление и другие термодинамические параметры состояния системы, или указать мгновенные координаты каждой молекулы (xi, yi, zi) и скорости перемещения по всем трем направлениям (vxi,vyi,vzi). В первом случае охарактеризовывается макросостояние системы, во втором – микросостояние. Каждому макросостоянию отвечает огромное число микросостояний. Число микросостояний, с помощью которых осуществляется данное макросостояние, называют термодинамической вероятностью состояния системы и обозначают W.
Термодинамическая вероятность состояния системы, состоящей всего из 10 молекул газа, примерно 1000, а ведь только в 1 см 3 газа содержится 2,7×10 19 молекул (н. у.). Чтобы перейти к более удобным для восприятия и расчетов числам, в термодинамике используют не величину W, а ее логарифм lnW. Последнему можно придать размерность (Дж/К), умножив на константу Больцмана k:
Величину S называют энтропией системы.
Энтропия – термодинамическая функция состояния системы и ее величина зависит от количества рассматриваемого вещества. Поэтому целесообразно относить величину энтропии к одному молю вещества (Дж/(моль×К)) и выражать как
где R = kNA – молярная газовая постоянная;
Из уравнения (11) следует, что энтропия системы увеличивается пропорционально логарифму термодинамической вероятности состояния W. Это соотношение лежит в основе современной статистической термодинамики.
При р = const энтропия является функцией температуры Т, причем температура замерзания и температура кипения – это те точки, в которых энтропия изменяется особенно резко, скачкообразно.
Итак, энтропия S является мерой неупорядоченности системы. «Носителями» энтропии являются газы. Если при реакции увеличивается число молей газообразных веществ, то увеличивается и энтропия. Т.е. не производя расчетов можно при необходимости определить знак изменения энтропии системы:
Рассмотренное положение представляет одну из формулировок второго закона термодинамики (закон имеет статистический характер, т. е. применим лишь к системам, состоящим из очень большого числа частиц). Требование постоянства внутренней энергии и объема системы исключает использование энтропии как критерия направления и предела протекания химических реакций, при которых внутренняя энергия веществ неизбежно меняется, а также совершается работа расширения против внешнего давления.
Энтропийный и энтальпийный факторы химических реакций, протекающих в изобарно-изотермических условиях.Движущей силой процесса, протекающего в изобарно-изотермических условиях, может быть или стремление системы перейти в состояние с наименьшей энергией, т. е. выделить теплоту в окружающую среду, уменьшить энтальпию (DH 0). Если процесс протекает так, что DH=0, то рост энтропии становится его единственной движущей силой. И, наоборот, при условии DS = 0 единственной движущей силой процесса является убыль энтальпии. В связи с этим можно говорить об энтальпийном DH и энтропийном TDS факторах процесса.
Максимальная работа.Голландский физико-химик Вант-Гофф предложил новую теорию химического сродства, которая, не объясняя природы химического сродства, ограничивается указанием способа его измерения, т. е. дает количественную оценку химическому сродству.
Вант-Гофф использует в качестве меры химического сродства максимальную работу А 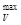

Максимальная работа равна энергии, которую нужно приложить к системе, чтобы остановить реакцию, т. е. преодолеть, силы химического сродства. Поскольку реакция протекает в направлении совершения положительной максимальной работы, знак А 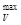

Максимальная работа при постоянном объеме равна
где U1, S1 и U2, S2 – величина внутренней энергии и энтропии системы в исходном и конечном состояниях соответственно.
Дата добавления: 2015-04-16 ; просмотров: 44 ; Нарушение авторских прав