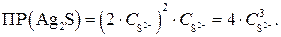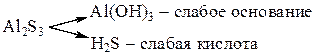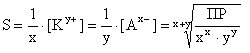Чем меньше произведение растворимости тем быстрее выпадает осадок
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ. ОБРАЗОВАНИЕ ОСАДКОВ
Различают вещества растворимые и малорастворимые. К малорастворимым в воде относятся вещества, растворимость которых не превышает 10 –2 моль/л.
Применение закона действующих масс к гетерогенной системе – насыщенному раствору малорастворимого электролита, находящегося в равновесии со своим осадком дает выражение константы равновесия, которая и называется произведением растворимости (ПР):

Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций его ионов в степенях, соответствующих стехиометрическимкоэффициентам при данных ионах, при данной температуре, – величина постоянная. Произведение растворимости малорастворимого электролита (ПР), как всякая константа равновесия, зависит только от природы электролита и температуры.
Зная ПР малорастворимого электролита, можно вычислить его растворимость S (моль/л, г/л или г/100 мл раствора).
Произведение растворимости характеризует сравнительную растворимость однотипных веществ: чем больше ПР данного вещества, тем больше его растворимость.
Если произведение концентраций ионов в растворе 
Растворимость малорастворимого электролита уменьшается, если его раствор содержит хорошо растворимый электролит, имеющий одноименный ион, согласно принципу Ле-Шателье. Исключение составляют случаи образования комплексных соединений.
Пример 1.Рассчитайте концентрацию ионов серебра и сульфид-ионов в насыщенном растворе сульфида серебра. 
Решение. В насыщенном растворе 


Выражаем концентрацию ионов S 2– :

тогда
Пример 2.Растворимость сульфата кальция при 25 о С равна 0,955 г/л. Определите величину
Решение. Записываем уравнение равновесия, устанавливающегося в растворе CaSO4:
тогда 
Из уравнения диссоциации видно, что

Выразим растворимость соли в молях на литр:

где M(CaSO4) – молярная масса CaSO4, г/моль.
Тогда 
Пример 3.Будет ли выпадать осадок при смешивании равных объемов раствора нитрата серебра, молярная концентрация которого составляет 0,01 моль/л (0,01 M), и раствора хромата калия, молярная концентрация эквивалента которого равна 0,02 моль/л (0,02 н.)? 
Решение. При сливании растворов нитрата серебра и хромата калия в осадок может выпасть труднорастворимый хромат серебра:

В ионно-молекулярной форме:
Условие образования осадка следующее
Чтобы рассчитать ПС, надо найти концентрации ионов серебра и хромат-ионов в растворе при смешивании. Но сначала вычисляем молярные концентрации интересующих нас ионов в исходных растворах.
Ионы серебра в растворе появляются при электролитической диссоциации AgNO3:
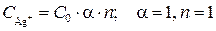
тогда 
Хромат-ионы появляются в растворе при электролитической диссоциации K2CrO4:

тогда 
При сливании растворов объем раствора увеличивается, при этом концентрация каждого вещества уменьшается во столько раз, во сколько раз увеличится объем раствора. В данном случае при сливании равных объемов растворов объем общего раствора увеличивается в 2 раза, т. е. концентрация каждого раствора и соответственно концентрации ионов, участвующих в образовании хромата серебра, уменьшаются в 2 раза.
При смешивании растворов



Находим произведение концентраций ионов:

ГИДРОЛИЗ СОЛЕЙ
Обменное взаимодействие соли с водой, приводящее к образованию слабого электролита, называетсягидролизом солей.
Гидролизу подвергаются растворимые соли, образованные:
– слабой кислотой и сильным основанием;
– слабым основанием и сильной кислотой;
– слабым основанием и слабой кислотой.
В водных растворах солей, образованных сильными основаниями и сильными кислотами, таких как NaCl, K2SO4, Ba(NO3)2 и др., происходит только распад соли на ионы, которые не образуют с ионами H + и OH – воды малодиссоциированныхчастиц, поэтому эти соли не подвергаются гидролизу, и, следовательно, pH растворов имеет ту же величину, что и pH воды.
В гидролизе участвуют катионы слабого основания и анионы слабой кислоты, в большинстве случаев гидролиз – процесс обратимый, протекает ступенчато. Гидролиз приводит к изменению pH среды. Уравнения реакций гидролиза составляют в молекулярной и ионно-молекулярной формах. Ниже приводятся примеры гидролиза солей.
Пример 1.Рассмотрим гидролиз раствора цианида калия. Соль KCN образована сильным основанием KOH и слабой кислотой HCN. В растворе соль диссоциирует:
Гидролизу подвергается анион слабой кислоты:
CN – + H2O D HCN + OH –
Учитывая, что в растворе присутствуют катионы калия (K + ), получаем уравнение гидролиза в молекулярной форме:
KCN + H2O D HCN + KOH
Пример 2.Гидролиз раствора соли хлорида аммония:
NH4Cl = NH4 + + Cl – (диссоциация в растворе)
Гидролизу подвергается катион слабого основания:
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
Уравнение гидролиза в молекулярной форме имеет вид:
Образуется два слабых электролита, реакция среды будет близка к нейтральной, pH ≈ 7.
Пример 4.Гидролиз раствора сульфата цинка:
ZnSO4 = Zn 2+ + SO4 2– (диссоциация в растворе).
Гидролизу подвергается катион слабого основания:
Zn 2+ + H2O DZnOH + + H + (I ступень)
Вторая ступень гидролиза возможна, но она протекает незначительно, так как образуется более диссоциированная форма Zn(OH)2:
ZnOH + + H2O D Zn(OH)2 + H + (II ступень)
В молекулярной форме:
Гидролизу подвергается многозарядный анион слабой кислоты:
В молекулярной форме:
Вторая ступень протекает незначительно, поэтому можем ограничиться рассмотрением первой ступени гидролиза.
Пример 6.Гидролиз раствора сульфида алюминия:
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
Образующиеся ионы H + и OH – нейтрализуют друг друга, исчезновение этих ионов из сферы реакции в виде малодиссоциированной воды смещает оба равновесия вправо, что приводит к активизации следующей ступени гидролиза:
Из сказанного выше следует, что будет протекать и третья ступень гидролиза:
Суммарное ионно-молекулярное уравнение имеет вид:
или в молекулярной форме:
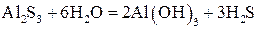
Сульфид алюминия в растворе полностью и необратимо гидролизуется с образованием нерастворимого гидроксида Al(OH)3 и слабой кислоты H2S.
Произведение растворимости
Большинство веществ обладают малой растворимостью в воде и других растворителях. В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между твердой фазой и ионами, образующимися при частичном растворении осадка.
Так, в насыщенном растворе электролита АnBm, находящегося в равновесии с его твердой фазой, будет протекать следующий обратимый процесс:
Этот процесс протекает на поверхности осадка. Состояние этого равновесия по закону действующих масс количественно характеризуется константой, называемой произведением растворимости (ПР):
В насыщенном растворе малорастворимого электролита произведение молярных концентраций ионов, возведенных в степени, равны их стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимости.
ПР зависит от природы растворителя и растворенного вещества, от температуры и не зависит от концентрации ионов в растворе.
Пример. Са3(РО4)2 « 3Са2+ + 2РО43–
Произведение растворимости и растворимость вещества являются характеристиками малорастворимого вещества, между этими величинами существует тесная связь.
Растворимость (S) – это максимально возможная концентрация вещества в растворе, выражается в г/л, г/100 г Н2О.
Молярная растворимость S совпадает с молярной концентрацией насыщенного раствора, выражается в моль/л и связана с ПР:
Для двухионных электролитов, например AgCl(n=1,m=1):
Для трехионных электролитов, например CaF2(n=1,m=2):
Следовательно, произведение растворимости и растворимость – взаимосвязанные величины, поэтому по известной растворимости вещества можно найти значение произведения растворимости и наоборот.
Вычисление произведения растворимости
малорастворимого электролита
При расчете произведения растворимости необходимо перевести в молярную растворимость (моль/л) растворимость, выраженную в г/л или г/100 г Н2О.
Для перехода растворимости, выраженной в г/100 г Н2О, к молярной концентрации можно принять объем насыщенного раствора »100 мл, учитывая малую растворимость электролита в Н2О.
Пример. Растворимость Mg(OH)2 при 18°С равна 0,012 г/л. Вычислите ПР(Mg(OH)2).
Молярная масса Mg(OH)2: М(Mg(OH)2)=58 г/моль. Рассчитаем молярную растворимость Mg(OH)2
S(Mg(OH)2) = L : M(Mg(OH)2) = 0,012 : 58 = 2,07•10–4 моль/л
Молярная растворимость совпадает с молярной концентрацией соли в растворе:
С(Mg(OH)2) = S(Mg(OH)2) = 2,07•10–4 моль/л
Найдем равновесные молярные концентрации ионов в растворе:
[Mg2+] = S =2,07•10–4 моль/л
[ОН–] = 2S = 2,07•10–4•2 = 4,14•10–4 моль/л
Тогда ПР(Mg(OH)2) = [Mg2+][OH–]2;
ПР(Mg(OH)2) = 2,07•10–4•(4,14•10–4)2 = 3,5•10–11
Вычисление концентрации ионов и растворимости
малорастворимого электролита в его насыщенном
растворе
Пример. Произведение растворимости PbJ2 при 18°С равно 1,4•10–8. Рассчитайте концентрации ионов Pb2+ и J– и молярную растворимость
Обозначим молярную растворимость соли – S моль/л. Тогда концентрации ионов равны:

Молярная растворимость соли равна 1,5•10–3 моль/л.
Концентрации ионов равны:
[J–] = 2•1,5•10–3 = 3,0•10–3 моль/л.
Чтобы от молярной растворимости перейти к растворимости в г/л, необходимо молярную растворимость умножить на молярную массу вещества.
L = S•M(PbJ2) = 1,5•10–3•461 = 0,692 г/л.
Условия образования осадков
При проведении реакций в растворе, в результате которых возможно образование осадка, необходимо соблюдать определенные требования к выбору концентраций реагентов.
Условие образования осадка: произведение молярных концентраций ионов, возведенных в степень стехиометрических коэффициентов (ПК), должно быть больше величины произведения растворимости (ПР):
ПК(AnBm) = (CA+m)n•(CB–n)m > ПР(AnBm)
Если ПК(AnBm) Читайте также: Химические свойства кислот
Ионно-молекулярное уравнение реакции
Для определения условия образования осадка необходимо рассчитать ПК
Для нахождения ПК нужно найти концентрации Fe2+ и ОН– после смешивания растворов заданной концентрации. Определяем исходные концентрации ионов до сливания растворов:
NaOH « Na+ + OH– [ОН–]=0,01 моль/л
0,01 моль/л 0,01 моль/л
Для определения концентрации ионов Fe2+ нужно перевести нормальную концентрацию FeSO4 в молярную.
fэк(FeSO4) = 1/2 0,04н FeSO4 = 0,02M FeSO4
0,02 моль/л 0,02 моль/л
Определяем концентрацию ионов после смешивания растворов.
Объем раствора после смешивания 4 мл FeSO4 и 6 мл NaOH стал 10 мл.
Концентрация ионов после смешивания растворов
Находим произведение концентраций
ПК(Fe(OH)2) = 0,008 • 0,0062 = 2,88•10–7
Сравниваем ПК с ПР (приложение, табл.3)
Следовательно при сливании 4 мл 0,004н. раствора FeSO4 и 6 мл 0,01М раствора NaOH образуется осадок Fe(OH)2.
Исходные данные и результаты расчета заносим в таблицу.
Произведение растворимости
Материалы портала onx.distant.ru
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:
PbCl2(кристалл.) ↔Pb 2+ (насыщ.р-р) + 2 Cl – (насыщ.р-р)
ПР = [Pb 2+ ] [Cl – ] 2
Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой.
ПР связано с изменением энергии Гиббса процесса уравнением:
ΔG о T = – RT lnПР (1)
которое используется для расчетов ПР по термодинамическим данным.
Из определенной опытным путем растворимости соединения можно рассчитать ПР и, наоборот, зная ПР соединения, можно рассчитать его растворимость в воде.
Рассмотрим растворение малорастворимого электролита КnАm. В насыщенном растворе этого электролита имеет место равновесие:
КnАm (к) + aq ↔ n К m+ (насыщ.р-р) + m A n- (насыщ.р-р)
Произведение растворимости КnАm запишется в виде:
ПР = [К m+ ] n [A n- ] m (2)
Если обозначить растворимость электролита буквой Р, то концентрации катионов и анионов в насыщенном растворе составят:
[К m+ ] = nP; [A n- ] = mP
В результате для величины ПР получаем
ПР = [nP] n [mP] m = n n m m P n+m (3)
Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР.
Добавление в раствор малорастворимого электролита, например, AgCl, веществ, содержащих одноименные ионы, в частности, BaCl2 или AgNO3, приводит к уменьшению растворимости этого электролита.
Примеры решения задач
Решение. М(BaCO3) = 197 г/моль. Растворимость Р карбоната бария равна:
В насыщенном растворе карбоната бария:
концентрации ионов бария и карбонат-ионов равны. Следовательно,
[Ba 2+ ] = [СO3 2- ] = 7× 10 –5 моль/л
Таким образом, растворимость Р карбоната бария равна 7·10 –5 моль/л. Величина ПР составит:
PbCl2(к) + aq ↔ Pb 2+ (насыщ.р-р) + 2 Cl — (насыщ.р-р)
Пусть Р (моль/л) — растворимость PbCl2. Тогда концентрации ионов соли в растворе составят:
[Pb 2+ ] = Р; [Cl – ] = 2[Pb 2+ ] = 2P.
Р(PbCl2) = 278× 1,6× 10 –5 = 4,4× 10 –3 г/л, где 278 — М(PbCl2) (г/моль)
Задача 3. Вычислите растворимость (моль/л) PbCl2 в 0,1 М растворе KCl, если ПР (PbCl2) = 1,6× 10 –5 при 298 К.
Решение. Суммарная концентрация хлорид-ионов составляет
[Cl – ] = (2Р + 0,1) моль/л
Хлорид-ионы образуются при диссоциации PbCl2. В его насыщенном растворе:
PbCl2(к) + aq ↔ Pb 2+ (насыщ.р-р) + 2 Cl — (насыщ.р-р)
а также за счет диссоциации неассоциированного электролита KCl в его 0,1М растворе:
KCl → K + + Cl —
В воде растворимость PbCl2 равна 1,6× 10 –2 моль/л (см. предыдущую задачу), в растворе KCl растворимость PbCl2 уменьшилась и составила 1,6× 10 –3 моль/л.
Решение. Осадок выпадет, если [Сu 2+ ][S 2– ] > ПР(СuS), т.е. если произведение концентраций ионов Сu 2+ и S 2– в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
Молярные концентрации растворов равны:
См (СuCl2) = 1/2× 0,01 = 0,005M
См (Na2S) = 1/2× 0,1 = 0,05M
До смешения растворов: [Сu 2+ ] = 0,005 M, [S 2– ] = 0,05М.
После смешения растворов концентрации ионов изменятся и станут равными:
[Сu 2+ ] = 0,005× 0,1:0,4 = 0,00125M
[S 2– ] = 0,05× 0,3:0,4 = 0,0375М
Следовательно, произведение концентраций ионов равно:
[Сu 2+ ][S 2– ] = 0,00125× 0,0375 = 4,7× 10 –5 (моль/л) 2
Решение.
Примем растворимость BaSO4 за Р моль/л.
Растворимость BaSO4 равна концентрации ионов Ba 2+ и SO4 2– в растворе: [Ba 2+ ] = [SO4 2– ].
где 233 — М(BaSO4) (г/моль).
Следовательно, 1 г BaSO4 растворяются в 1/2,33× 10 –3 = 429,2 л воды.
Задачи для самостоятельного решения
3. При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли.
4. При некоторой температуре рН насыщенного раствора гидроксида кальция составляет 13. Рассчитайте величину ПР этого основания.
1,4× 10 –2 моль/л; 4,4 г/л.
7. Вычислить растворимость (моль/л) Ni(OH)2 в 0,15 М растворе Ni(NO3)2, если ПР(Ni(OH)2) = 1,2× 10 –16 при 298 К.
10. При 298 К растворимость PbS в 0,015 М водном растворе K2S равна 4,1× 10 –26 моль/л. Определить G o 298 процесса растворения PbS.
Условие образование осадка. Произведение растворимости



Абсолютно нерастворимых веществ нет. Большинство твердых веществ обладают ограниченной растворимостью. В насыщенных растворах электролитов малорастворимых веществ в состоянии динамического равновесия находятся осадок и насыщенный раствор электролита. Например, в насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие:
Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия: Kp = [Ba 2+ ] [SO4 2- ]
Эта величина называется произведением растворимости малорастворимого вещества (ПР). Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере
Произведение растворимости характеризует растворимость малорастворимого вещества при данной температуре: чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора.
В насыщенном растворе сильного малорастворимого электролита произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам при данных ионах (при данной температуре), есть величина постоянная, называемая произведением растворимости.
Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ. Чем больше ПР данного вещества, тем больше его растворимость. Например:
В данном случае наименее растворимым является гидроксид железа (II).
Условие образования осадка:
Условие растворения осадка:
[K y+ ] x ·[A x- ] y y+ и A x- пропорциональны растворимости S (моль/л) вещества KxAy:
[K y+ ] = x· S и [A x- ] = y· S
ПР = (x· S) x · (y· S) y = x x · y y · S x+y
Полученные выше соотношения позволяют рассчитывать значения ПР по известной растворимости веществ (а, следовательно, и равновесные концентрации ионов) по известным значениям ПР при T = const.