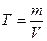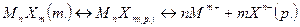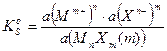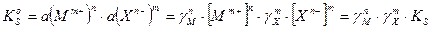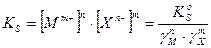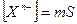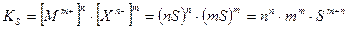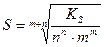Чем меньше произведение растворимости
Произведение растворимости
Материалы портала onx.distant.ru
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:
PbCl2(кристалл.) ↔Pb 2+ (насыщ.р-р) + 2 Cl – (насыщ.р-р)
ПР = [Pb 2+ ] [Cl – ] 2
Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой.
ПР связано с изменением энергии Гиббса процесса уравнением:
ΔG о T = – RT lnПР (1)
которое используется для расчетов ПР по термодинамическим данным.
Из определенной опытным путем растворимости соединения можно рассчитать ПР и, наоборот, зная ПР соединения, можно рассчитать его растворимость в воде.
Рассмотрим растворение малорастворимого электролита КnАm. В насыщенном растворе этого электролита имеет место равновесие:
КnАm (к) + aq ↔ n К m+ (насыщ.р-р) + m A n- (насыщ.р-р)
Произведение растворимости КnАm запишется в виде:
ПР = [К m+ ] n [A n- ] m (2)
Если обозначить растворимость электролита буквой Р, то концентрации катионов и анионов в насыщенном растворе составят:
[К m+ ] = nP; [A n- ] = mP
В результате для величины ПР получаем
ПР = [nP] n [mP] m = n n m m P n+m (3)
Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР.
Добавление в раствор малорастворимого электролита, например, AgCl, веществ, содержащих одноименные ионы, в частности, BaCl2 или AgNO3, приводит к уменьшению растворимости этого электролита.
Примеры решения задач
Решение. М(BaCO3) = 197 г/моль. Растворимость Р карбоната бария равна:
В насыщенном растворе карбоната бария:
концентрации ионов бария и карбонат-ионов равны. Следовательно,
[Ba 2+ ] = [СO3 2- ] = 7× 10 –5 моль/л
Таким образом, растворимость Р карбоната бария равна 7·10 –5 моль/л. Величина ПР составит:
PbCl2(к) + aq ↔ Pb 2+ (насыщ.р-р) + 2 Cl — (насыщ.р-р)
Пусть Р (моль/л) — растворимость PbCl2. Тогда концентрации ионов соли в растворе составят:
[Pb 2+ ] = Р; [Cl – ] = 2[Pb 2+ ] = 2P.
Р(PbCl2) = 278× 1,6× 10 –5 = 4,4× 10 –3 г/л, где 278 — М(PbCl2) (г/моль)
Задача 3. Вычислите растворимость (моль/л) PbCl2 в 0,1 М растворе KCl, если ПР (PbCl2) = 1,6× 10 –5 при 298 К.
Решение. Суммарная концентрация хлорид-ионов составляет
[Cl – ] = (2Р + 0,1) моль/л
Хлорид-ионы образуются при диссоциации PbCl2. В его насыщенном растворе:
PbCl2(к) + aq ↔ Pb 2+ (насыщ.р-р) + 2 Cl — (насыщ.р-р)
а также за счет диссоциации неассоциированного электролита KCl в его 0,1М растворе:
KCl → K + + Cl —
В воде растворимость PbCl2 равна 1,6× 10 –2 моль/л (см. предыдущую задачу), в растворе KCl растворимость PbCl2 уменьшилась и составила 1,6× 10 –3 моль/л.
Решение. Осадок выпадет, если [Сu 2+ ][S 2– ] > ПР(СuS), т.е. если произведение концентраций ионов Сu 2+ и S 2– в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
Молярные концентрации растворов равны:
См (СuCl2) = 1/2× 0,01 = 0,005M
См (Na2S) = 1/2× 0,1 = 0,05M
До смешения растворов: [Сu 2+ ] = 0,005 M, [S 2– ] = 0,05М.
После смешения растворов концентрации ионов изменятся и станут равными:
[Сu 2+ ] = 0,005× 0,1:0,4 = 0,00125M
[S 2– ] = 0,05× 0,3:0,4 = 0,0375М
Следовательно, произведение концентраций ионов равно:
[Сu 2+ ][S 2– ] = 0,00125× 0,0375 = 4,7× 10 –5 (моль/л) 2
Решение.
Примем растворимость BaSO4 за Р моль/л.
Растворимость BaSO4 равна концентрации ионов Ba 2+ и SO4 2– в растворе: [Ba 2+ ] = [SO4 2– ].
где 233 — М(BaSO4) (г/моль).
Следовательно, 1 г BaSO4 растворяются в 1/2,33× 10 –3 = 429,2 л воды.
Задачи для самостоятельного решения
3. При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли.
4. При некоторой температуре рН насыщенного раствора гидроксида кальция составляет 13. Рассчитайте величину ПР этого основания.
1,4× 10 –2 моль/л; 4,4 г/л.
7. Вычислить растворимость (моль/л) Ni(OH)2 в 0,15 М растворе Ni(NO3)2, если ПР(Ni(OH)2) = 1,2× 10 –16 при 298 К.
10. При 298 К растворимость PbS в 0,015 М водном растворе K2S равна 4,1× 10 –26 моль/л. Определить G o 298 процесса растворения PbS.
Взаимосвязь между растворимостью и константой растворимости
Тема: Константа растворимости (Произведение растворимости)
1. Гетерогенные системы
2. Константа растворимости
3. Взаимосвязь между растворимостью и константой растворимости
4. Условия образования осадков
Гетерогенными называются такие системы, которые состоят из нескольких фаз и имеют реальную физическую границу раздела.
Фаза – это часть системы с одинаковыми химическими и физическими свойствами. Межфазные процессы заканчиваются восстановлением гетерогенных динамических равновесий. Например, минеральные компоненты костной и зубной ткани находятся в равновесии с ионами кальция и фосфата плазмы крови. Смещение этого равновесия может привести к развитию патологических состояний. При некоторых патологических состояниях может начаться образование твердой фазы. Например, возникновение мочевых камней (оксалат кальция, фосфат кальция, мочевая кислота) при почечнокаменной болезни, образование холестериновых камней и т.д. В аналитической химии существует ряд гетерогенных процессоров, которые сопровождаются выпадением или растворением осадков. Знание общих закономерностей установления и смещение гетерогенного равновесия позволяет управлять процессами разделения, растворения и определения веществ.
Оба процесса – прямой и обратный – происходят очень быстро: достаточно в раствор с осадком AgCl добавить иодид калия и перемешать смесь, как почти сразу же весь белый хлорид серебра переходит в желтый иодид AgI; если же в раствор добавить бесцветный сульфид натрия, немедленно образуется черный сульфид серебра Ag2S.
Константа растворимости
Рассмотрим процессы, возникающие при взаимодействии малорастворимого, но сильного электролита ВаSO4 с водой. Под действием диполей воды ионы Ва 2+ и SO4 2- из кристаллической решетки будут переходить в жидкую фазу. Одновременно под влиянием электростатического поля кристаллической решетки часть ионов Ва 2+ и SO4 2- будет осаждаться. При данной температуре в гетерогенной системе установится равновесие: скорость процесса растворения (v1) будет равна скорости процесса осаждения (v2).
Такой раствор называется насыщенным. Равновесная гетерогенная система характеризуется константой химического равновесия:
Кх.р.= 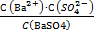
Знаменатель этой дроби является постоянной величиной, поэтому произведение
К х.р.∙ С(ВаSO4 ) – величина постоянная(произведение растворимости или константа растворимости). Обозначается ПР или Кs. Если малорастворимый сильный электролит образует при диссоциации несколько ионов, то в выражении Кs (ПР) концентрации ионов берутся в соответствующих степенях, равных стехиометрическим коэффициентам.
Произведение растворимости (константа растворимости) – это произведение молярной концентрации ионов малорастворимого электролита в его насыщенном растворе. Каждая из концентраций берется в степени, равной количеству ионов, образующихся при диссоциации данного электролита.
В общем виде для электролита АmBn константа растворимости рассчитывается по формуле: Ks (АmBn) = С m (А) ∙ С n (В ).
Величиной Ks принято пользоваться только в отношении электролитов, растворимость которых в воде не превышает 0,01моль/л.
Так как абсолютно нерастворимых веществ нет, то и Ks 
Взаимосвязь между растворимостью и константой растворимости
Количественно растворимость различных веществ выражается концентрацией насыщенных растворов. Растворимость данного вещества равна его молярной концентрации в насыщенном растворе (Sмоль/л). Растворимость часто выражается в граммах растворенного вещества на 100г или на 1000г растворителя. Связь между Кs и растворимостью зависит от числа ионов, на которые распадается малорастворимый сильный электролит в растворе.
В общем виде S(АmВn)= 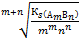
По величине Ks ряда однотипных соединений (индексы m и n у них одинаковые) можно судить об их относительной растворимости: чем меньше Ks, тем меньше растворимость. Например, можно сравнивать растворимость (в единицах моль/л) для FeS и CuS, но нельзя сравнивать значения Ks для CuS и Ag2S (разные m). Значения Ks для некоторых малорастворимых соединений приведены в таблице.
Произведение растворимости



Закон действующих масс применим как к гомогенным равновесиям, например, к равновесиям в растворах, так и к равновесиям в гетерогенных системах.
Гетерогенная (неоднородная) система – это система, состоящая из нескольких гомогенных фаз, разделенных между собой поверхностью раздела. Свойства фаз отличаются друг от друга и примерами таких гетерогенных систем могут являться две несмешивающиеся жидкости, осадок и насыщенный раствор над ним, газ и твердое вещество и др. Равновесие, устанавливающееся в гетерогенной системе на границе раздела фаз, называется гетерогенным равновесием. Гетерогенная система «осадок – раствор» представляет собой осадок малорастворимого соединения, например, сульфата бария BaSO4, находящийся в равновесии с его насыщенным раствором:
Напомним, что насыщенным называется раствор, содержащий максимальное количество вещества, которое может раствориться в данном объеме раствора при данной температуре и давлении. Насыщенный раствор устойчив во времени.
Пересыщенный раствор – это раствор, в котором содержится бóльшее количество вещества, чем в насыщенном. Такой раствор неустойчив и избыток вещества выделяется из него в твердую фазу, то есть образуется осадок. Процесс протекает до образования над осадком насыщенного раствора.
Ненасыщенный раствор характеризуется меньшим количеством растворенного вещества, чем насыщенный, и в нем может быть растворено дополнительное количество вещества до получения насыщенного раствора.
Концентрация вещества в насыщенном растворе называется растворимостью. Растворимость является количественной характеристикой способности вещества растворяться. Различают молярную и массовую растворимость вещества.
Молярная растворимость вещества (S, моль/л) – это количество растворенного вещества, содержащееся в одном литре его насыщенного раствора:
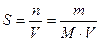
где: n – количество растворенного вещества, моль
m – масса растворенного вещества, г
M – молярная масса растворенного вещества, г/моль
Массовая растворимость вещества (Т, г/л) – это масса растворенного вещества, содержащаяся в одном литре его насыщенного раствора:
где: m – масса растворенного вещества, г
V – объем насыщенного раствора, л
Молярная и массовая растворимости связаны между собой соотношением:
В гетерогенной системе «осадок-раствор» на поверхности раздела твердой и жидкой фаз протекают два противоположно направленных процесса – переход молекул малорастворимого вещества в раствор (растворение) и обратный процесс перехода молекул вещества в осадок (осаждение). Если оба процесса протекают с одинаковой скоростью, в гетерогенной системе «осадок – раствор» на поверхности раздела твердой фазы и раствора устанавливается динамическое химическое равновесие между молекулами вещества в осадке и растворе.
Молекулы малорастворимого сильного электролита, перешедшие в раствор, полностью распадаются на ионы и его непродиссоциированных молекул в растворе нет. Поэтому в гетерогенной системе «осадок – раствор» устанавливается равновесие между молекулами малорастворимого вещества в осадке и его ионами в насыщенном растворе:
Для этого химического равновесия можно написать выражение истинной термодинамической константы химического равновесия:
Активность твердого вещества а(MnXm(т)) принимается постоянной и равной единице, тогда:
где: 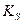
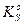
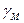
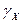
Из выше приведенных выражений следует правило произведения растворимости: произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе малорастворимого электролита есть величина постоянная для данного растворителя, температуры, давления.
Это правило справедливо как для сильных, так и для слабых электролитов, как для идеальных, так и для реальных систем. В реальных системах, однако, вместо активностей удобнее использовать концентрации. Соответственно, вместо термодинамического произведения растворимости 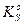
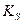
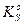
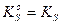
Для расчета растворимости малорастворимого соединения используют выражение для концентрационного произведения растворимости ( 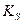
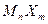
равновесные концентрации катиона и аниона в насыщенном растворе будут равны:
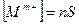
Подставив эти значения в выражение для концентрационного произведения растворимости, получим:
Если ионная сила раствора мала и коэффициенты активности катиона и аниона стремятся к единице, то можно вместо концентрационного произведения растворимости ( 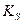
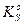
Растворимость малорастворимого соединения зависит от его природы и природы растворителя, температуры, давления, присутствия в растворе других электролитов (как имеющих, так и не имеющих одноименные ионы с данным малорастворимым соединением), а также различных веществ, вступающих с ионами осадка в реакции нейтрализации, комплексообразования и другие химические реакции.
Произведение растворимости является одной из основных характеристик малорастворимых электролитов и по значению ПР:
1. можно рассчитать условия осаждения;
2. определить растворимость данного осадка в данных условиях;
3. выяснить какой осадок будет выпадать первым.
Из всего сказанного вытекают два следствия:
I. а) Если произведение концентрации ионов (ИП) меньше величины произведения растворимости (ПР), то раствор ненасыщен относительно данного труднорастворимого соединения и осадок не образуется;
б) если произведение концентрации ионов (ИП) равно произведению растворимости (ПР), то раствор насыщен относительно данного труднорастворимого соединения; в растворе наступает подвижное равновесие и осадок не выпадает;
в) Если произведение концентрации ионов (ИП) больше произведения растворимости (ПР), то раствор пересыщен относительно данного труднорастворимого соединения и осадок образуется. Осадок выделяется до тех пор, пока не будет достигнута величина ПР.
II. Из двух труднорастворимых соединений в первую очередь выпадет в осадок тот, чье произведение растворимости (ПР) будет наименьшим.
Определение и суть
При определённой температуре, зависящей от вида раствора электролита между кристаллами и его содержанием, устанавливается равновесие. Оно является динамическим, так как скорость прямой и обратной реакции совпадают, то есть время растворения и кристаллизации равны. Главным условием для наступления такого процесса является содержание в жидкости малорастворимого электролита.
Протекающая реакция характеризуется двумя константами:
Общей формулой произведения растворимости в химии является выражение: ПР = [Ky]x * [Ax-]y. Таким образом, определяется взаимосвязь между постоянной растворимости и равновесия. То есть это гетерогенное равновесие между кристаллами Кх Ау и раствором.
Любое соединение, образующее раствор, может быть насыщенным или ненасыщенным. Первым называют взаимодействие при определённой температуре, когда можно растворить ещё какую-то часть продукта, а вторым — раствор, в котором скорости реакции и осаждения равны. Существует и третий вид раствора — перенасыщенный. Это состояние реакции, при которой образуется осадок.
Эти три состояния можно описать формулами:
Константа связана и с перераспределением энергии Гиббса. Эта зависимость объединяет температуру, давление и газовую постоянную. Так как свободная энергия — это мощность, равная изменению системы внутри неё, то потенциал Гиббса характеризуется полной энергией, которая используется для химического превращения и позволяет определить возможность прохождения реакции. Находится она по формуле: G = U + PV — TS. Изменение мощности можно описать выражением: ΔG = R * T * LtKa.
Определение влияния константы равновесия и решение уравнений электронного баланса даёт возможность найти равновесные составы уравнений, что важно для описания термодинамических процессов.
Правило активности ионов
В аналитической химии по выпадению осадка часто определяют, какие продукты содержатся в растворе. На изучении осадка построен качественный анализ. В природе не существует веществ абсолютно нерастворимых, поэтому всегда образуются выпавшие частицы или ионы. Для изучения системы осадок-раствор и используют правило произведения растворимости.
Сформулировал этот закон в 1889 году Нернст. Согласно утверждению химика, в высококонцентрированном растворе малорастворимого соединения произведение активностей частиц с их стехиометрическими коэффициентами определяется константой, характерной для растворителя. При этом на показатель также влияет температура.
По факту это правило является следствием второго начала термодинамики применительно к равновесной системе. По сути, осадок представляет двухфазную систему. Правило произведения было установлено эмпирическим путём при изучении слаборастворимых веществ. Его нельзя применять, например, к солям KCl, TaTO3 и другим.
Полный расчёт обычно довольно сложен, так как необходимо определить коэффициенты активности. Поэтому используют упрощённый подход. Расчёт выполняют только для слаборастворимых веществ, у которых активность ионов равна концентрации. Следовательно, она составляет единицу. А также при отсутствии дополнительных кислот или оснований пренебрегают гидролизом.
В качественном анализе большую часть электролитов охватывают следующие типы солей:
Экспериментально установленные значения являются справочными данными и берутся из таблицы произведений растворимости. Зная их величину, вычислить растворимость слаборастворимых продуктов при установленных условиях не составляет труда.
Экспериментальное подтверждение
Для эксперимента нужно поместить в химическую колбу любую труднорастворимую соль, например, AgCl, и перемешать с ней дистиллированную воду. Так как ионы Ag+ и Cl- взаимодействуют с диполями H2O, то через время они начнут отрываться от кристаллической решётки и насыщать раствор.
Сталкиваясь, освободившиеся ионы начнут создавать хлорид серебра и выпадать в виде осадка. Это приводит к тому, что в системе возникают два противоположных друг другу процесса. В итоге наступает динамическое равновесие. То есть за единицу времени в раствор поступает столько частиц серебра и хлора, сколько и выпадает в осадок. После того как отрыв ионов прекратится, раствор станет насыщенным. Таким образом, получится раствор, где будет находиться осадок труднорастворимой соли с находящимся в жидком состоянии соединении этого же вещества.
Процесс образования соединения будет сопровождаться:
Исходя из того, что эта система находится в состоянии равновесия, верным будут следующие выражения: V1 = V2 и K1 = K2. То есть [Ag + ] [Cl — ], где: [ Cl — ] = k 2 / k 1 = cotst, для реакции, протекающей при постоянной температуре. Поэтому можно утверждать, что произведение количества ионов в концентрированном растворе малорастворимого электролита будет постоянной величиной, но только при постоянной температуре: ПР AgCl = [ Ag + ] * [ Cl — ].
Но необходимо учитывать и влияние различных факторов. К ним относят концентрацию раствора, количество осадителя, температуру, присутствие одноимённого иона. Правило произведения важно при растворении осадков в растворе. С его помощью можно заранее узнать выпавшую в осадок часть. Для часто используемых соединений существует таблица, куда внесены экспериментально полученные результаты при температуре 25 0 С.