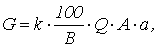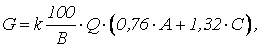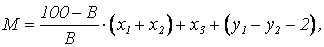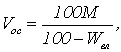Чем можно нейтрализовать серную кислоту
Как нейтрализовать кислоту содой
H2SO4 – вещество, способное растворяться в воде и выделять при этом большое количество тепла. Его 100-процентная концентрация при температуре больше +10 С затвердевает и становится кристаллической массой. Раствор используют в фармакологии и медицине, для диагностики желудочных заболеваний.
Но при всех её удивительных способностях, серная кислота способна нанести немалый урон или причинить ожог. Как распространённая сода способна помочь в нейтрализации?
О серной кислоте побольше
Данное вещество — это результат взаимодействия воды с серой. Два атома водорода и кислотный остаток составляют его формулу. Интересно, что способность растворяться в воде без нейтрализации давно используется в промышленности, когда нужно осушить газ.
Кислота забирает на себя воду, оставляя газ нетронутым (за исключением случаев, когда с ним реагирует). При соприкосновении с углеводами тоже происходит необычное – раствор их обугливает. Это объясняется химически: происходит реакция, где углевод отдаёт водород и кислород, а остаётся уголь.
Как кислота, раствор H2SO4 реагирует с метиловым оранжевым, перекрашивая его в красный. Она способна окислять практически все металлы, кроме:
Реакция нейтрализации
Сама реакция представляет собой взаимодействие основания и кислоты. Обязательным условием является образование воды и кислотной соли. Чем менее сильная кислота, тем больше воды выделяется.
Нейтрализацию часто используют в лабораториях, чтобы выяснить объём жидкости, нужный для реакции. То есть, если известна концентрация раствора, необходимо провести реакцию, постепенно добавляя второй компонент.
Предельное количество добавляемого компонента, при котором будет проходить реакция используют для проведения расчётов.
Действует такая формула: кислоту нейтрализуют щёлочью и наоборот. Ионное уравнение часто будет выглядеть подобным образом:
Каждая реакция нейтрализации может быть обратимой или необратимой в зависимости от компонентов – распадаются ли они при реакции. Необратимым считается взаимодействие сильных кислот и оснований, но остальные сочетания веществ будут распадаться.
Сода – слабая щёлочь, а это обуславливает обратимость реакции независимо от того, насколько концентрированной будет H2SO4. Когда же возникает необходимость нейтрализовать это агрессивное вещество?
Зачем необходимо нейтрализовать
Взаимодействие соды и серной кислоты
Сода – слабая щёлочь, которая используется для гашения лимонной кислоты, уксусной и серной, в том числе. NaHCO3 вступает в гомогенную реакцию с ними, обмениваясь атомами. Вот как выглядит уравнение для концентрированной серной кислоты:
Происходит вот что: формируется кислотный остаток, выделяется углекислый газ и вода. Оксид водорода появляется из-за взаимодействия карбонат ионов соли и водорода. Оба вида ионов образуются в процессе диссоциации кислоты. Разбавленная H2SO4 требует меньшего количества соды:
Что образуется при взаимодействии
Кислотный остаток уже не так опасен, как исходный компонент. Интересно, что именно реакции с выделением углекислого газа сода обязана добавлением её в хлеб – углекислый газ, выделяющийся из-за взаимодействия с молочной кислотой, поднимает тесто и делает в нём пузырьки.
Примерно также происходит реакция нейтрализации: основание вступает в реакцию с H2SO4 и выделяется углекислый газ. Поэтому, чтобы этот химический опыт не превратился в плачевный жизненный, следует проводить его в проветриваемом помещении.
К вопросу о том, сколько соды необходимо для нейтрализации H2SO4. Если взять 1 часть кислоты, пригодится 1 часть щёлочи для реакции с ней, то есть соотношение будет 1:1. Но концентрированная кислота требует больше соды, здесь соотношение увеличится до 1:2. Раствор соды необходим 3%.
Кроме того, если необходимо оказать помощь при ожоге кислотой, то готовится раствор соды в очень приблизительном количестве: 1 чайная ложка щёлочи и на 2,5 стакана воды. Насколько эффективна реакция? В этом помогут разобраться отзывы тех, кто с ней часто сталкивается.
Отзывы
Автолюбители прекрасно знают, что электролит в аккумуляторе содержит 30-35% серной кислоты (если плотность 1,26). Чтобы его утилизировать они используют именно пищевую соду. На всю жидкость уходит 1,5 пачки соды. Положительным отзывом этот способ нейтрализации обязан стоимости соды и её доступности – щелочь легко можно приобрести в продуктовом магазине.
На форумах можно найти другой способ нейтрализации, с помощью силиката натрия. Он имеет право на существование, но сода в этом случае имеет бесспорное преимущество: в результате реакции с силикатом натрия выпадает осадком кремневая кислота, которую, увы, очень сложно вымыть. Результат реакции с содой – появляется карбонат ионов соли, безопасный и легко смываемый, что обуславливает большое количество положительных отзывов.
Очень интересный вопрос был обнаружен на одном из форумов. Он касался выпечки: в ней есть сода, которая теоретически может реагировать с желудочным соком (H2SO4). В результате должна образоваться в желудке соль, а вся проблема в том, что человек сидел на бессолевой диете. Пользователи успокоили волнующегося, что для реакции нейтрализации необходимо большое количество соды, а в выпечке она измеряется маленькими ложками.
Среди отзывов можно найти немало полезных советов: сыпать щёлочь лучше понемногу, чтобы пена не выходила из узкой пробирки струёй, перед утилизацией раствора разводить его дополнительно водой и проводить реакцию в проветриваемом помещении. Таким образом опасная H2SO4 не причинит вреда, если её правильно утилизировать содой.
Счет на секунды: что делать при ожоге серной кислотой в первую очередь
Врач рассказал о правилах первой помощи при ожогах серной кислотой
Фото, видео: Depositphotos / belchonock; 5-tv.ru
Эксперт назвал основные правила, следуя которым, можно снизить фактор поражения и облегчить состояние пациента до приезда медиков.
Химические ожоги от воздействия серной кислоты могут привести к фатальным последствиям для организма. Для того, чтобы облегчить состояние пострадавшего и не усугубить факторы поражения, необходимо действовать четко и в соответствии с основными правилами.
Как рассказал в беседе с 5-tv.ru директор Национального совета по первой помощи Станислав Манеров, их не много, и они достаточно простые, поэтому важно о них помнить.
Тем, кто оказался рядом с пострадавшим от воздействия серной кислоты, нужно осень быстро найти поблизости большое количество простой воды.
Между тем, ранее стали известны подробности шокирующего происшествия в Петербурге, где 24-летний мужчина, предположительно, из ревности облил серной кислотой девушку, к которой питал романтические чувства, и ее молодого человека.
В результате трагедии больше всего пострадала девушка. По словам ее спутника, который вызвал скорую помощь, все время до приезда медиков она страшно кричала от боли, а он даже знал, чем ей помочь и не мог даже дотронуться до нее.
Страшная трагедия разыгралась в центре Северной столицы вечером 10 декабря. По версии следствия, 24-летний мужчина облил серной кислотой свою бывшую возлюбленную и ее парня. Молодой человек не получил серьезного поражения, а вот его 16-летняя спутница испытала страшные мучения. Девушку экстренно госпитализировали с химическим ожогом лица, волосистой части головы, шеи, туловища и рук III степени.
Кроме того, бедняжка не успела даже спрятать глаза. Медики установили ожог роговиц и коньюктив II степени. По данному факту возбуждено уголовное дело по статье о причинении вреда здоровью средней степени тяжести.
Сегодня Октябрьский районный суд Петербурга вынес решение об аресте для нападавшего. Он останется за решеткой до 8 января 2022 года.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
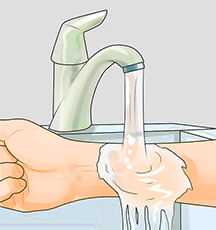
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
каустическая
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
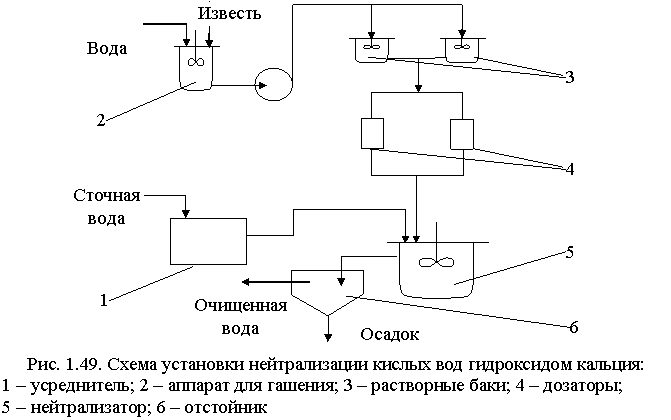
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Инструкция по нейтрализации отработанной серной кислоты аккумуляторных батарей
Утверждаю:
Директор ООО » »
_______________ В.В.Иванов
« ____ » ____________ 2015г.
Инструкция
по нейтрализации отработанной серной кислоты аккумуляторных батарей (2 класса опасности).
1. Общие требования безопасности.
При сборе, хранении, нейтрализации отработанной серной кислоты от аккумуляторных батарей следует учитывать особенности ее эксплуатации и степень опасности.
Природные воды имеют нейтральную, слабокислую или слабощелочную реакцию, рН их находится в пределах 6.5 — 8,5. Электролит имеет кислую рН среду и представляет собой серную кислоту плотностью 1,2 — 1,27. Аккумуляторная серная кислота является достаточно концентрированной и не подлежит утилизации без предварительной нейтрализации.
Растворы серной кислоты оказывают вредное воздействие на организм человека.
При нагревании серной кислоты образуются пары сернистого ангидрида, которые, соединяясь с парами воздуха, образуют кислотный туман. При вдыхании паров серной кислоты раздражаются и прижигаются слизистые оболочки верхних дыхательных путей.
При попадании на кожу серная кислота вызывает сильные ожоги, болезненные и трудно поддающиеся лечению. Попадание серной кислоты в глаза грозит потерей зрения.
Персонал, занятый нейтрализацией аккумуляторной серной кислоты, должен работать в одежде из кисло-защитной ткани, прорезиненных фартуках, резиновых сапогах, резиновых кислостойких перчатках, защитных очках или щитках из оргстекла, иметь фильтрующий противогаз марки В.
Места сбора и нейтрализации аккумуляторной серной кислоты должны иметь предупредительные надписи.
2. Требования безопасности перед началом работы.
Получить инструктаж от ответственного за нейтрализацию, о мерах безопасности и производственной санитарии при работе с аккумуляторной серной кислотой.
Подготовить и проверить исправность защитных средств, приспособлений и другого инвентаря. Следует иметь в виду, что любые разбавленные растворы серной кислоты, к которым относится и электролит, крайне • агрессивны. Вследствие этого нейтрализацию электролита необходимо проводить с максимально возможной быстротой и без перерывов.
Разработал руководитель экологической службы организации_____________
Согласовано:
Инженер по охране труда _______________________________