Чем можно нейтрализовать соляную кислоту
Действия в условиях возможного химического заражения (при аварии с выбросом соляной кислоты)
Памятка населению «Действия в условиях возможного химического заражения»
(при аварии с выбросом соляной кислоты)
Население, проживающие вблизи химически опасных объектов, должно знать свойства, отличительные признаки и потенциальную опасность аварийно химических опасных веществ, уметь действовать при возникновении аварии, оказывать первую медицинскую помощь пострадавшим.
СОЛЯНАЯ КИСЛОТА – бесцветная прозрачная агрессивная негорючая жидкость с острым запахом хлористого водорода. Хорошо растворяется в воде во всех пропорциях, «дымит» на воздухе из-за образования хлористого водорода с парами воды капелек тумана. Разрушает бумагу, дерево, ткани. При попадании на кожу вызывает ожоги. Воздействие тумана соляной кислоты, образующегося в результате взаимодействия хлористого водорода с водяными парами воздуха, вызывает отравления. На расстоянии свыше 50 метров от очага концентрация резко уменьшается. Тяжелее воздуха.
При вдыхании паров : кашель, першение в горле, слезотечение, насморк, нарушение ритма дыхания, удушье, охриплость голоса, загрудинные боли, рвота с кровью.
При поступлении через рот : ожоги губ, слизистой полости рта, резкие боли за грудиной, боли в области желудка, рвота с кровью, охриплость голоса, спазм и отек гортани, болевой шок, коллапс.
Промышленные и гражданские противогазы, при их отсутствии – ватно-марлевые повязки, смоченные 5% раствором пищевой соды или гашеной извести. Для защиты кожи используют костюмы из кислотостойкой ткани, сапоги, рукавицы, перчатки из кислотостойкой резины.
МЕРЫ ПЕРВОЙ ПОМОЩИ.
При ингаляционном отравлении – придать пострадавшему горизонтальное положение; свежий воздух, питье теплого молока с питьевой содой; антигистаминные и противокашлевые препараты.
При попадании через рот – обильное питье холод- ной воды с кусочками льда, молока (по возможности с несколькими взбитыми сырыми яйцами или антацидными препаратами, не содержащими гидрокарбонаты). Осторожно с введением карбонатов, «нейтрализацией».
. Противопоказано вызывать рвоту искусственным путем.
. Во всех случаях срочная госпитализация.
ПОРЯДОК ДЕЙСТВИЙ НАСЕЛЕНИЯ ПРИ ОПОВЕЩЕНИИ ОБ АВАРИИ С ВЫБРОСОМ СОЛЯНОЙ КИСЛОТЫ
1. Выслушайте сообщения и рекомендации по радиоприемнику или телевизору
2. Наденьте средства защиты органов дыхания и кожи
При наличии индивидуальных средств защиты, убежища, а также возможности выхода из зоны аварии:
1. Наденьте средства защиты органов дыхания и кожи;
2. Закройте окна и форточки;
3. Отключите газ, воду, электричество, погасите огонь в печи;
4. Возьмите необходимые вещи и документы;
5. Возьмите питание (трехдневный запас непортящихся продуктов);
6. Укройтесь в ближайшем убежище или покиньте район аварии.
При движении на зараженной местности соблюдайте следующие правила:
— двигайтесь быстро, но не бегите и не поднимайте пыли;
— не прислоняйтесь к зданиям и не касайтесь окружающих предметов;
— не наступайте на встречающиеся на пути капли жидкости или порошкообразные россыпи неизвестных веществ;
— не снимайте средства индивидуальной защиты;
— при обнаружении на коже, одежде, обуви, средствах индивидуальной защиты капель сильнодействующих ядовитых веществ удалите их тампоном из бумаги, ветоши или носовым платком, по возможности промойте зараженное место водой;
— оказывайте помощь пострадавшим, детям и престарелым, не способным двигаться самостоятельно;
— не принимайте пищу, не пейте воду.
При отсутствии индивидуальных средств защиты, убежища, а также возможности выхода из зоны аварии:
1. Плотно закройте окна и двери;
2. Входные двери плотно зашторьте плотной тканью;
3. Проведите герметизацию жилища, заклейте окна и стыки рам пленкой, лейкопластырем или обычной бумагой.
ВАЖНО : п ри авариях с выбросом соляной кислоты необходимо укрываться на верхних этажах зданий, следует избегать пониженных участков местности, подвалов, цокольных этажей.
Действия населения после выхода из зоны химического заражения
Чем можно нейтрализовать соляную кислоту
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Небольшие разливы
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
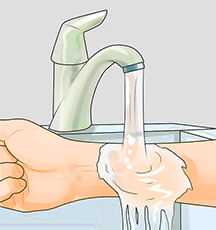
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Утилизация соляной кислоты
Утилизация соляной кислоты
Соляная кислота – химическое соединение, часто используемое в промышленности. Ее утилизация представляет собой определенные трудности и должно осуществляться по установленным правилам.
Свойства
Водный раствор хлористого водорода разной концентрации – это соляная кислота. Чаще всего используется раствор с концентраций хлористого водорода 36-38%. Плотность – 1,19 г/см 3
Кислота с такой концентрацией испускает молекулы хлористого водорода – дымится. При уменьшении в растворе содержания этого соединения его выделение прекращается.
Чистая кислота не имеет цвета. В технических целях применяется раствор с содержанием примесей железа, хлора и других веществ. Он желтоватого оттенка.
Применение
При нагревании соляная кислота становится летучей. Она взаимодействует с большинством металлов. Исключение составляют платина, вольфрам, золото, серебро и свинец.
Используется в промышленности для извлечения металлов из руд и для травления металлов. Также она присутствует в составе некоторых соединений, например, в царской водке и в паяльной жидкости.
Воздействие на человеческий организм
Соляная кислота ядовита. Воздействие на организм человека проявляется в следующих заболеваниях:
При работе с соляной кислотой необходимо использовать защитную одежду и обувь. Органы дыхания защищать при помощи противогаза.
Хранение и транспортировка
Длительное хранение осуществляется в наземных покрытых изнутри слоем резины вертикальных резервуарах. Давление допускается атмосферное. Также соляную кислоту можно хранить в стеклянных бутылях емкостью в 20 литров. Максимальный объем хранения – 370 тонн.
Транспортируют соляную кислоту в металлических цистернах, баллонах, контейнерах. Они тоже должны быть гуммированы (покрыты слоем резины).
Нейтрализация соляной кислоты
Для нейтрализации соляной кислоты используются водные растворы щелочей:
Разлитую на земле соляную кислоту можно нейтрализовать при помощи воды. Ее подавают при помощи поливочных или пожарных машин. Загрязненный соляной кислотой грунт нужно срезать и вывезти на утилизацию.
Утилизация промышленных объемов соляной кислоты
Соляная кислота может нанести огромный вред здоровью человека. Поэтому утилизацию нужно проводить правильно.
Использование отходов
Промышленные процессы оставляют большое количество отходов соляной кислоты. Простая нейтрализация этого продукта невыгодна.
Отходы можно с успехом использовать в промышленности. Существует несколько возможностей:
Утилизация соляной кислоты в НПСТЦ
Наша компания предлагает комплекс услуг по утилизации и переработке соляной кислоты. Мы гарантируем высокий профессиональный уровень нашей деятельности и выполнение всех правил безопасности.
Дополнительными преимуществами сотрудничества с нами можно назвать бесплатный вывоз отходов (начиная с 10 тонн). Сроки и стоимость работ оговариваются заранее, перед заключением договора, и входят в него.
Соляная кислота – опасный отход, который еще может принести пользу. Мы гарантируем правильную и безопасную утилизацию этого вещества.
© 1988-2021 ООО «НПСТЦ» Научно-производственный Строительно-технологический Центр. Основан в 1988г.
- Адрес: г. Москва, Средняя первомайская, д. 4 +7(495) 032-34-75
Обзор современных антацидных средств
Антацидные средства, или антациды, представляют собой препараты, уменьшающие кислотность желудочного сока за счет нейтрализации соляной кислоты. История их применения в медицине насчитывает более 100 лет. По своей химической природе антацидные
Антацидные средства, или антациды, представляют собой препараты, уменьшающие кислотность желудочного сока за счет нейтрализации соляной кислоты. История их применения в медицине насчитывает более 100 лет. По своей химической природе антацидные средства — это основания, вступающие в реакцию с соляной кислотой, в результате чего образуются хлориды, вода и иногда углекислый газ [1].
В настоящее время на фармакологическом рынке РФ представлен большой спектр антацидных средств, основными компонентами которых являются гидрокарбонат натрия, карбонат кальция, гидроксид и фосфат алюминия, цитрат, карбонат, оксид и гидроксид магния. Применяемые в настоящее время антацидные средства отличаются скоростью наступления эффекта, его длительностью, а также способностью оказывать системное воздействие и образовывать углекислый газ в желудке. Антацидные средства делятся на растворимые в воде и нерастворимые [2].
Гидрокарбонат натрия и карбонат кальция растворяются в воде, действуют быстро, при этом образуется углекислый газ, вызывающий растяжение желудка и стимулирующий вторичную гиперсекрецию соляной кислоты (синдром рикошета). Гидрокарбонат натрия благодаря своей растворимости в воде способен всасываться и оказывать системное действие; при длительном и чрезмерном употреблении этого антацида может развиться ацидоз. Основные растворимые антациды приведены в табл. 1.
Соединения магния и алюминия не растворяются в воде, они отличаются более медленным по сравнению с солями натрия и кальция наступлением эффекта при более продолжительном воздействии. Кроме того, буферная емкость соединений магния и алюминия выше, чем у солей натрия и кальция. Эти соединения практически не всасываются в кровь и частично сорбируют токсины. В больших количествах соли магния обладают слабительным действием, алюминия — запирающим. Основные нерастворимые антациды приведены в табл. 2.
В отличие от всасывающихся антацидов длительное применение невсасывающихся препаратов не приводит к развитию феномена рикошета. Механизм данного явления может быть связан с тем, что невсасывающиеся антацидные средства не только нейтрализуют соляную кислоту, но и абсорбируют пепсин, что приводит к подавлению биосинтеза соляной кислоты. Механизм воздействия, характерный для невсасывающихся препаратов, оказывается более медленным, чем связывание соляной кислоты, однако при этом эффект сохраняется более длительное время [3].
В качестве антацидных средств в последние годы все чаще и чаще используются комплексы, содержащие несколько соединений. Благодаря этому удается варьировать скорость наступления терапевтического эффекта, продолжительность воздействия препарата, а также свести к минимуму его побочные эффекты. Кроме того, некоторые современные препараты обладают и гастропротективным эффектом благодаря содержащимся в них специальным добавкам [8].
Область клинического применения антацидов — кислотозависимые заболевания желудка (язвенная болезнь желудка и двенадцатиперстной кишки, гастроэзофагальная рефлюксная болезнь), эзофагиты, «голодные» боли, изжога у практически здоровых людей [7, 8]. Обычно антациды используются как симптоматическое средство для лечения изжоги, однако может быть рекомендовано и курсовое назначение препаратов — через 1,5 ч после еды или на ночь [4].
В последние годы появились данные о том, что в ряде случаев целесообразно назначать антациды при гиперацидном гастрите, даже если его развитие связано с Helicobacter pylori. Предварительная гипоацидная терапия позволяет в дальнейшем повысить эффективность эрадикации H.pylori, снизить повреждающее действие соляной кислоты на слизистые оболочки желудка [6].
В лечении гастроэзофагальной рефлюксной болезни антациды по сути являются единственными препаратами, положительно влияющими на состояние больного и обладающими длительным терапевтическим эффектом. Применение антацидных средств в качестве монотерапии приводит не только к купированию клинических симптомов заболевания, но и к редукции морфологического субстрата рефлюксной болезни. В результате терапии у больных полностью проходит диспептический синдром [5].
Ниже приводится краткая характеристика некоторых комплексных антацидных препаратов.
Маалокс — комплексный антацидный препарат, содержит гель гидроокиси алюминия и магния, отличается повышенной буферной емкостью. Выпускается в виде таблеток, суспензии или порошка. Применяют внутрь по 1-2 таблетки (предварительно разжевав), или по 1 столовой ложке суспензии, или содержимое 1 пакета на прием. При длительном применении может вызывать рвоту, диарею или запор. Противопоказанием к назначению является тяжелая почечная недостаточность. Маалокс не назначают вместе с тетрациклинами.
Альмагель и Альмагель А — комплексные высокоэффективные антациды. Выпускаются в виде суспензии гидроокиси алюминия и магния. Также содержат D-сорбит. Представляют собой вязкую жидкость. Обладают обволакивающим действием. Применяются не только для симптоматического лечения гиперацидных состояний, но и при язвенной болезни желудка, двенадцатиперстной кишки, эзофагитах. D-сорбит способствует желчеотделению и оказывает послабляющее действие. Входящий в состав Альмагеля А анестезин обладает обезболивающим действием, что позволяет применять препарат при болях в эпигастральной области. При гиперацидных состояниях препараты назначают по 1-2 столовые ложки на прием, для курсового лечения используется та же дозировка, препараты назначают 2-3 раза в день. Побочные эффекты: запор, при передозировке сонливость. Противопоказания к назначению: прием сульфаниламидных препаратов, выраженные нарушения деятельности почек.
Фосфалюгель содержит фосфат алюминия, гель пектина и агар-агар. Выпускается в пластмассовых пакетах. На прием назначают 1-2 пакета, при этом их или запивают небольшим количеством жидкости, или разводят в 1/2 стакана кипяченой воды. Побочные эффекты и противопоказания те же, что и у Альмагеля.
Гастал — комплексный препарат, не влияющий на кислотно-основное равновесие. Выпускается в виде таблеток, содержащих гель гидроксида алюминия, карбонат и гидроксид магния. На прием назначают 1-2 таблетки, которые следует медленно сосать. Побочные эффекты: тошнота, запор, диарея. Противопоказания: непереносимость препарата или его компонентов, тяжелая почечная недостаточность.
Гелусил — препарат в виде таблеток или порошков, содержащих силикат гидрат алюминия-магния. На прием назначают 1 таблетку (разжевывают) или 1 пакетик порошка (растворяют в 1/4 стакана кипяченой воды). Противопоказания: тяжелая почечная недостаточность, гиперчувствительность к компонентам препарата.
Тальцид — таблетки, содержащие гидроксикарбонат алюминия-магния. Обычная дозировка на прием — 1-2 таблетки. Побочные эффекты: диарея, жидкий стул. Противопоказания: не назначается детям до 6 лет, при нарушении выделительной функции почек.
Литература
1. Кольцов П. А., Задионченко В. С. Фармакотерапия хронических заболеваний органов пищеварения. — М.: М-Око, 2001, с. 7-12.
2. Лапина Т. Л., Ивашкин В. Т. Современные подходы к лечению язвенной болезни желудка и двенадцатиперстной кишки. — Библиотека русского медицинского журнала. Болезни органов пищеварения, 2001, т. 3, № 1, с. 10-15.
3. Лапина Т. Л. Гиперацидные состояния: принципы лечения. — Consilium medicum, 2001, т. 3, № 6, с. 251-255.
4. Минушкин О. Н. Место современных антацидных препаратов в лечении кислотозависимых заболеваний. — Лечащий Врач, 2001, № 5-6, с. 8-10.
5. Нурмухамедова Е. А. Антациды и антагонисты Н2-рецепторов в лечении изжоги. — Consilium provisorum, 2001, т. 1, № 2, с. 10-14.
6. Шептулин А. А. Современные принципы фармакотерапии язвенной болезни — Клиническая медицина, 1996, № 8, с. 17-18.
7. Furu K., Straume B. Use of antacids in a general population. — J. Clin. Epideiol., 1999. V. 52. N. 6. P. 509-516.
8. Maton P. N., Burton M. E. Antacides revisited: a review of their clinical pharmacology and recommended therapeutic use. — Drugs, 1999. V. 57. N. 6. P. 855-870.
