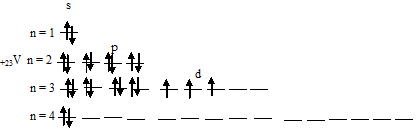
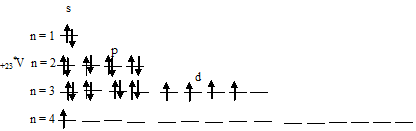
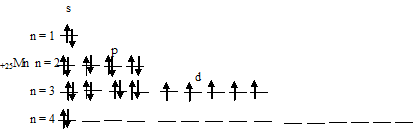
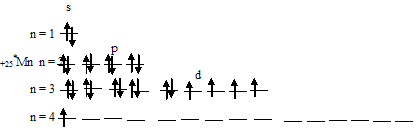
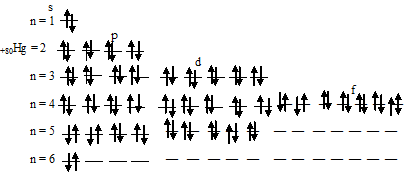
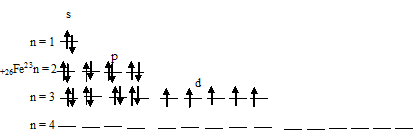
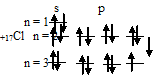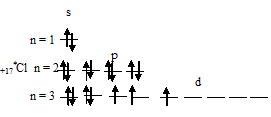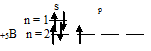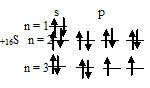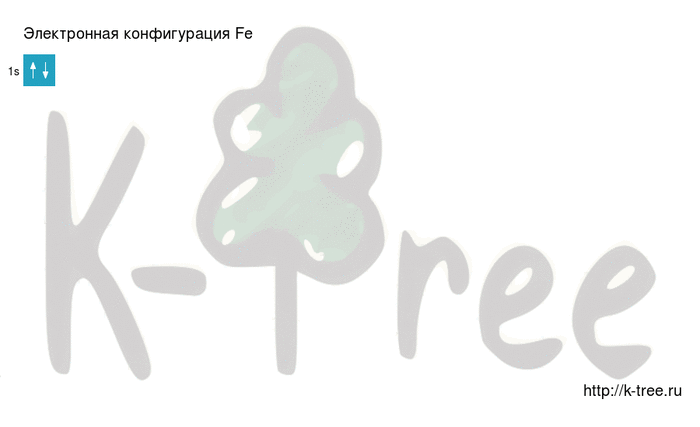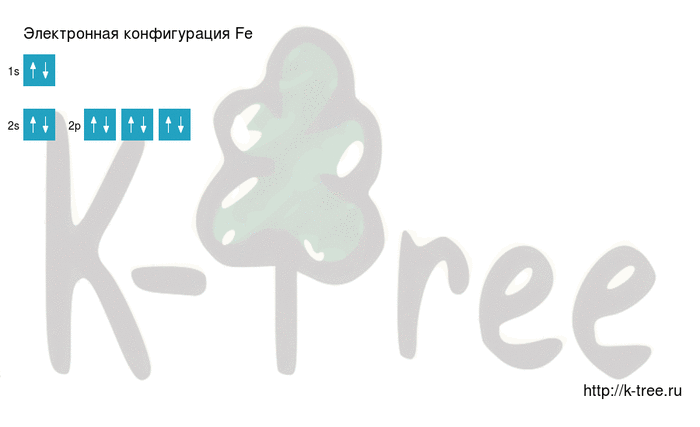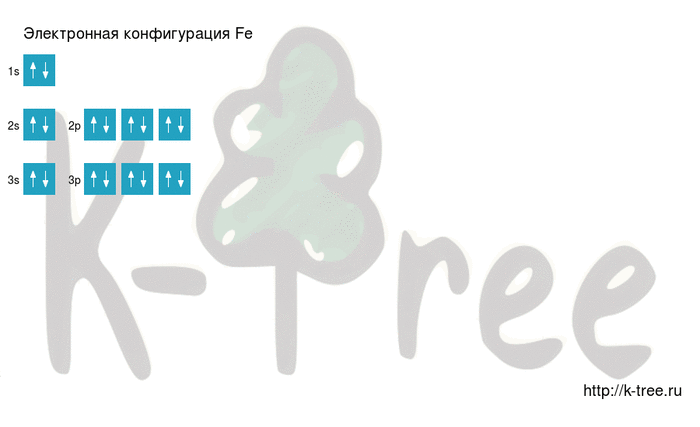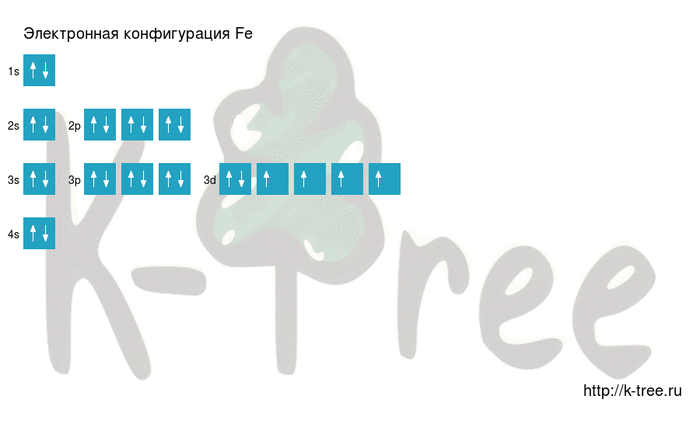Чем можно объяснить особую устойчивость электронной конфигурации fe3
Графическое заполнение валентных энергетических слоев | Электронные конфигурации атомов
в) Электронная конфигурация 3s 2 верна, потому что на третьем энергетическом уровне (n = 3) находятся s-, p- и d-подуровни. Согласно правилу Хунда, на s-подуровне, состоящем из одной атомной орбитали, может находиться максимальное число электронов равное двум.
г) Электронная конфигурация 2s 2 реализуется, потому что на втором энергетическом уровне (n = 2) содержатся s- и p-подуровни, и на s-подуровне, в его единственной атомной орбитали, может содержаться максимальное число электронов равное двум.
д) Электронная конфигурация 2d5 не реализуется, потому что во втором энергетическом уровне (n = 2) d-подуровень не содержится, в этом слое расположены только s- и p-подуровни.
е) Электронная конфигурация 5d 2 реализуется, потому что на пятом энергетическом уровне (n = 5) содержатся s-, p- d- и f-подуровни. Подуровень d содержит пять атомных орбиталей, в которых может находиться максимальное число электронов равное десяти (5 . 2 = 10). Запись 5d 2 означает, что на 5d-подуровне содержится два неспаренных электрона.
ж) Электронная конфигурация 3f 12 не реализуется, потому что на третьем энергетическом уровне (n = 3) могут находиться только s-, p- и d-подуровни.
з) Электронная конфигурация 2p4 реализуется, потому что на втором энергетическом уровне (n = 2) могут находиться только s- и p-подуровни. Подуровень p состоит из трёх атомных орбиталей, на которых, согласно правилу Хунда, может находиться до шести электронов.
и) Электронная конфигурация 3p7 не реализуется, потому что на p-подуровне, состоящем из трёх атомных орбиталей, согласно правилу Хунда, максимальное число электронов равно 6.
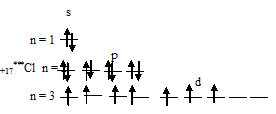
Таким образом, внешний энергетический уровень атома хлора имеет свободные орбитали на 3d-подуровне, что позволяет электронам переходить в возбуждённое состояние (перемещаться на более высокие свободные орбитали). У атома хлора возможно три состояния перемещения электронов на более высокие свободные орбитали, электроны с s- и p-подуровней переходят на 3d-подуровень:
1) При затрате некоторой энергии один из 3p-электронов атома хлора может быть переведён на вакантную 3d-орбиталь, при этом энергия атома возрастает, так что возникающая электронная конфигурация (1s 2 2s22p 6 3s 2 3p 4 3d 1 ) соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
В данном случае 3d-подуровень содержит четыре вакантные орбитали возбуждённого атома хлора.
2) При затрате некоторой энергии два из 3p-электронов атома хлора могут быть переведены на вакантные 3d-орбитали, при этом энергия атома возрастает, так что возникает электронная конфигурация (1s 2 2s 2 2p 6 3s 2 3p 3 3d 2 ), которая соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
В таком возбуждённом состоянии атом хлора содержит три вакантные 3d-орбитали.
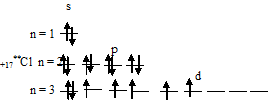
3) При затрате некоторой энергии один из 3s- и два 3p-электронов могут быть переведены на свободные 3d-орбитали, при этом энергия атома возрастает, так что возникающая конфигурация (1s 2 2s 2 2p 6 3s 1 3p 3 3d 3 ) также соответствует одному из возможных состояний хлора:
В возбуждённом состоянии атома ванадия один 4s-электрон может быть переведён на свободную 3d-орбиталь, так что возникающая электронная конфигурация валентного уровня (3d 4 4s 1 ) соответствует возбуждённому состоянию атома ванадия, что можно представить в виде схемы:
При возбуждении атома ванадия остаётся вакантной одна 3d-орбиталь.
При возбуждении атома марганца один s-электрон переходит на 3d-орбиталь, при этом получается электронная конфигурация валентного уровня (3d 6 4s 1 ) соответствует возбуждённому состоянию атома марганца, что можно представить в виде схемы:
Из схемы вытекает, что при возбуждении атома марганца свободных d-орбиталей нет, так как на 3d-подуровне распределяются два спаренных электрона и четыре неспаренных. Таким образом, атом марганца ни в основном, ни в возбуждённом состоянии не имеет свободных d-орбиталей.
Следовательно, атом бора содержит один неспаренный 2p-электрон.
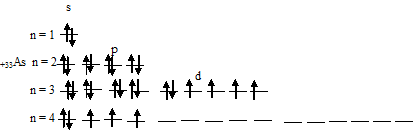
Таким образом, атом мышьяка имеет три неспаренных электрона на 4p-подуровне.
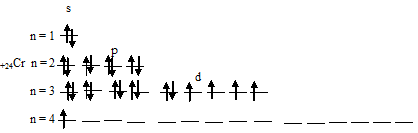
Следовательно, атом хрома в стационарном состоянии содержит шесть неспаренных электронов, из которых пять на 3d-подуровне и один на 4s-подуровне.
Атом ртути не содержит ни одного неспаренного электрона.
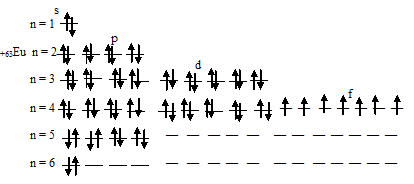
Таким образом, атом европия содержит семь неспаренных 4f-электронов.
Ответ: а) 1; б) 2; в) 3; г) 6; д) 0; е) 7.
Задача 187.
Указать особенности электронных конфигураций меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
Решение:
Так как число электронов в атоме элемента равно его порядковому номеру, то общее число электронов в атоме меди и хрома соответственно равно 29 и 24.
Последовательность заполнения энергетических уровней и подуровней в атоме элемента определяется правилами Клечковского, согласно которым электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией (меньшая сумма n + l). Порядок заполнения подуровней определяется правилом Хунда. Согласно правилу Хунда, минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Электронные формулы атомов хрома и меди можно выразить следующим образом:
Таким образом, атомы хрома и меди на внешних энергетических уровнях содержат по одному 4-электрону. Графические схемы распределения электронов по квантовым ячейкам у атомов хрома и меди в стационарном состоянии будут иметь следующий вид:
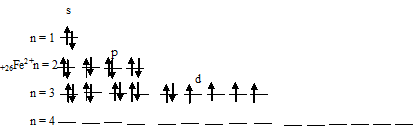
Составить электронно-графические схемы ионов Fe(2+) и Fe(3+). Чем можно объяснить особую устойчивость электронной конфигурации
В 4:21 поступил вопрос в раздел ЕГЭ (школьный), который вызвал затруднения у обучающегося.
Вопрос вызвавший трудности
Ответ подготовленный экспертами Учись.Ru
Для того чтобы дать полноценный ответ, был привлечен специалист, который хорошо разбирается требуемой тематике «ЕГЭ (школьный)». Ваш вопрос звучал следующим образом: Составить электронно-графические схемы ионов Fe(2+) и Fe(3+). Чем можно объяснить особую устойчивость электронной конфигурации иона Fe(3+)?
После проведенного совещания с другими специалистами нашего сервиса, мы склонны полагать, что правильный ответ на заданный вами вопрос будет звучать следующим образом:
НЕСКОЛЬКО СЛОВ ОБ АВТОРЕ ЭТОГО ОТВЕТА:
Работы, которые я готовлю для студентов, преподаватели всегда оценивают на отлично. Я занимаюсь написанием студенческих работ уже более 4-х лет. За это время, мне еще ни разу не возвращали выполненную работу на доработку! Если вы желаете заказать у меня помощь оставьте заявку на этом сайте. Ознакомиться с отзывами моих клиентов можно на этой странице.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
Площадка Учись.Ru разработана специально для студентов и школьников. Здесь можно найти ответы на вопросы по гуманитарным, техническим, естественным, общественным, прикладным и прочим наукам. Если же ответ не удается найти, то можно задать свой вопрос экспертам. С нами сотрудничают преподаватели школ, колледжей, университетов, которые с радостью помогут вам. Помощь студентам и школьникам оказывается круглосуточно. С Учись.Ru обучение станет в несколько раз проще, так как здесь можно не только получить ответ на свой вопрос, но расширить свои знания изучая ответы экспертов по различным направлениям науки.
При заполнении уровня и подуровня устойчивость электронной конфигурации возрастает и
Такие отклонения имеют место во многих случаях:
для d-элементов: Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au;
для f-элементов: La, Gd, Ac, Th, Pa, U, Cm.
Причем нарушение последовательности заполнения АО у актиноидов связано также со сближением 6d- и 5f-подуровней, так что «легкие» актиноиды от Ac до Pu по своим свойствам похожи на d-элементы.
Атомные и ионные радиусы. Размер атомов и ионов не может быть определен точно, так как электронная плотность на их периферии убывает экспоненциально. Поэтому используются так называемые эффективные радиусы (половина расстояния между центрами двух смежных атомов в кристаллах), или орбитальные радиусы атомов (принимают расстояние от ядра до последнего максимума электронной плотности).
Однако закономерности в изменении радиусов атомов и ионов не зависят от способов их определения. Наблюдается периодичность изменения атомных радиусов, особенно у s- и р- элементов. У d- и f- элементов кривая изменения радиусов по периоду имеет более плавный характер.
В одной и той же группе при одинаковом строении внешней валентной оболочки радиусы атомов (или ионов одинакового заряда) возрастают в связи с увеличением числа электронных оболочек. Эта закономерность хорошо выполняется для элементов главных подгрупп (s-, p- элементов).
Орбитальные конфигурации и первые энергии ионизации атомов.Энергия, необходимая для отрыва электрона от атома называется энергией ионизации (I). В результате ионизации атомы превращаются в положительно заряженные ионы:
Э + I1 ® Э + + ē.
Энергия ионизации зависит от электронной конфигурации атома или иона и ее изменение имеет периодический характер.
Энергия ионизации возрастает по периоду (заряд возрастает, радиус уменьшается). В одной и той же группе энергия ионизации уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением атомных радиусов.
Сродство к электрону и электроотрицательность. Энергия, которая выделяется при присоединении электрона к атому, называется сродством к электрону (Eср) (кДж/моль или эВ).
Электроотрицательность.Согласно Полингу, “электроотрицательность есть способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании связи”. Очевидно, у инертных газов электроотрицательность отсутствует, т.к. внешний уровень в их атомах завершен и устойчив. Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов каждой главной подгруппы ПC
(рис. 2.2).
Обычно cизмеряют не в эВ или Дж, а в условных относительных единицах. По шкале Полинга) c (F) принята равной 4,0, а c (Li) = 1.
Пример 3. Учитывая положение в Периодической системе, дать общую характеристику и указать химические свойства фосфора.
Рис. 2.2. Электроотрицательности элементов (по Полингу)
Пример 4. Вывести формулу валентных электронов и графическую электронную формулу элемента, расположенного в 4-м периоде, 5-й группе, побочной подгруппе. Какой это элемент?
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.007 сек.)
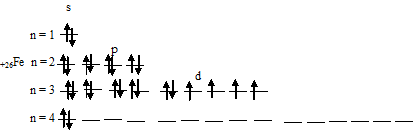
Железо Fe
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
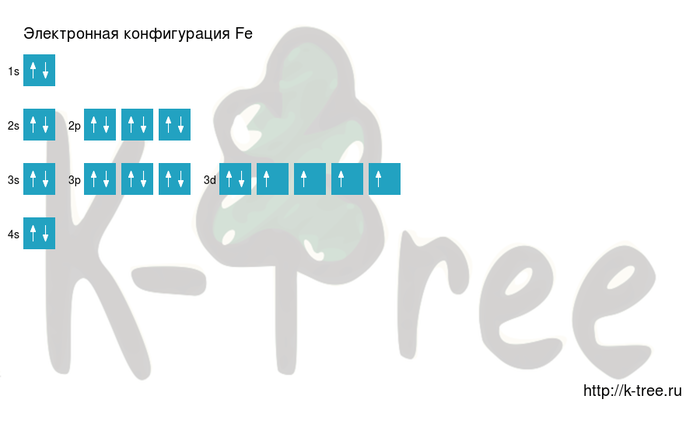
Электронная схема железа
Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Короткая запись:
Fe: [Ar]4s 2 3d 6
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации, для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Графическое заполнение валентных энергетических слоев | Электронные конфигурации атомов
в) Электронная конфигурация 3s 2 верна, потому что на третьем энергетическом уровне (n = 3) находятся s-, p- и d-подуровни. Согласно правилу Хунда, на s-подуровне, состоящем из одной атомной орбитали, может находиться максимальное число электронов равное двум.
г) Электронная конфигурация 2s 2 реализуется, потому что на втором энергетическом уровне (n = 2) содержатся s- и p-подуровни, и на s-подуровне, в его единственной атомной орбитали, может содержаться максимальное число электронов равное двум.
д) Электронная конфигурация 2d5 не реализуется, потому что во втором энергетическом уровне (n = 2) d-подуровень не содержится, в этом слое расположены только s- и p-подуровни.
е) Электронная конфигурация 5d 2 реализуется, потому что на пятом энергетическом уровне (n = 5) содержатся s-, p- d- и f-подуровни. Подуровень d содержит пять атомных орбиталей, в которых может находиться максимальное число электронов равное десяти (5 . 2 = 10). Запись 5d 2 означает, что на 5d-подуровне содержится два неспаренных электрона.
ж) Электронная конфигурация 3f 12 не реализуется, потому что на третьем энергетическом уровне (n = 3) могут находиться только s-, p- и d-подуровни.
з) Электронная конфигурация 2p4 реализуется, потому что на втором энергетическом уровне (n = 2) могут находиться только s- и p-подуровни. Подуровень p состоит из трёх атомных орбиталей, на которых, согласно правилу Хунда, может находиться до шести электронов.
и) Электронная конфигурация 3p7 не реализуется, потому что на p-подуровне, состоящем из трёх атомных орбиталей, согласно правилу Хунда, максимальное число электронов равно 6.
Таким образом, внешний энергетический уровень атома хлора имеет свободные орбитали на 3d-подуровне, что позволяет электронам переходить в возбуждённое состояние (перемещаться на более высокие свободные орбитали). У атома хлора возможно три состояния перемещения электронов на более высокие свободные орбитали, электроны с s- и p-подуровней переходят на 3d-подуровень:
1) При затрате некоторой энергии один из 3p-электронов атома хлора может быть переведён на вакантную 3d-орбиталь, при этом энергия атома возрастает, так что возникающая электронная конфигурация (1s 2 2s22p 6 3s 2 3p 4 3d 1 ) соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
В данном случае 3d-подуровень содержит четыре вакантные орбитали возбуждённого атома хлора.
2) При затрате некоторой энергии два из 3p-электронов атома хлора могут быть переведены на вакантные 3d-орбитали, при этом энергия атома возрастает, так что возникает электронная конфигурация (1s 2 2s 2 2p 6 3s 2 3p 3 3d 2 ), которая соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
В таком возбуждённом состоянии атом хлора содержит три вакантные 3d-орбитали.
3) При затрате некоторой энергии один из 3s- и два 3p-электронов могут быть переведены на свободные 3d-орбитали, при этом энергия атома возрастает, так что возникающая конфигурация (1s 2 2s 2 2p 6 3s 1 3p 3 3d 3 ) также соответствует одному из возможных состояний хлора:
В возбуждённом состоянии атома ванадия один 4s-электрон может быть переведён на свободную 3d-орбиталь, так что возникающая электронная конфигурация валентного уровня (3d 4 4s 1 ) соответствует возбуждённому состоянию атома ванадия, что можно представить в виде схемы:
При возбуждении атома ванадия остаётся вакантной одна 3d-орбиталь.
При возбуждении атома марганца один s-электрон переходит на 3d-орбиталь, при этом получается электронная конфигурация валентного уровня (3d 6 4s 1 ) соответствует возбуждённому состоянию атома марганца, что можно представить в виде схемы:
Из схемы вытекает, что при возбуждении атома марганца свободных d-орбиталей нет, так как на 3d-подуровне распределяются два спаренных электрона и четыре неспаренных. Таким образом, атом марганца ни в основном, ни в возбуждённом состоянии не имеет свободных d-орбиталей.
Следовательно, атом бора содержит один неспаренный 2p-электрон.
Таким образом, атом мышьяка имеет три неспаренных электрона на 4p-подуровне.
Следовательно, атом хрома в стационарном состоянии содержит шесть неспаренных электронов, из которых пять на 3d-подуровне и один на 4s-подуровне.
Атом ртути не содержит ни одного неспаренного электрона.
Таким образом, атом европия содержит семь неспаренных 4f-электронов.
Ответ: а) 1; б) 2; в) 3; г) 6; д) 0; е) 7.
Задача 187.
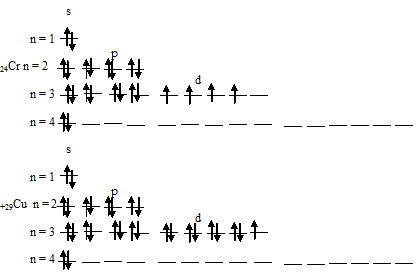
Указать особенности электронных конфигураций меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
Решение:
Так как число электронов в атоме элемента равно его порядковому номеру, то общее число электронов в атоме меди и хрома соответственно равно 29 и 24.
Последовательность заполнения энергетических уровней и подуровней в атоме элемента определяется правилами Клечковского, согласно которым электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией (меньшая сумма n + l). Порядок заполнения подуровней определяется правилом Хунда. Согласно правилу Хунда, минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Электронные формулы атомов хрома и меди можно выразить следующим образом:
Таким образом, атомы хрома и меди на внешних энергетических уровнях содержат по одному 4-электрону. Графические схемы распределения электронов по квантовым ячейкам у атомов хрома и меди в стационарном состоянии будут иметь следующий вид: