Чем можно заменить гипохлорит натрия
Форум химиков
Гипохлорид натрия или обычная хлорка, что лучше?
Гипохлорид натрия или обычная хлорка, что лучше?
Сообщение nayil » Чт фев 26, 2009 8:17 pm
Re: Гипохлорид натрия или обычная хлорка, что лучше?
Сообщение SkydiVAR » Чт фев 26, 2009 8:36 pm
Re: Гипохлорид натрия или обычная хлорка, что лучше?
Сообщение MikolaV » Чт фев 26, 2009 8:54 pm
Re: Гипохлорид натрия или обычная хлорка, что лучше?
Сообщение avor » Чт фев 26, 2009 9:02 pm
Вариант 2. Малоприменим из-за плохой пермешиваемости, а значит отбелка в стиральной машине будет неравномерной(местами густо, до дыр, местами пусто(нет отбелки)). Варенку помните? Вот такой эффект может быть достигнут, только с еще большей неравномерностью. Аналогично из-за плохой растворимости последующая дезактивация(восстановление) избытка активного хлора тоже становится проблематичной процедурой
Вариант 3 а) Дорог б) Не позволяет достичь высоких концентраций активного хлора(тоже мало растворим) Применяется в основном для дезинфекции в медицине.
Вариант 1) по госту или ТУ(точно не помню) содержит активного хлора 70 г/л и по сути является разведенным гипохлоритом натрия с добавками(скажем фосфатов и триполифосфатов натрия)
-не всегда стандартизированное
Активный хлор в варианте 1 и 3 стандартизованы. Про Хлорную известь не знаю и про щелочность врать не буду. В варианте 3 по сравнению с 1 о щелочности вообще говорить трудно.
Другое дело, что содержание активного хлора, как в гипохлорите, так и в белизне(вариант 1) и хлорной извести(Вариант 2) при хранении катастрофически уменьшается и не соответствует паспорту уже через несколько недель хранения.
Поэтому производитель ограничивает их сроки хранения 6 месяцами.
Рубрика технолога: «Все, что нужно знать об отбеливании»
Любые белые ткани с течением времени и при многократной стирке желтеют из-за действия света и солей жесткости. Вернуть таким тканям первоначальную белизну помогают химические отбеливатели.
Вопрос о применении отбеливающих препаратов в процессах профессиональной стирки многократно рассматривался в различной литературе, нормативных документах и статьях. Однако, чем чаще встречаешься с технологами и владельцами прачечных в различных регионах страны, тем больше понимаешь, что до сих пор остаются вопросы по применению не только современных средств для отбеливания, но и классических, давно известных веществ.
Полагаю, целесообразно еще раз вернуться к рассмотрению свойств веществ, используемых в процессах отбеливания белья.
Что было
Можно предположить, что период раннего средневековья не является объектом нашего внимания. Тогда на Руси вместо мыла использовали измельченные ягоды бузины, корни мыльнянки, смешанные с зольным щелоком, а основным отбеливателем было солнце — то есть солнечный свет в ультрафиолетовом диапазоне. По современным меркам это были действительно экологически чистые технологии.
После открытия шведским химиком Карлом Вильгельмом Шееле хлора в 1774 году началось время химических отбеливателей. Они бывают трех типов: пероксидные (перекисные или кислородосодержащие), хлорные и серосодержащие. Применение химических отбеливателей основано на процессе окисления кислородом различных веществ, придающих желтизну ткани.
Более чем двухсотлетнюю историю применения в отбеливании тканей имеет хорошо известный гипохлорит натрия (англ. sodium hypochlorite) — натрий хлорноватистокислый. Историческое название гипохлорита натрия лабарракова вода или жавелевая вода. Гипохлорит натрия относится к химическим хлорным отбеливателям. Химическая формула — NaOCl. Обычно в прачечных применяются его водные растворы различной концентрации.
Хлорные отбеливатели типа гипохлорита натрия, хлорамина, хлорной извести, ди-хлоризоциануратов калия и натрия действуют на холоде. Пользоваться этими дешевыми отбеливателями удобно и просто, они универсальны и могут применяться не только при стирке белья, но для дезинфекции. Однако у них имеются и существенные недостатки: они раздражают кожу рук и сильно снижают прочность ткани. Если капля хлорного отбеливателя попадает на цветное белье, получаются ничем неудаляемые пятна самого неожиданного цвета (например, оранжевые на темно-синем фоне), а неотстиранные жировые загрязнения в хлорном отбеливателе могут приобрести ярко-желтый цвет.
Серосодержащие отбеливатели (например, на основе гидросульфита натрия) при нагревании с водой выделяют сернистый газ. Гидросульфит натрия применяется в текстильной промышленности главным образом как восстановительное средство для кубовых красителей, для восстановительной очистки при крашении полиэфира и для снятия прямых активных красителей при крашении хлопка. Он обесцвечивает не только окрашенные пятна вина, ягод и фруктов, но и цветные изделия. Серосодержащие красители универсальны, могут применяться для обработки любых тканей. Однако против сернистого газа в водной среде не могут устоять даже самые прочные текстильные красители. По этой причине серосодержащие препараты применяются при отбеливании тканей крайне редко.
Что есть
Как это не покажется странным, но за прошедшие годы практически ничего не изменилось. В качестве средств для отбеливания применяются все те же химические отбеливатели. До сих пор действуют Правила технологического процесса обработки белья в прачечных, утвержденные Министерством жилищно-коммунального хозяйства РСФСР от 14 декабря 1972 года (текст документа по состоянию на июль 2011 года).
В этом же документе приводятся нормы расхода отбеливающих средств.
Нормы расхода отбеливающих средств в кг на 1 т сухого белья
| Отбеливающее средство | Количество отбеливающих средств на 1 т сухого белья | |
|---|---|---|
| кг | л | |
| Пергидроль (30-процентный) | 4 | — |
| Перборат | 2 | — |
| Перкарбонат | 2 | — |
| Персульфат | 4 | — |
| Гипохлорит натрия с концентрацией | — | 3,8 |
| 185 г/куб. дм активного хлора | ||
| Гидросульфит натрия | 160 | — |
Позволю себе еще раз остановиться на, казалось бы, хорошо известном и сказать несколько слов о самых широко используемых отбеливающих средствах.
Гипохлорит натрия
В нашей стране состав и свойства гипохлорита натрия нормируются ГОСТом или ТУ и производятся, в зависимости от марки, с массовой концентрацией активного хлора от 120 до 190 г/дм³ и массовой концентрацией щелочи в пересчете на NaOH от 10 до 90 г/дм³. Растворы гипохлорита натрия недостаточно стабильны. Для растворов гипохлорита натрия по ГОСТ 11086-76 допускается потеря активного хлора по истечении 10 суток со дня отгрузки не более 30% первоначального содержания и изменение окраски до красновато-коричневого цвета. А для растворов по ТУ допускается потеря активного хлора по истечении 10 суток со дня отгрузки для марок А и Б не более 30% первоначального содержания, для марок В и Г — не более 20%, для Марки Э — не более 15%.
Гипохлорит натрия различных марок применяют:
Без гипохлорита натрия не обойтись при отбелке больничного белья или белья, пораженного плесенью. Он прекрасно работает при низких температурах (
Перборат натрия, перкарбонат натрия и пероксид водорода
Наиболее распространены кислородсодержащие отбеливатели, которые, так же как и хлорсодержащие, обладают дезинфицирующими свойствами. Выделяемый ими кислород окисляет нестойкие органические соединения, скопившиеся в местах загрязнений. После этого они либо переходят в раствор, либо образуют новые соединения, которые легко удаляются при последующей стирке.
Самым распространенными отбеливателями в синтетических стиральных порошках являются перборат натрия (NaBO3•4H2O) и перкарбонат натрия (Na2CO3•1,5H2O2). Соединяясь с водой, перборат натрия высвобождает перекись водорода. При повышенных температурах (от 600 градусов) перекись водорода распадается на воду и кислород.
В отличие от пербората натрия, перкарбонат натрия не содержит бор, то есть он более экологичен.
В качестве индивидуального отбеливающего вещества, усиливающего эффект стирки, в прачечных применяют или перкарбонат натрия, или пероксид водорода. Последний представляет собой прозрачную негорючую жидкость, способную самопроизвольно разлагаться на воду и кислород. Пероксид водорода коррозионно опасен для большинства металлов.
В промышленных масштабах в нашей стране выпускается пероксид водорода с массовой долей действующего вещества от 30 до 40% (по ГОСТ 177-88 или ТУ). В течение гарантийного срока хранения допускается снижение массовой доли перекиси водорода до 1,5-2,5%.
Обычно пероксид водорода применяют в виде рабочего раствора с концентрацией 6% по активному кислороду. При дозировании в стиральную машину пероксид водорода рекомендуется добавлять во вторую ванну к основному моющему средству при температуре от 60°С при двухванновом способе стирки в концентрации 5-10 млна килограмм белья.
Что же изменилось за время, прошедшее с начала промышленного производства химических отбеливателей? До сих пор в профессиональных прачечных применяются те же вещества, что и более чем сто лет назад. Однако нельзя сказать, что ничего нового не придумано. Так для снижения температуры отбеливания в состав стиральных порошков вводят активатор отбеливателя, самым распространенным из которых является тетраацетилэтилендиамин — ТАЭД. Это позволяет снизить температуру отбеливания до 30-40°С.
Кроме того более 70 лет назад были открыты оптические отбеливатели. В 1929 году Пол Крайс впервые провел эксперимент по отбеливанию волокон натуральным отбеливающим агентом (гликозидом 6,7-дигидроксикумарина), относящимся к группе флуоресцентных отбеливающих веществ. Оптические отбеливатели — это бесцветные или слабоокрашенные органические соединения, обладающие способностью поглощать ультрафиолетовую составляющую солнечного света (300-400 нм) и преобразовывать полученную энергию в видимый свет, преимущественно в голубой или фиолетовой части спектра (400-500 нм). Отбеливающее действие оптических отбеливателей основано на том, что излучаемый ими свет компенсирует недостаток синих лучей в свете, отражаемом материалом (в этом их коренное отличие от химических отбеливателей). В отличие от подсинивания ультрамарином (синькой), при котором уменьшение желтизны происходит из-за частичного поглощения света в желто-красной области спектра, при отбеливании оптическими отбеливателями благодаря флуоресценции резко увеличивается интенсивность отражаемого света в фиолетово-синей части спектра, что особенно проявляется при дневном свете и ультрафиолетовом освещении.
Происходят изменения и в оборудовании. Меняется экологическое законодательство, актуальными становится технологии стирки и отбеливания, позволяющие осуществлять экономию воды, электроэнергии и других ресурсов.
Что будет
Сегодня на фоне изменения ассортимента изделий и состава тканей отчетливо просматривается тенденция применения экологичных моющих и отбеливающих препаратов и снижения температуры стирки.
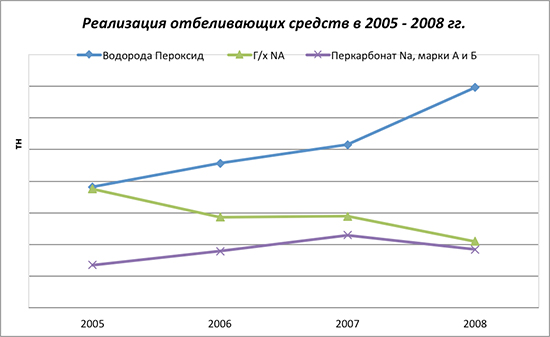
На диаграмме реализации средств для отбеливания компанией «УНИВЕРСАЛ» можно увидеть изменения в потреблении отбеливающих препаратов за последние несколько лет. Так, отчетливо виден рост потребления пероксида водорода и перкарбоната при уменьшении потребления гипохлорита натрия (г/х Na).
В будущем представляется наиболее перспективным все более широкое применение препаратов для отбеливания, основанных на действии надкислот. Из них наиболее известны — это препараты на основе перуксусной (надуксусной) кислоты.
Надуксусная кислота (пероксиуксусная кислота, перуксусная кислота, НУК) — химическое соединение, органическая надкислота с формулой СН3СО3Н. Она представляет собой бесцветную жидкость с резким запахом, относится к группе сильных окислителей. Перуксусная кислота в товарном виде существует в виде равновесной четырехкомпонентной смеси, состоящей из уксусной и перуксусной кислот, пероксида водорода и воды. Перуксусная кислота содержит пероксидную функциональную группу, поэтому по химическим свойствам схожа с перекисью водорода. Механизм отбеливания при применении перуксусной кислоты аналогичен механизму отбеливания перекисью водорода в щелочной среде. Известно, что при этом почти не происходит деструкции целлюлозы хлопкового волокна, достигается высокая капиллярность и более устойчивая белизна, обеспечивается устойчивость отбеливающих растворов и появляется возможность отбеливания тканей при низких температурах.
На российском рынке уже присутствуют средства на основе надуксусной (перуксусной) кислоты, применяемые для отбеливания (в том числе низкотемпературного) в процессе стирки. Они подходят как для белых, так и для окрашенных тканей, для отбеливания шерстяных тканей и цветного льна. Обычно подобные препараты представляет собой высококонцентрированные средства, обладающие хорошими отбеливающими, пятновыводящими и дезинфицирующими свойствами. Препараты на основе перуксусной кислоты после применения разлагаются на воду, кислород и уксусную кислоту, которая в дальнейшем распадается на углекислый газ и воду, обеспечивая экологическую безопасность. Дозируются они в зависимости от степени загрязнения: от 2 мл до 5 мл на 1 кг сухого белья.
Однако появление подобных препаратов никак не исключает применение и других ранее описанных отбеливающих средств. Сегодня компания «УНИВЕРСАЛ» поставляет своим заказчикам весь ассортимент отбеливающих препаратов для профессиональной стирки: перкарбонат натрия, гипохлорит натрия и пероксид водорода и др. А линейка препаратов для стирки под торговой марки «УНИВЕР» включает в себя препараты для отбеливания белья на основе всех имеющихся отбеливающих веществ, включая перуксусную кислоту. Качество всей продукции обеспечивается за счет осуществления постоянного контроля как на предприятиях-изготовителях, так и в наших двух собственных лабораториях. Одна из них находится непосредственно на складе готовой продукции, что позволяет нам оперативно реагировать на любые внештатные ситуации. Таким образом компания «УНИВЕРСАЛ» поставляет заказчикам только продукты гарантированного качества.
Хочется надеяться, что очередной возврат к известной теме будет полезен технологам профессиональных прачечных и читателям журнала.
Марина Галаничева,
руководитель направления технологий и разработки компании «Универсал»,
к.т.н.
Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Журнал «Сырье и Упаковка»
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
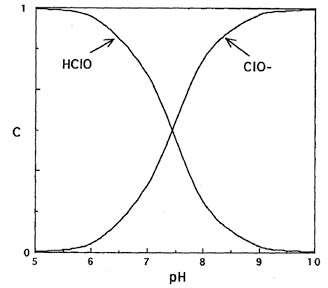
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
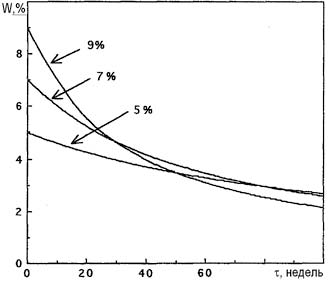
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
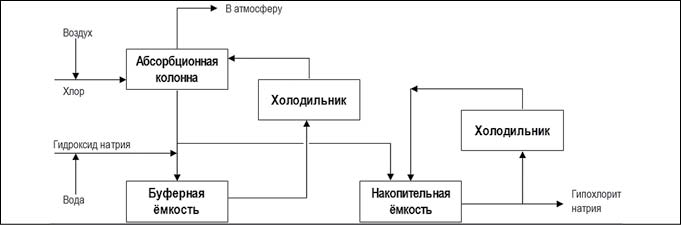
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
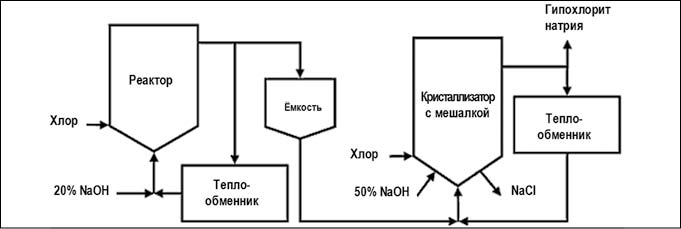
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76