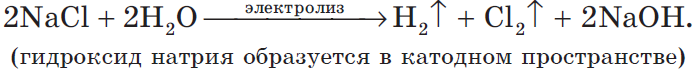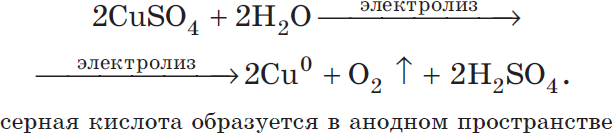Что образуется на аноде что образуется на катоде
Электролиз
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
2H2O +2ē → H2 + 2OH —
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
Me n+ + nē → Me 0
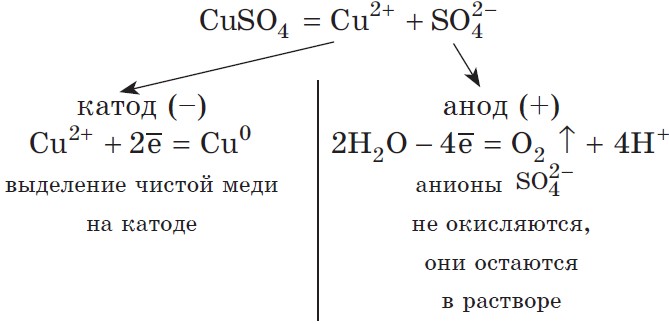
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
2H + + 2ē → H2 0
Анодные процессы
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
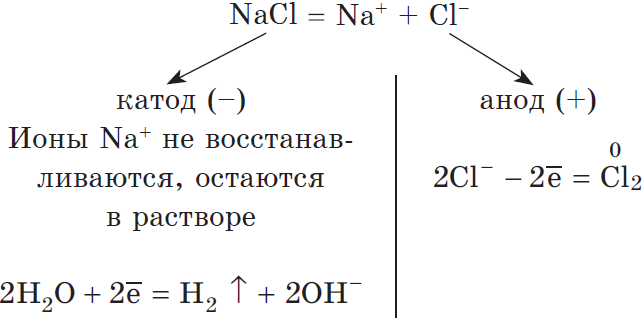
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
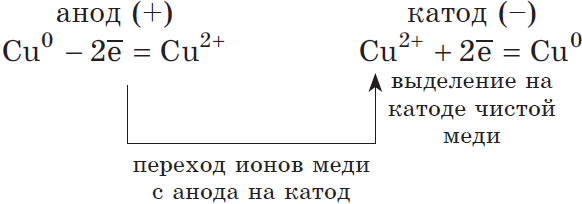
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Электролиз расплавов и растворов
Теория к заданию 22 из ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
2. Процесс на аноде зависит от материала анода и от природы аниона.
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
2) Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
Суммарное ионное уравнение:
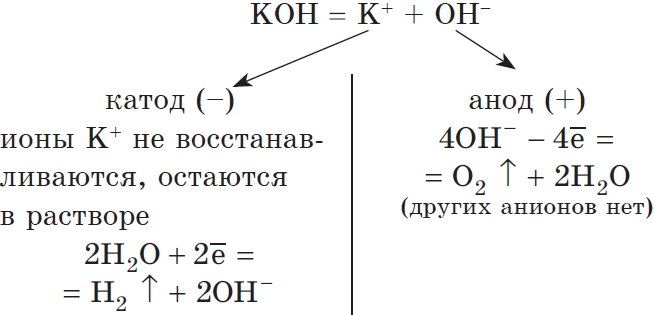
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
Электролиз расплавов и растворов веществ широко используется в промышленности:
Электролиз солей
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Электролиз расплава NaCl
Аналогично происходит миграция ионов Cl — к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения