Что образуется при диссоциации соляной кислоты
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация оснований
Примеры уравнений диссоциации щелочей:
Многокислотные основания диссоциируют ступенчато:
Диссоциация амфотерных оснований (амфолитов)
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Na 3 PO 4 →3Na + + PO 3- 4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Диссоциация оснований, кислот, солей
Урок 35. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Диссоциация оснований, кислот, солей»
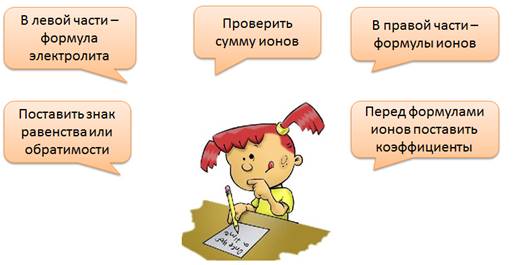
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
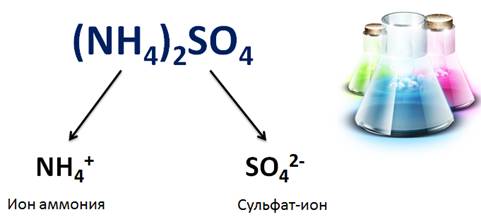
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4 + ), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
Диссоциация кислот
При диссоциации кислот роль катионов играют ионы водорода (H + ), других катионов при диссоциации кислот не образуется:
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляеют кислотный остаток.
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато: сначала отщепляется один ион водорода, затем другой (третий).
Ступенчатая диссоциация двухосновной кислоты:
Ступенчатая диссоциация трехосновной кислоты:
Диссоциация оснований
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными (см. Кислотно-основные реакции).
Диссоциация Zn(OH)2, как основания:
Диссоциация Zn(OH)2, как кислоты:
Диссоциация солей
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Классификация диссоциации солей:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Что образуется при диссоциации соляной кислоты
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
I. Электролитическая диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
1. Электролитическая диссоциация одноосновных кислот
Кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды.
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H + + Cl —
2. Электролитическя диссоциация многоосновных кислот
Многоосновные кислоты диссоциируют ступенчато.
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
II — я стадия диссоциации
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
НРО 2- 4 ↔ Н + + PО4 З- (третья ступень) – ортофосфат ион
II. Электролитическая диссоциация оснований
Диссоциация амфотерных оснований (амфолитов)
Щёлочи – это основания, растворимые в воде
Это основания щелочных и щелочноземельных металлов :
LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также NН4ОН
Примеры уравнений диссоциации щелочей
Многокислотные основания диссоциируют ступенчато:
Примеры уравнений диссоциации амфолитов
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением:
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
III. Электролитическая диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH + 4) и анионы кислотных остатков.
Например, диссоциация средних солей :
Кислые же и основные соли диссоциируют ступенчато:
Диссоциация кислых солей
Диссоциация основных солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
IV. Тренажеры
Интерактивное задание LearningApps.org по теме: “Химические свойства растворов кислот»
V. Памятки
Памятка – Определение солей
VI. Задания для закрепления
Задание №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Задание №2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: Ca(OH)2, Na2CO3, Na3PO4, HNO3, KOH, Ba(OH)2, H2SO3, Ca(NO3)2, Ca3(PO4)2, H2S, NaOH, HBr
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе: