Что образуется при разряде аккумулятора
Теория работы свинцово-кислотного аккумулятора
В свинцово-кислотном аккумуляторе основные продукты реакции, происходящие между положительным и отрицательным электродами аккумулятора в водном растворе серной кислоты, подчиняются так называемой теории двойной сульфатации в соответствии с уравнением:
…⇐ заряд
Pb + PbO2 + 2H2SO4 ⇐ ⇒ 2PbSO4 + 2H2 O (1)
…разряд ⇒
Этому соотношению подчиняется взаимодействие активных веществ в аккумуляторе во время разряда, заряда, подзаряда, а также во время бездействия (холостого хода).
Основные соотношения между реагентами при бездействии (при разомкнутой внешней цепи аккумулятора) определяются следующими реакциями:
— на отрицательном электроде:
2H+ + 2e- ⇒ H2 ↑ анодная полуреакция
Pb + SO42- ⇒ PbSO4 + 2e- катодная полуреакция
Pb + H2 SO4 ⇒ PbSO4 + H2 ↑ общая реакция (2)
— на положительном электроде:
PbO2 + 4H+ + SO42- + 2e- ⇒ PbSO4 + 2H2 O катодная полуреакция
H2 O ⇒ 1/2 O2 ↑ + 2H+ + 2e- анодная полуреакция
PbO2 + H2 SO4 + H2O ⇒ PbSO4 + 2H2 O + 1/2 O2 ↑ общая реакция (3)
Приведенные уравнения реакций на отрицательном и положительном электродах показывают, что даже при разомкнутой внешней цепи аккумулятора в нем происходит образование сульфата свинца на обоих электродах, снижение плотности электролита, а также разложение воды с выделением газообразных водорода и кислорода, что приводит, таким образом, к снижению емкости аккумулятора, т.е. к саморазряду. Объем продуктов этих реакций зависит от концентрации серной кислоты (плотности электролита), температуры, состава сплава решеток и активной массы электродов, возраста аккумулятора и других причин.
При подключении к аккумулятору нагрузки токообразующий процесс подчиняется уравнению (1) для фазы разряда. На отрицательном электроде (на границе раздела свинец — сульфат свинца) происходит образование электронов, поступающих во внешнюю цепь:
PbO2 + 4H+ + 2e- ⇒ Pb2+ + 2H2 O
Анионы свинца, связываясь с кислотным остатком, образуют на обоих электродах сульфат свинца, покрывающий поверхность активных масс пластин. По мере разряда концентрация серной кислоты в электролите убывает.
При подключении аккумулятору зарядного устройства токообразующий процесс проходит согласно уравнению (1) для фазы заряда.
На отрицательном электроде анионы свинца, образованные из сульфата свинца при растворении в электролите, связываются с электронами, поступающими из внешней цепи, образуя чистый (губчатый) свинец:
На положительном электроде процесс протекает согласно реакции (4) с образованием на электроде окиси свинца и отдачи во внешнюю цепь электронов:
Pb2+ + 2H2 O ⇒ PbO2 + 4H+ + 2e- (4)
По мере заряда увеличивается напряжение поляризации аккумулятора, и, когда оно превысит величину перенапряжения по кислороду, на положительном электроде начинает выделяться кислород:
2OH— ⇒ 1/2 O2 ↑ + H2 O + 2e-
Когда напряжение поляризации превысит величину перенапряжения по водороду, на положительном электроде начинается образование водорода:
Таким образом, при заряде наряду с образованием на электродах исходных продуктов (свинца и окиси свинца) происходит повышение плотности электролита за счет восстановления серной кислоты, а на последней стадии заряда при повышенном напряжении часть подводимого электричества идет на разложение воды:
Из других побочных реакций на положительном электроде при заряде следует обратить внимание на образование озона и на окисление (коррозию) решетки, что оказывает решающее влияние на сокращение срока службы аккумулятора.
Как работает аккумулятор. Принцип работы аккумуляторной батареи (АКБ) простыми словами
Аккумулятор или сокращённо (АКБ), это основное и необходимое устройство в любом автомобиле. Каждый водитель знает, что серце его машины — это конечно же аккумулятор, и нет таких машин с двигателем внутреннего сгорания, где бы его не было. Как бы это устройство не менялось за 150 лет с момента его изобретения, принцип работы аккумуляторной батареи остался низменным. Однако, современность внесла серьёзные коррективы в технологические процессы их изготовления. В этой статье вы ознакомитесь с и используемыми материалами, из чего состоит аккумулятор и как он работает. Итак, как работает аккумулятор (АКБ)?
Понятие аккумулятор и его устройство
В общем понимании этого слова в технике под термином «Аккумулятор» подразумевается устройство, позволяющие при разных условиях эксплуатации накапливать определенный вид энергии, либо же — расходовать ее для человеческих нужд.
Применимы в тех ситуациях, когда необходимо собрать энергию за определенное время, после чего использовать ее для совершения больших трудоемких процессов. Так — гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по такому же принципу: когда вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а после отдают его подключенным приборам для совершения дальнейшей работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
В процессе работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
Узнайте больше о самовозобновляемой и бесплатной энергии будущего. Солнечные батареи в действии.
На рисунке ниже изображена схема устройства аккумулятора. Изображен тот вид, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
Как работает аккумулятор (АКБ) при разряде
В момент, когда к электродам подключена нагрузка в виде лампочки, создается замкнутая электрическая цепь, через которую протекает ток разряда. Его формированию способствует движение электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
В данном примере в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
Работа аккумулятора при заряде
Беря за основу отключенную нагрузку на клеммы пластин, подаем постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.
Таким образом мощность зарядного устройства всегда больше, чем та, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. Это приводит к изменениям внутренних химических процессов между электродами и электролитом. К примеру на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов (как работает аккумулятор)
Параллельное соединение (как работает аккумулятор)
Величина разряда тока, зависит от многих факторов, хотя в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Чтобы зарядить такую конструкцию потребуется поднять мощность источника. Этот способ используется редко для готовых конструкций, в настоящее время куда проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
Последовательное соединение (как работает аккумулятор)
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. На самом деле этот диапазон гораздо шире. И многим электрическим приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, делают это зачастую в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.
Часто среди водителей транспорта, под понятием «аккумулятор» принято понимать любое устройство, независящее от количества его составных элементов — банок. Это не является правильным. Собранная из нескольких последовательно подключенных банок конструкция считается уже батареей, за которой закрепилось сокращенное название «АКБ». Ее внутреннее устройство показано на рисунке.
Любая банка состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Благодаря соединению пластин в блоки увеличивается их рабочая площадь. Это снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
Компоновка АКБ
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами. Они обычно имеют конусную форму, для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». При этом есть одно правило: во избежании ошибок при подключении, диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки помещена заливная горловина, чтобы контролировать уровень электролита либо доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, предохраняющая внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Для того, чтобы предотвратить бурное выделение газов из электролита, который возможен при интенсивной езде, в пробках делаются отверстия для предотвращения повышения давления внутри банки. И через эти отверстия выходят кислород и водород, а также пары электролита. Такие ситуации, связанные с чрезмерными токами заряда, желательно избегать.
На том же рисунке выше показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, что сопровождается изменением химического состава активной массы электродов с выделением или поглощением в электролит (серную кислоту) воды.
Этим явлением можно объяснить повышение удельной плотности электролита при заряде, а так же снижение при разряде батареи. Иными словами, величина плотности дает возможность оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
В состав электролита кислотных батарей входит дистиллированная вода. Она же при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Виды аккумуляторов
Классификация АКБ по составу активного вещества
Свинцовые пластины, используемые в старых аккумуляторах перестали устраивать потребителей. Таким образом, возникала необходимость по улучшению качества работы АКБ. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, характерной чертой которых является более редкий процесс долива воды.
При использовании металлического кальция для покрытия пластин появились кальциевые энергосберегающие источники. В предыдущих моделях потери воды из-за электролиза на 12 вольт нуждались в постоянном доливе, а кальций позволил повысить этот порог до 16 вольт. Так появилась возможность в производстве необслуживаемых аккумуляторов и использовать герметичный, неразборной корпус.
Виды АКБ
Классификация батарей по типу электролита
Электролиты бывают кислотными и щелочными.
Щелочные растворы применяются в заправке аккумуляторных батарей. Щелочные аккумуляторные жидкости этот такие жидкости, которые проявляют большую активность по отношению к металлам и кислотам. При реакциях с кислотами образуются соль и вода. Растворы щелочей подвергаются гидролизу. Химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электрической энергии в аккумуляторе.
Кислотные смеси с дистиллированной водой применяются в основном в автомобильных аккумуляторах. Составы этого типа легко можно приобрести в специализированных магазинах либо, при желании, приготовить самостоятельно на дому. На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке его приготовление так же возможно при соблюдении обязательных пропорций и правил техники безопасности. Для этого нужно смешать кислоту с дистиллированной водой.
Как работает аккумулятор — АКБ
Принцип работы аккумулятора основан на электрохимической реакции окисления свинца в растворе серной кислоты и воды.
При разрядке батареи на положительной пластине происходит окисление металлического свинца, в то время, как на отрицательной пластине восстанавливается уже диоксид свинца.
При зарядке происходит обратный процесс, количество диоксида свинца на отрицательной пластине уменьшается, а на положительной пластине увеличивается количество металла.
Так же при разрядке АКБ уменьшается количество серной кислоты в электролите и увеличивается количество воды. А при зарядке происходит обратный процесс.
Материалы АКБ
Пластины
На данный момент наиболее качественные батареи потерпели небольшие изменения. И связаны эти изменения с материалом пластин. Теперь пластины делают не из чистого свинца, а из его сплава с серебром. При этом удалось снизить массу батареи на треть, а срок её службы увеличить на 20 %.
Кроме этого, изменилась сама технология их изготовления. Если первые пластины производились путём их литья, то сегодня их делают из тонкого свинцового листа, путём штамповки. Такой метод дешевле и при этом пластины получаются прочнее и тоньше.
Сепараторы
Одной из причин выхода АКБ из строя является короткое замыкание положительных и отрицательных пластин.
Когда из пластин осыпается активная зона внизу банок происходит замыкание. Чтобы этого не случилось на помощь приходят сепараторы, которые делают в виде конвертов, запаянных снизу, под пластинами. Таким образом, когда активная зона осыпается она остаётся внутри конверта и не замыкает.
Литий-ионные аккумуляторы
Эти батареи получили широкое распостранение благодаря мобильным телефонам и иным гаджетам. Сегодня же, существуют разработки и для автомобилей. Однако, невзирая на все свои достоинства, в автотехнике данный вид АКБ не прижился из-за ряда принципиальных недостатков.
Электролит
Как было указано выше, электролит представляет собой раствор серной кислоты и воды. Под действием низких температур, известно, что вода замерзает, однако с электролитом этого не происходит.
Но тем не менее она заметно загустевает и теряет свои свойства, из-за чего ёмкость батареи заметно снижается. Что бы избежать этого, сегодня, в электролит добавляют разнообразные присадки.
Гелевые электролиты
Их по праву можно считать вершиной эволюции кислотных батарей. Такие АКБ называются попросту, гелевыми. В этих устройствах электролит модифицирован настолько, что представляет собой нечто наподобие желе.
Такая модификация, в комплексе с другими вышеописанными инновациями дала поистине волшебные результаты. В итоге батареи стали практически вечными, невосприимчивыми к переворачиванию, практически не теряющими свои свойства зимой и при этом на много легче по массе.
Графен-полимерные аккумуляторы
Это, пожалуй, самые перспективные батареи для использования, как в автомобилях, оснащённых ДВС, так и электрической силовой установкой. В производстве этих АКБ использованы нанотехнологии.
Принцип работы этих поистине чудесных аккумуляторов заключается в следующем: их ёмкость, практически в три раза больше литий-ионных и при этом имеет меньшую стоимость, поскольку в их производстве не используется дорогостоящий литий. Кроме этого они не теряют своих свойств под действием низких температур.
Основные технические характеристики аккумуляторов
Номинальная емкость аккумулятора
Номинальная емкость элемента – способность накапливать и отдавать электроэнергию постоянного тока, определяет время автономной работы ИБП. Емкость электрического аккумулятора показывает время питания подключенной к нему нагрузки.
Важно! Полностью емкость не характеризует энергию аккумулятора, то есть энергию, которая может быть накоплена в полностью заряженном аккумуляторе. Чем больше напряжение аккумулятора, тем больше накопленная в нем энергия.
Емкость всегда указывается на корпусе АКБ, а также на упаковке. Именно по этому критерию, большинство пользователей выбирают нужную модель.
Пусковой ток
Полярность
Порядок расположения на крышке аккумулятора присоединительных клемм, которые являются токовыводящими соединительными элементами, называется полярностью. Имеет два полюса – положительный и отрицательный и варианты расположения – прямое и обратное.
Прямая полярность – отечественная разработка. Дла ее определения нужно повернуть аккумулятор таким образом, чтобы этикетка была перед глазами. При расположении плюсовой клеммы слева, а минусовой справа, можно утверждать, что АКБ с прямой полярностью. На иномарках устанавливаются аккумуляторные батареи обратной полярности.
Устройство корпуса
Европейский тип корпуса характерен тем, что АКБ клеммы находятся в углублении, их верхний край не выступает над плоскостью крышки. В некоторых случаях клеммы дополнительно защищаются от внешнего воздействия специальными крышечками. Азиатский тип корпуса – это коробка, на которой клеммы расположились на верхней крышке. Верхний край клемм является самой высокой точкой аккумулятора.
Российский стандарт АКБ
| Обозначение | Описание букв |
| А | АКБ имеет общую крышку для всего корпуса |
| З | Корпус батареи залит и она является полностью заряженной изначально |
| Э | Корпус-моноблок АКБ выполнен из эбонита |
| Т | Корпус-моноблок АБК выполнен из термопластика |
| М | В корпусе использованы сепараторы типа минпласта из ПВХ |
| П | В конструкции использованы полиэтиленовые сепараторы-конверты |
Тип крепления аккумулятора
Особое внимание при выборе АКБ следует уделять типу крепления АКБ, при котором батарея может крепиться снизу или сверху. С помощью специальной монтажной рамки, которая охватывает аккумулятор, элемент крепится вверху. Крепление аккумулятора происходит с помощью планки и двух шпилек. Чаще всего такой вид установки и фиксации аккумуляторной батареи встречается на автомобилях китайского или корейского производства.
Нижнее крепление применимо на европейских автомобилях. На нижней части корпуса АКБ находится выступ. За этот выступ аккумулятор прижимается к платформе с помощью пластины и винта.
Заключение
Теперь вы знаете, как работает аккумулятор. Его роль в работе приборов трудно оспорить. Данный источник энергии применяться почти во всех отраслях. Что доказывает его значимость и необходимость знаний о принципе работы АКБ. А также ее внутреннем содержимом. Аккумуляторы широко используются в автомобилях, разнообразных электроприборах, кондиционерах, мультимедийных центрах. Там, где, генераторы не всегда справляются с обеспечением их энергией. И тогда в «игру» вступает АКБ, которая кроме подпитки энергией еще и выполняет основную функцию, обеспечивая электроэнергией стартер двигателя. Водителю необходимо знать, как устроен аккумулятор. Ведь в нужное время придется устранять сбои в работе источника энергии. К тому же, важно иметь представление о назначении и видах аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю.
§42. Кислотные аккумуляторы
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от

постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
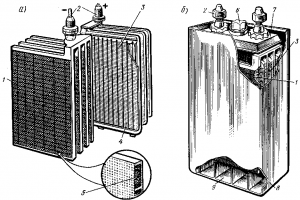
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемые расширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя

пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04— со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при

неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.


