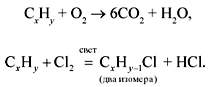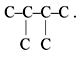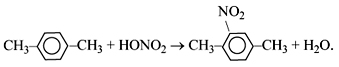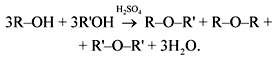Что образуется при сгорании углеводорода
Большая Энциклопедия Нефти и Газа
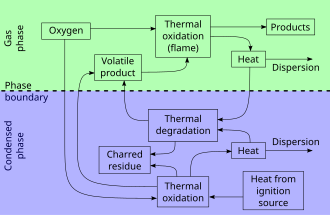
При диффузионном горении и горении гомогенных ( предварительно перемешанных) смесей с участием органических соединений протекают сложные химические процессы. В пламенах предварительно перемешанных смесей и в диффузионных пламенах органических соединений ( не содержащих в своем составе кислорода) отсутствуют окисленные углеводороды. Это свидетельствует о том, что процесс горения углеводородов отличается от предложенных в литературе схем низкотемпературного окисления этих соединений. Подобное предположение высказано еще в работе [21] при анализе результатов исследования диффузионного пламени парафиновой свечи. [7]
Для этого перекрывают кран 36 на сообщение трубки 18 с сосудом 5, заполненным раствором едкого кали. Первое прокачивание газа делают медленно, как это указано для сжигания водорода. Все последующие прокачивания проводят с обычной скоростью. Образующийся в процессе горения углеводородов углекислый газ тотчас же поглощается раствором едкого кали. Прокачивание повторяют до постоянства объема, после чего печь выключают и снимают с трубки. Последнюю охлаждают влажным полотном до комнатной температуры. Чтобы освободить газ от кислорода, который мог выделиться в результате термического разложения окиси меди, его вновь прокачивают через охлажденную трубку, затем через раствор пирогаллола и замеряют его объем. Уменьшение объема газа принимают за объем суммы предельных углеводородов. [9]
Из будущих применений спектроскопии к вопросам горения следует особо выделить изучение динамики процесса. Весьма вероятно, что очень существенными окажутся вопросы о деталях протекания столкновения, о зависимости вероятности осуществления данного элементарного акта от электронной конфигурации сталкивающихся частиц и о характере продуктов реакции. Мы уже видели, что молекулы С02, образующиеся при реакции нормальных молекул окиси углерода и атомов кислорода, первоначально находятся в возбужденном электронном состоянии и что даже после потери энергии электронного возбуждения молекула С02 сохраняет некоторый избыток колебательной энергии, который существенно влияет на весь процесс горения. Во всех насыщенных углеводородах и, вообще говоря, во всех органических соединениях углерод четырехвалентен, тогда как в СО и, вероятно, в GH, С2 и некоторых других радикалах он двухвалентен. Таким образом, в ходе процесса горения углеводородов атомы углерода до своего перехода в конечный продукт С02 могут несколько раз изменить свою валентность, что может усложнить механизм горения. Развитию работ в этом направлении должно предшествовать серьезное исследование электронных структур многоатомных молекул и взаимодействия между электронными конфигурациями различного типа. Большое количество статей, посвященных электронным структурам различных классов многоатомных молекул, было опубликовано за последние годы Мэлликеном ( в Phys. Следует надеяться, что эти результаты смогут быть со временем использованы для выяснения деталей кинетики процессов горения. [10]
СОДЕРЖАНИЕ
Полное и неполное
Полный
Горение не обязательно способствует максимальной степени окисления и может зависеть от температуры. Например, триоксид серы не образуется количественно при сжигании серы. НЕТ
Икс виды появляются в значительных количествах при температурах выше примерно 2800 ° F (1540 ° C), и больше производятся при более высоких температурах. Количество NO
Икс также является функцией избытка кислорода.
Количество воздуха, необходимое для полного сгорания, называется чистым воздухом. Однако на практике используется воздух в 2-3 раза больше, чем чистый воздух.
Неполный
При неполном сгорании образуется окись углерода.
Проблемы, связанные с неполным сгоранием
Проблемы со здоровьем человека:
Вдыхание угарного газа вызывает головную боль, головокружение, рвоту и тошноту. Если уровень окиси углерода достаточно высок, люди теряют сознание или умирают. Воздействие умеренного и высокого уровня окиси углерода в течение длительного времени положительно коррелирует с риском сердечных заболеваний. Люди, пережившие тяжелое отравление угарным газом, могут страдать от долговременных проблем со здоровьем. Окись углерода из воздуха абсорбируется в легких, а затем связывается с гемоглобином в красных кровяных тельцах человека. Это снизит способность красных кровяных телец переносить кислород по всему телу.
Тлеющий
Стремительный
Спонтанный
Турбулентный
Микрогравитация
Микро-горение
Химические уравнения
Стехиометрическое горение углеводорода в кислороде
Обычно химическое уравнение для стехиометрического горения углеводорода в кислороде имеет следующий вид:
Например, стехиометрическое горение пропана в кислороде составляет:
Стехиометрическое горение углеводорода на воздухе
Например, стехиометрическое горение пропана ( ) на воздухе: C 3 ЧАС 8 <\ displaystyle <\ ce
Стехиометрический состав пропана в воздухе составляет 1 / (1 + 5 + 18,87) = 4,02% об.
Стехиометрическая реакция горения C α H β O γ в воздухе:
Стехиометрическая реакция горения для C α H β O γ S δ :
Стехиометрическая реакция горения для C α H β O γ N δ S ε :
Стехиометрическая реакция горения для C α H β O γ F δ :
Следы продуктов сгорания
Неполное сгорание углеводорода в кислороде
Когда z падает ниже примерно 50% стехиометрического значения, CH
4 может стать важным продуктом горения; когда z падает ниже примерно 35% стехиометрического значения, элементарный углерод может стать стабильным.
Этих трех уравнений недостаточно для расчета состава дымовых газов. Однако в положении равновесия реакция конверсии водяного газа дает другое уравнение:
Жидкое топливо
Газообразное топливо
Твердое топливо
Акт горения состоит из трех относительно разных, но перекрывающихся фаз:
Управление горением
В идеальной печи поток воздуха для горения будет согласован с потоком топлива, чтобы дать каждой молекуле топлива точное количество кислорода, необходимое для полного сгорания. Однако в реальном мире горение не происходит идеально. Несгоревшее топливо (обычно CO и H
2 ), выбрасываемый из системы, представляет собой потерю теплотворной способности (а также угрозу безопасности). Поскольку горючие вещества в отходящем газе нежелательны, а присутствие в нем непрореагировавшего кислорода представляет минимальные проблемы безопасности и защиты окружающей среды, первый принцип управления горением заключается в обеспечении большего количества кислорода, чем теоретически необходимо для обеспечения сгорания всего топлива. Для метана ( CH
4 ) для горения, например, требуется чуть больше двух молекул кислорода.
Соблюдению этих двух принципов способствует обеспечение баланса материала и тепла в процессе сгорания. Материальный баланс напрямую связывает соотношение воздух / топливо в процентах от O
2 в дымовом газе. Тепловой баланс связывает тепло, доступное для заряда, с общим чистым теплом, произведенным при сгорании топлива. Дополнительные материальные и тепловые балансы могут быть выполнены для количественной оценки теплового преимущества от предварительного нагрева воздуха для горения или его обогащения кислородом.
Механизм реакции
Подробное описание процессов горения с точки зрения химической кинетики требует формулировки больших и сложных сетей элементарных реакций. Например, при сжигании углеводородного топлива обычно участвуют сотни химических веществ, вступающих в реакцию в соответствии с тысячами реакций.
Включение таких механизмов в решатели вычислительных потоков все еще представляет собой довольно сложную задачу, главным образом в двух аспектах. Во-первых, количество степеней свободы (пропорциональное количеству химических соединений) может быть очень большим; во-вторых, исходный член из-за реакций вводит несопоставимое количество временных масштабов, что делает всю динамическую систему жесткой. В результате прямое численное моделирование турбулентных реактивных потоков с тяжелым топливом вскоре становится трудновыполнимым даже для современных суперкомпьютеров.
Поэтому было разработано множество методологий для уменьшения сложности механизмов сгорания, не прибегая к высокому уровню детализации. Примеры предоставлены:
Кинетическое моделирование
СОДЕРЖАНИЕ
Полное и неполное
Полный
Горение не обязательно способствует максимальной степени окисления и может зависеть от температуры. Например, триоксид серы не образуется количественно при сжигании серы. НЕТ
Икс виды появляются в значительных количествах при температурах выше примерно 2800 ° F (1540 ° C), и больше производятся при более высоких температурах. Количество NO
Икс также является функцией избытка кислорода.
Количество воздуха, необходимое для полного сгорания, называется чистым воздухом. Однако на практике используется воздух в 2-3 раза больше, чем чистый воздух.
Неполный
При неполном сгорании образуется окись углерода.
Проблемы, связанные с неполным сгоранием
Проблемы со здоровьем человека:
Вдыхание угарного газа вызывает головную боль, головокружение, рвоту и тошноту. Если уровень окиси углерода достаточно высок, люди теряют сознание или умирают. Воздействие умеренного и высокого уровня окиси углерода в течение длительного времени положительно коррелирует с риском сердечных заболеваний. Люди, пережившие тяжелое отравление угарным газом, могут страдать от долговременных проблем со здоровьем. Окись углерода из воздуха абсорбируется в легких, а затем связывается с гемоглобином в красных кровяных тельцах человека. Это снизит способность красных кровяных телец переносить кислород по всему телу.
Тлеющий
Стремительный
Спонтанный
Турбулентный
Микрогравитация
Микро-горение
Химические уравнения
Стехиометрическое горение углеводорода в кислороде
Обычно химическое уравнение для стехиометрического горения углеводорода в кислороде имеет следующий вид:
Например, стехиометрическое горение пропана в кислороде составляет:
Стехиометрическое горение углеводорода на воздухе
Например, стехиометрическое горение пропана ( ) на воздухе: C 3 ЧАС 8 <\ displaystyle <\ ce
Стехиометрический состав пропана в воздухе составляет 1 / (1 + 5 + 18,87) = 4,02% об.
Стехиометрическая реакция горения C α H β O γ в воздухе:
Стехиометрическая реакция горения для C α H β O γ S δ :
Стехиометрическая реакция горения для C α H β O γ N δ S ε :
Стехиометрическая реакция горения для C α H β O γ F δ :
Следы продуктов сгорания
Неполное сгорание углеводорода в кислороде
Когда z падает ниже примерно 50% стехиометрического значения, CH
4 может стать важным продуктом горения; когда z падает ниже примерно 35% стехиометрического значения, элементарный углерод может стать стабильным.
Этих трех уравнений недостаточно для расчета состава дымовых газов. Однако в положении равновесия реакция конверсии водяного газа дает другое уравнение:
Жидкое топливо
Газообразное топливо
Твердое топливо
Акт горения состоит из трех относительно разных, но перекрывающихся фаз:
Управление горением
В идеальной печи поток воздуха для горения будет согласован с потоком топлива, чтобы дать каждой молекуле топлива точное количество кислорода, необходимое для полного сгорания. Однако в реальном мире горение не происходит идеально. Несгоревшее топливо (обычно CO и H
2 ), выбрасываемый из системы, представляет собой потерю теплотворной способности (а также угрозу безопасности). Поскольку горючие вещества в отходящем газе нежелательны, а присутствие в нем непрореагировавшего кислорода представляет минимальные проблемы безопасности и защиты окружающей среды, первый принцип управления горением заключается в обеспечении большего количества кислорода, чем теоретически необходимо для обеспечения сгорания всего топлива. Для метана ( CH
4 ) для горения, например, требуется чуть больше двух молекул кислорода.
Соблюдению этих двух принципов способствует обеспечение баланса материала и тепла в процессе сгорания. Материальный баланс напрямую связывает соотношение воздух / топливо в процентах от O
2 в дымовом газе. Тепловой баланс связывает тепло, доступное для заряда, с общим чистым теплом, произведенным при сгорании топлива. Дополнительные материальные и тепловые балансы могут быть выполнены для количественной оценки теплового преимущества от предварительного нагрева воздуха для горения или его обогащения кислородом.
Механизм реакции
Подробное описание процессов горения с точки зрения химической кинетики требует формулировки больших и сложных сетей элементарных реакций. Например, при сжигании углеводородного топлива обычно участвуют сотни химических веществ, вступающих в реакцию в соответствии с тысячами реакций.
Включение таких механизмов в решатели вычислительных потоков все еще представляет собой довольно сложную задачу, главным образом в двух аспектах. Во-первых, количество степеней свободы (пропорциональное количеству химических соединений) может быть очень большим; во-вторых, исходный член из-за реакций вводит несопоставимое количество временных масштабов, что делает всю динамическую систему жесткой. В результате прямое численное моделирование турбулентных реактивных потоков с тяжелым топливом вскоре становится трудновыполнимым даже для современных суперкомпьютеров.
Поэтому было разработано множество методологий для уменьшения сложности механизмов сгорания, не прибегая к высокому уровню детализации. Примеры предоставлены:
Кинетическое моделирование
Большая Энциклопедия Нефти и Газа
Сгорание углеводородов топлив протекает значительно сложнее, чем сгорание элементов, их составляющих. [2]
Теплота сгорания углеводорода зависит от содержания в молекуле водорода и от соотношения углерод: водород. [3]
Продукты сгорания углеводородов в воздухе проходят через реактор и далее через насадку регенератора 21, подогревая их до требуемой температуры. [5]
Теплота сгорания углеводородов повышается по мере увеличения числа атомов углерода в молекуле. С увеличением числа атомов в молекуле предельных углеводородов возрастают также их плотность и температура кипения. [6]
Теплота сгорания углеводородов сильно зависит от молекулярного веса: чем тяжелее углеводород, тем больше его теплота сгорания. [8]
Скорость сгорания углеводородов в зависимости от их строения и от принадлежности к тому или иному классу, различна. [11]
При сгорании углеводорода происходит смещение электронов от атомов углерода и водорода к атомам кислорода, в результате чего атомы углерода и водорода становятся электроположительными и соединяются с электроотрицательными атомами кислорода. [12]
При сгорании углеводорода энергия уменьшается, ее избыток выделяется в виде тепла и света. А энтропия, мера неупорядоченности, действительно увеличивается, так как малые молекулы HjO и СО2 менее упорядочены в смысле расположения атомов, чем большая моло-кула углеводорода, скажем бутана. [13]
При сгорании углеводорода энергия уменьшается, ее избыток выделяется в виде тепла и света. А энтропия, мера неупорядоченности, действительно увеличивается, так как малые молекулы НУЭ и СО2 менее упорядочены в смысле расположения атомов, чем большая молекула углеводорода, скажем бутана. [14]
Что образуется при сгорании углеводорода
Собственно подсказок для решения задачи две: это выделение шести объемов СО2 (значит, в молекуле 6 атомов углерода) и то, что хлорирование идет на свету (значит, это алкан).
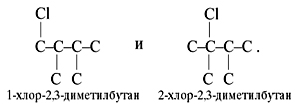
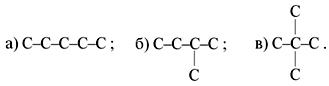
Устанавливаем структуру. Поскольку у этого углеводорода всего два монохлорпроизводных, значит, его углеродная цепь следующая:
Это – 2,3-диметилбутан. Каркасы хлоруглеводородов следующие:
При разборе решения надо обратить внимание на расстановку коэффициентов в общем виде (черезn), т.к. без этого задачу не решить:
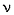
1 моль алкана – 1,5n + 0,5 кислорода,
0,166 моль алкана – 1,33 моль кислорода.
Это – пентан C5H12, для него возможны три изомера:
При разборе решения надо обратить внимание на расстановку коэффициентов в общем виде черезn, т.к. без этого задачу не решить:
До реакции общий объем газов был:
После реакции учитываем только объем СО2 – n л (вода H2O при 20 °С – жидкость).
Составляем уравнение: 1 + 1,5n + 0,5 = 2n.
Напишем уравнение реакции алкена с раствором перманганата калия:
3СnH2n + 2KMnO4 + 4H2O = 3СnH2n(OH)2 + 2MnO2 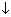
Пусть в реакцию вступил 1 моль алкена, тогда выделилось 0,6667 моль оксида марганца(IV).
Следовательно, учитывая условие задачи, относительная молекулярная масса алкена меньше 58. Этому условию отвечают алкены С2Н4, С3Н6, С4Н8.
По условию задачи алкен имеет цис- и трансизомеры. Тогда точно не подходят этен и пропен. Остается бутен-2: только он имеет цис- и трансизомеры.
По условию задачи 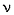
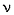
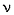
31,8/(77 + R) = 45,3/(77 – 1 + 46 + R).
Поэтому n = 2, радикал R – это С2Н5.
Однако по условию задачи получается только одно нитропроизводное. Следовательно, исходное вещество не может быть этилбензолом, т. к. тогда образовались бы орто- и паранитропроизводные. Значит, гомолог бензола содержит не радикал этил, а два метильных радикала. Расположены они симметрично (пара-ксилол). При таком расположении заместителей получается только одно нитропроизводное.
Анализируем условие задачи для написания уравнения. В присутствии серной кислоты возможна либо внутримолекулярная, либо межмолекулярная дегидратация или их комбинация. Если дегидратация внутримолекулярная, то получается всего два непредельных углеводорода, если межмолекулярная, то получается смесь трех эфиров. Комбинированный вариант рассматривать не имеет смысла, т.к. по условию получаются вещества одного класса. Уравнение реакции:
Рассчитаем количество вещества воды:
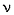
Поскольку продукты реакции получены в равных молярных соотношениях, значит, каждого эфира получилось по: 0,15/3 = 0,05 моль.
Составляем уравнение материального баланса:
Отсюда (M(R) + M(R’) = 128. Оба радикала R и R’ – предельные, поэтому их суммарную молярную массу можно записать так:
Подставляя значения атомных масс, находим:
Молекулы двух спиртов содержат 9 атомов углерода.
По условию задачи спирты первичные и имеют разветвленный углеродный скелет. Значит, один спирт содержит 4 атома углерода, а другой – 5.