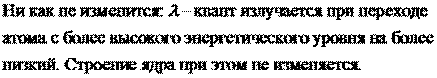Что общего и различного у изотопов
Г). Что общего у различных изотопов одного и того же химического элемента? Чем они различаются?
Изотопы – это разновидности данного химического элемента, различающиеся массовым числом своих ядер.
Различаются количеством нейтронов в ядре, массовым числом своих ядер, различается стабильность атомов, у нестабильных ядер различается время полураспада, физические свойства изотопов могут различаться весьма резко
2. Муфельная печь потребляет мощность Р=1кВт. Температура Т ее внутренней поверхности при открытом отверстии площадью S=25 см 2 равна 1200К. Считая, что отверстие печи излучает как черное тело, определить, какая часть мощности рассеивается стенками
а). Запишите формулу Рэлея-Джинса для теплового излучения. Что известный физик Эренфест имел – в виду, когда говорил об «ультрафиолетовой катастрофе»?
Формула Рэлея-Джинса для теплового излучения:

Формула Рэлея-Джинса для испускательной способности
абсолютно черного тела:
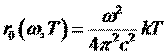
Интегрирование выражения (2) по всему частотному диапазону дает бесконечно большое значение, т.е. энергетическая светимость абсолютно черного тела должна равняться бесконечности при любой температуре.Практически вся энергия нагретого тела должна быть немедленно испущена в виде излучения с очень большой частотой и малой длиной волны. Этот результат назвали «ультрафиолетовой катастрофой Рэлея-Джинса»
б). Почему в спектре водорода так много линий, если у атома водорода всего лишь один электрон?
в). Каков физический смысл коэффициентов Эйнштейна для спонтанного излучения, резонансного поглощения, вынужденного излучения?
Коэффициенты Эйнштейна определяют вероятности переходов атомов с уровня 

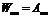
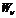
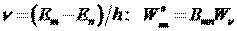

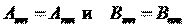
г). Как изменится положение химического элемента в таблице Менделеева после испускания его ядром гамма-кванта?
2. Короткий импульс света с энергией Е=7,5 Дж в виде узкого почти параллельного пучка падает на зеркальную пластинку с коэффициентом отражения р=0,60. Угол падения пучка равен 30°. Определить с помощью корпускулярных представлений импульс, переданный
пластинке.
2. Определить, какая часть (в процентах) начального количества ядер радиоактивного изотопа останется нераспавшейся по истечении времени t, равного трем средним временам жизни радиоактивного ядра.
Что общего и различного у изотопов
а). Что можно сказать об относительной температуре звезд, имею щих желтый, голубой и красный оттенки?
Температура красных звезд меньше температуры желтых. Температура голубых звезд больше температуры желтых.
б). Предложите методику определения значения постоянной Планка из опытов по изучению фотоэффекта.
в). Какова зависимость от времени волновой функции для частицы, находящейся в бесконечно глубокой одномерной прямоугольной по тенциальной яме?
Частица в потенциальной яме
Пусть частица движется вдоль оси x. В точках x=0 и x=l установлены непроницаемые бесконечно высокие стенки.
Потенциальная энергия в этом случае имеет вид.
Такая зависимость потенциальной энергии от x получила название потенциальной ямы.
Стац. уравнение Шредингера имеет вид:

Вероятность нахождения частицы вне потенциальной ямы равна 0.
Найдём условия, при которых ψ-функция удовлетворяет граничным условиям.


Важный результат: 

Энергия электрона внутри потенциальной ямы принимает дискретные значения, т.е. является квантованной. Величина En зависит от числа n, которое носит название главного квантового числа. Квантованные значения энергии называются энергетическими уровнями. Главное квантовое число n определяет номер энергетического уровня, следовательно, электрон в потенциальной яме может находиться только на определённом энергетическом уровне, причём минимальное значение En<>0. Дискретный характер энергетических уровней проявляется при малых значениях массы частицы, размера потенциальной ямы и главного квантового числа n. При больших значениях этих параметров движение становится классическим. Положение частицы в яме не равновероятно, а определяется собственными функциями.
Заметим еще, что на ширине “ямы” l должно укладываться целое
На рис. представлена зависимость плотности вероятности
обнаружения частицы в окрестности определенной точки “ямы”
от координаты точки x (т.е. ½ y n ( x ) ½ 2 ), а также спектр значений
энергии частицы. Из рисунка видно, что, например, при n =2
частица не может находиться в центре ямы, но одинаково часто
бывает как в левой, так и в правой её половинах.
г). Что общего у различных изотопов одного и того же химического элемента? Чем они различаются?
Изотопы – это разновидности данного химического элемента, различающиеся массовым числом своих ядер.
Различаются количеством нейтронов в ядре, массовым числом своих ядер, различается стабильность атомов, у нестабильных ядер различается время полураспада, физические свойства изотопов могут различаться весьма резко
2. Муфельная печь потребляет мощность Р=1кВт. Температура Т ее внутренней поверхности при открытом отверстии площадью S =25 см 2 равна 1200К. Считая, что отверстие печи излучает как черное те ло, определить, какая часть мощности рассеивается стенками
Разница между изотопами и элементами
В ключевое отличие между изотопами и элементами заключается в том, что изотопы представляют собой разные формы одного и того же химического элемента, тогда как элементы представляют собой разновидност
Содержание:
В ключевое отличие между изотопами и элементами заключается в том, что изотопы представляют собой разные формы одного и того же химического элемента, тогда как элементы представляют собой разновидности атомов, имеющих одинаковое количество протонов в атомных ядрах.
Одинаковые атомы могут претерпевать небольшие изменения с образованием разных изотопов. Элемент может иметь несколько изотопов. Природа каждого изотопа влияет на природу элемента. Здесь мы будем подробно обсуждать изотопы и элементы, чтобы выяснить разницу между изотопами и элементами.
Что такое изотопы?
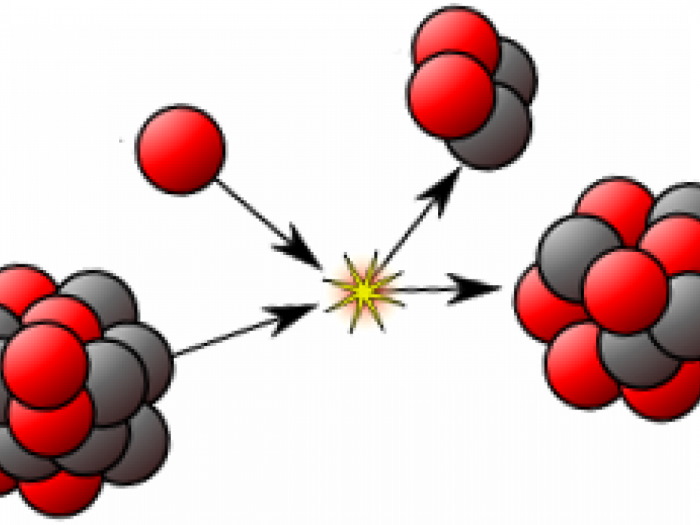
Атомы одного и того же элемента могут отличаться друг от друга. Эти разные атомы одного и того же элемента являются изотопами. Они отличаются друг от друга разным количеством нейтронов. Поскольку число нейтронов другое, их массовое число также отличается. Однако изотопы одного и того же элемента имеют одинаковое количество протонов. В природе разные изотопы встречаются в разных количествах. Следовательно, мы можем указать их частоту в процентах, называемую относительной численностью. Например, у водорода есть три изотопа, таких как протий, дейтерий и тритий. Число протонов в их атомных ядрах одинаково, но число нейтронов другое. Их нейтроны и относительные содержания следующие.
Кроме того, количество нейтронов важно для баланса стабильности ядер. Когда ядра становятся слишком тяжелыми, они становятся нестабильными, и, следовательно, эти изотопы становятся радиоактивными. Например, 238 U испускает излучение и распадается на ядра гораздо меньшего размера. Изотопы могут иметь разные свойства из-за разной массы. Например, у них могут быть разные вращения. Таким образом, их спектры ЯМР различаются. Однако их электронное число одинаково, что приводит к аналогичному химическому поведению.
Что такое элементы?
Каждый элемент имеет атомную массу, атомный номер, символ, электронную конфигурацию и т. Д. Хотя большинство элементов встречаются в природе, есть некоторые синтетические элементы, такие как калифорний, америций, эйнштейний и менделевий. Мы можем разделить все элементы на три группы; как металлы, металлоиды и неметаллы.
Кроме того, мы можем разделить их на группы и периоды на основе более конкретных характеристик. Кроме того, элементы в одной группе или периоде имеют определенные общие характеристики, и некоторые свойства могут изменяться последовательно, когда вы проходите через группу или период. Более того, элементы могут подвергаться химическим изменениям с образованием различных соединений; однако мы не можем дальше разрушать элементы простыми химическими методами.
В чем разница между изотопами и элементами?
В качестве еще одного важного различия между изотопами и элементами мы можем сказать, что атомная масса изотопа может быть вычислена простым сложением общей массы протонов и нейтронов в атомных ядрах, тогда как мы можем вычислить атомную массу химического элемента, используя атомную массу. массы его изотопов и их относительное содержание.
Изотоп
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
См. также
Нестабильные (менее суток): 4 H: Водород-4, 5 H: Водород-5, 6 H: Водород-6, 7 H: Водород-7
Описание изотопов: определение, состав, превращения
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.