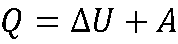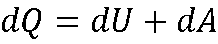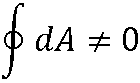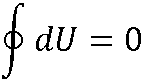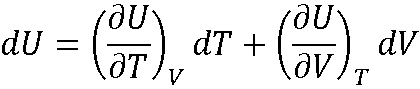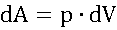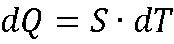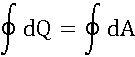Что общего между теплотой и работой
Лекция 2. Первый закон термодинамики. Теплота. Работа. Внутренняя энергия
Теплота – энергия, передающаяся путем теплового (неупорядоченного) движения молекул.
Работа – путем упорядоченного движения молекул.
Внутренняя энергия – энергия взаимодействия всех частиц.
Все величины являются энергией и измеряются в джоулях.
Первый закон термодинамики
Теплота, подведенная к системе, расходуется на изменение внутренней энергии и совершение работы:
Первый закон термодинамики – частный вид закона сохранения энергии.
Свойства теплоты, работы, внутренней энергии
Теплота и работа – функции процесса:
Внутренняя энергия – функция состояния:
dA, dQ не являются полными дифференциалами.
dU является полным 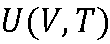
Сходные по формуле выражения
Доказательство того, что внутренняя энергия является функцией состояния
Сохранение энергии:
Что общего между теплотой и работой
ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
1. Первое начало термодинамики
§1. Внутренняя энергия
Всякая термодинамическая система в любом состоянии обладает энергией, которая называется полной энергией. Полная энергия системы складывается из кинетической энергии движения системы как целого, потенциальной энергии системы как целого и внутренней энергии.



При переходе из одного состояния в другое внутренняя энергия системы изменяется. Но при этом внутренняя энергия в новом состоянии не зависти от процесса, по которому система перешла в данное состояние.
§2. Теплота и работа
Возможны два различных способа изменения внутренней энергии термодинамической системы. Внутренняя энергия системы может изменяться в результате выполнения работы и в результате передачи системе тепла. Работа есть мера изменения механической энергии системы. При выполнении работы имеет место перемещения системы или отдельных макроскопических частей относительно друг друга. Например, вдвигая поршень в цилиндр, в котором находиться газ, мы сжимаем газ, в результате чего его температура повышается, т.е. изменяется внутренняя энергия газа.
Отличие между теплотой и работой состоит в том, что теплота передаётся в результате целого ряда микроскопических процессов, при которых кинетическая энергия молекул более нагретого тела при столкновениях передаётся молекулам менее нагретого тела.
Общее между теплотой и работой, что они являются функциями процесса, т. е. можно говорить о величине теплоты и роботы, когда происходит переход системы из состояния первого в состояние второе. Теплота и робота не является функцией состояния, в отличие от внутренней энергии. Нельзя говорить, чему равна работа и теплота газа в состоянии 1, но о внутренней энергии в состоянии 1 говорить можно.
§3 I начало термодинамики
I начало термодинамики : Количество тепла (Δ Q ), сообщённой системе идёт на увеличение внутренней энергии системы и на совершение системой работы (А) против внешних сил.
Запись I начало термодинамики в дифференциальной форме


Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии равно нуля. Тогда
т. е. вечный двигатель I рода, периодически действующий двигатель, который совершал бы большую работу, чем сообщённая ему извне энергия, невозможен (одна их формулировок I начало термодинамики).
§2 Число степеней свободы молекулы. Закон о равномерном
распределении энергии по степеням свободы молекулы
Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью ( N 2 , O 2 , Н2 ) имеют 3 поступательные степени свободы и 2 вращательные степени свободы: i = i пост + i вр =3 + 2=5.

Независимо от общего числа степеней свободы молекул 3 степени свободы всегда поступательные. Ни одна из поступательных степеней не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равна 1/3 значения
Мы будем рассматривать молекулы с жесткой связью, поэтому
так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы не взаимодействуют между собой), то внутренняя энергия 1 моля равна произведению средней энергии одной молекулы на число молекул в моле вещества, то есть на число Авогадро
Для 
§3 Теплоемкость. Работа газа
1. Удельная теплоемкость вещества – величина равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1К.
Молярная теплоемкость С – величина равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1К.
Связь молярной и удельной теплоемкости
Различают теплоемкости при постоянном объеме CV ( v = const ) и постоянном давлении Cp ( p = const ), если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Введите только число, размерность (Дж) не указывайте
1.Определите, какое количество теплоты необходимо для нагревания 2 моль вещества от 200 до 230 К, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
Ответ укажите в Дж.
Ответ введите цифрами.
Введите только число, размерность (Дж) не указывайте.
Правильный ответ: 1758
2. Какое из веществ не является простым:
Выберите один ответ:
c. Жидкий свинец Pb
Правильный ответ: Жидкий свинец Pb
3. Вставьте пропущенный текст: Тепловой эффект прямой реакции _______________________ тепловому эффекту обратной реакции.
Выберите один ответ:
a. противоположен по величине и равен по знаку
b. равен по величине и по знаку
c. обратно пропорционален
d. равен по величине и противоположен по знаку
e. противоположен по величине и по знаку
Правильный ответ: равен по величине и противоположен по знаку
4. Система представляет из себя воду, которая находится в термосе при 0оС. На поверхности воды плавают кусочки льда. Над водой есть слой водяного пара.
Сколько фаз в такой системе
Выберите один ответ:
a. Недостаточно данных для ответа
d. Такая система не может существовать
Правильный ответ: Три
5. Зависимость теплового эффекта реакции от температуры (закон Кирхгофа) обусловливается
Выберите один ответ:
a. зависимостью от температуры теплоемкостей веществ, участвующих в реакции
Правильный ответ: зависимостью от температуры теплоемкостей веществ, участвующих в реакции
6. Определите тепловой эффект реакции N2O4(г)=2NO2(г) при стандартных условиях, если известны стандартные теплоты образования исходных и конечных веществ:
Δ f H2980 (N2O4(г)) = 11кДж,
Δ f H298 0(NO2(г)) = 34кДж.
Ответ приведите в кДж. Введите только число, размерность указывать не нужно.
Правильный ответ: 57
7. Выберите уравнение закона Кирхгофа
Выберите один ответ:
Правильный ответ: dH/dT = ΔСр
Выберите один ответ:
9. Закончите высказывание: При приближении температуры к абсолютному нулю теплоемкость правильного кристалла чистого вещества ____________
Выберите один ответ:
a. стремится к максимуму
b. также стремится к нулевому значению
c. становится равной единице
d. принимает постоянное значение, характерное для данного вещества
e. равна универсальной газовой постоянной
10. Зависимость теплоемкости органического вещества от температуры выражается эмпирическим уравнением
Выберите один ответ:
Правильный ответ: СР = а + вТ+ сТ2
11. Что общего между теплотой и работой?
Выберите один ответ:
12. На рисунке приведена зависимость теплового эффекта некоторой реакции от температуры.
Как зависят от температуры теплоемкости продуктов и исходных веществ в этой реакции?
Выберите один ответ:
a. Сумма теплоемкостей продуктов больше суммы теплоемкостей исходных веществ
b. Сумма теплоемкостей продуктов меньше суммы теплоемкостей исходных веществ
c. При низких температурах больше сумма теплоемкостей продуктов, а при высоких – сумма теплоемкостей исходных веществ
d. По данному графику невозможно сделать вывод о зависимости теплоемкостей от температуры
e. При низких температурах больше сумма теплоемкостей исходных веществ, а при высоких – сумма теплоемкостей продуктов реакции
f. Сумма теплоемкостей продуктов и сумма теплоемкостей исходных веществ одинаковы.
Правильный ответ: Сумма теплоемкостей продуктов и сумма теплоемкостей исходных веществ одинаковы.
13. Выберите все правильные формулировки первого закона термодинамики
Выберите один или несколько ответов:
a. В изолированной системе самопроизвольный процесс сопровождается возрастанием энтропии
b. Невозможно построить машину, которая давала бы механическую работу, не затрачивая на это соответствующее количество энергии
c. В любой изолированной системе запас энергии остается постоянным
d. В любой закрытой системе изменение внутренней энергии равно нулю
e. В любой изолированной системе запас энергии остается постоянным
Правильный ответ: В любой изолированной системе запас энергии остается постоянным, Невозможно построить машину, которая давала бы механическую работу, не затрачивая на это соответствующее количество энергии, В любой изолированной системе запас энергии остается постоянным
14. Какие из перечисленных величин в общем случае не являются функциями состояния т.е. зависят от пути процесса? Выберите все верные варианты
Выберите один или несколько ответов:
e. давление в системе
f. внутренняя энергия
h. внутренняя энергия
Правильный ответ: Теплота, работа
15. Система совершает работу против внешних сил. Какое численное значение может иметь эта работа?
Выберите один ответ:
Правильный ответ: 40 кДж
16. Для некоторого вещества известны теплоты кристаллизации (30 КДж/моль) и сублимации (минус 50 КДж/моль). Определите теплоту кипения данного вещества.
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте. В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов.
Правильный ответ: 80
17. Вычислите работу расширения 1 моля идеального газа, если известно, что процесс протекает в изобарных условиях (1 атм), а объем газа изменяется с 2 до 2,2 м3.
1 атм считать равной 100 000 Па.
Ответ введите цифрами.
Размерность (Дж) не указывайте.
Правильный ответ: 2000
18. Выберите все верные высказывания
Выберите один или несколько ответов:
-Термодинамической системой называют реально или мысленно отделенную от всего окружающего (от внешней среды) группу тел или отдельное тело.,
-Термодинамика рассматривает макроскопические свойства тел без учета их внутренней структуры
19.Определите, какое количество теплоты необходимо для нагревания 3 моль вещества от 77 до 127 оС, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
Ответ укажите в Дж.
Ответ введите цифрами.
Введите только число, размерность (Дж) не указывайте.
Правильный ответ: 67509.
20. Вычислите работу расширения 5 моль идеального газа при нагревании его на 20 градусов в изобарных условиях.
Универсальную газовую постоянную считать равной 8,3Дж/(моль*К).
Ответ введите цифрами. Размерность (Дж) не указывайте.
Правильный ответ: 830
21. Выберите верное высказывание
Выберите один ответ:
a. Мольная теплоемкость зависит от условий, при которых протекает нагревание, а удельная – не зависит
b. Теплоемкость зависит от условий, при которых протекает нагревание
c. Теплоемкость не зависит от условий, при которых протекает нагревание
d. Средняя теплоемкость зависит от условий, при которых протекает нагревание, а истинная – не зависит
Правильный ответ: Теплоемкость зависит от условий, при которых протекает нагревание
Выберите один ответ:
1. тело или группа тел,окруженных реальной или воображаемой вселенной обособленной от соседней вселенной границей раздела
3. вселенная или группа вселенных,контактирующих друг с другом через полупроницаемую мембрану
4. тело или группа тел,контактирующих друг с другом,обособленная от окружающей среды реальной или воображаемой границей раздела верный ответ
Правильный ответ: тело или группа тел,контактирующих друг с другом,обособленная от окружающей среды реальной или воображаемой границей раздела
Определите теплоту сгорания жидкости
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте.
В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов.
24. Тепловой эффект какой реакции может считаться теплотой образования соли CaCO3?
Выберите один ответ:
b. Са +3О + Салмаз = CaCO3
c. Са + Сграфит+ 3/2O2 = CaCO3
d. 2Са + 2Сграфит+ 3O2 = 2CaCO3
e. Са(ОН)2 + Н2СO3 = CaCO3 + 2Н2O
f. Са +3О + Сграфит = CaCO3
Правильный ответ: Са + Сграфит+ 3/2O2 = CaCO3
25.Определите тепловой эффект реакции Al2(SO4)3(тв)=Al2O3(тв)+3SO3(г) при стандартных условиях, если известны стандартные теплоты образования исходных и конечных веществ:
Ответ приведите в кДж. Введите только число, размерность указывать не нужно.
Правильный ответ: 578
26. На рисунке приведена зависимость энергии Гиббса некоторой реакции от температуры.
Как зависят от температуры теплоемкости продуктов и исходных веществ в этой реакции?
Выберите один ответ:
a. Сумма теплоемкостей продуктов и сумма теплоемкостей исходных веществ одинаковы.
b. При низких температурах больше сумма теплоемкостей исходных веществ, а при высоких – сумма теплоемкостей продуктов реакции
c. При низких температурах больше сумма теплоемкостей продуктов, а при высоких – сумма теплоемкостей исходных веществ
d. По данному графику невозможно сделать вывод о зависимости теплоемкостей от температуры
e. Сумма теплоемкостей продуктов больше суммы теплоемкостей исходных веществ
f. Сумма теплоемкостей продуктов меньше суммы теплоемкостей исходных веществ
Правильный ответ: По данному графику невозможно сделать вывод о зависимости теплоемкостей от температуры
27. Какое из веществ является простым:
Выберите один ответ:
d. Атомарный водород Н
e. Тяжелая вода D2О (газ)
Правильный ответ: Водород Н2 (газ)
28. В идеальном газе протекает изохорный процесс, причем известно, что ΔU = –11 кДж. Как изменится температура газа:
Выберите один ответ:
b. Недостаточно данных, чтобы ответить на вопрос
c. Сначала повысится, потом понизится
Правильный ответ: Понизится
29. Какая из записей уравнения закона Кирхгофа верна
Выберите один ответ:
a. ΔHТ = ΔH298 – ΔСр(Т+298)
b. ΔHТ = ТΔH298 + ΔСр
c. Ни один из вариантов не верен
d. ΔHТ = ΔH298 – ΔСр(Т–298)
e. ΔHТ = – ΔH298 – ΔСр(Т+298)
Правильный ответ: Ни один из вариантов не верен
30. Какая из записей уравнения закона Кирхгофа ошибочна:
Выберите один ответ:
d. ΔHТ = ΔH298 + ΔСр(Т–298)
Правильный ответ: ΔH = ΔСр ΔH298
31. В любых закрытых системах изменение внутренней энергии равно
Выберите один ответ:
32. Система представляет из себя водный раствор спирта, над которым находится пар, содержащий молекулы спирта и воды. Сколько независимых компонентов содержится в системе, и какие это компоненты?
Выберите один ответ:
a. два: спирт и вода
b. четыре: спирт в растворе, жидкая вода, спирт в паровой фазе, вода в паровой фазе
c. два: раствор и пар
d. более двух, так как нужно учесть, что и вода и спирт частично диссоциируют
Правильный ответ: два: спирт и вода
33. При приближении температуры к абсолютному нулю теплоемкость правильного кристалла чистого вещества ____________
Выберите один ответ:
a. равна R, что следует из уравнения СР = СV + R
b. равна СV, что следует из уравнения СР = СV + TR
c. также стремится к нулевому значению
d. равна а, что следует из уравнения теплоемкости СР = а + вТ+ сТ2
Правильный ответ: также стремится к нулевому значению
34. Обратимым в термодинамике называется процесс,который
Выберите один ответ:
a. может идти только в обратном направлении независимо от противодействующей силы
b. можно развернуто обратить вокруг бесконечно малой переменной путем применения противодействующей силы
c. может развернуть в обратную сторону путем бесконечно малого изменения противодействующей силы
d. может идти,как в прямом, так и в обратном направлении
Правильный ответ: может развернуть в обратную сторону путем бесконечно малого изменения противодействующей силы
35. Определите тепловой эффект реакции C6H12O6(твα)+ C6H12O6(твβ)=С12Н22О11(тв)+Н2О(ж) при стандартных условиях, если известны стандартные теплоты сгорания исходных и конечных веществ:
ΔсН298 о(Н2О(ж)) = 0кДж,
Ответ приведите в кДж. Введите только число, размерность указывать не нужно.
Правильный ответ: 37
36. Какое из веществ является простым:
Выберите один ответ:
a. Аморфный углерод
Правильный ответ: Графит
37. Начало температурной шкалы Кельвина совпадает с ____
Выберите один ответ:
a. температурой кипения воды
b. температурой плавления льда
c. абсолютным нулём
d. температурой кристаллизации ртути
Правильный ответ: абсолютным нулём
38. От системы отводится некоторое количество теплоты. Какое численное значение может иметь эта теплота?
Выберите один ответ:
Правильный ответ: Минус 10 кДж
39. Какая из записей уравнения закона Кирхгофа верна
Выберите один ответ:
a. ΔHТ = ΔH298 – ΔСр(Т+298)
b. ΔHТ = ТΔH298 + ΔСр
c. Ни один из вариантов не верен
d. ΔHТ = ΔH298 – ΔСр(Т–298)
e. ΔHТ = – ΔH298 – ΔСр(Т+298)
Правильный ответ: Ни один из вариантов не верен
40. Вставьте пропущенный текст
Теплотой образования называется изменение энтальпии в реакции образования одного моля данного вещества ____________ при стандартных условиях.
Выберите один ответ:
a. из протонов и электронов
b. из любых других соединений
c. из простых веществ
Правильный ответ: из простых веществ
41. Выберите все правильные формы уравнения закона Кирхгофа
Выберите один или несколько ответов:
a. ΔH = ΔСрТ3 + const
b. ΔHТ = ΔH298 – ΔСр(Т–298)
e. ΔHТ = ΔH298 + ΔСр(Т–298)
Вы правильно выбрали 2.
Выберите один ответ:
a. форма перехода температуры от одной частицы к другой
b. форма перехода энергии за счет упорядоченного движения частиц
c. форма беспорядка в частицах за счет температурного перехода энергии
d. характеристическая функция
e. форма перехода энергии за счет неупорядоченного движения частиц
Правильный ответ: форма перехода энергии за счет неупорядоченного движения частиц
43. При приближении температуры к абсолютному нулю теплоемкость правильного кристалла чистого вещества ____________
Выберите один ответ:
a. также стремится к нулевому значению
b. равна R, что следует из уравнения СР = СV + R
c. равна а, что следует из уравнения теплоемкости СР = а + вТ+ сТ2
d. равна СV, что следует из уравнения СР = СV + TR
Правильный ответ: также стремится к нулевому значению
44. На рисунке приведены зависимости суммарных энтропий исходных веществ и продуктов для некоторой реакции от температуры.