Что означает атомная масса в таблице менделеева
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
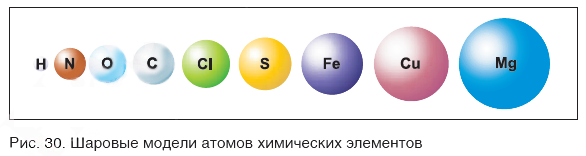
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
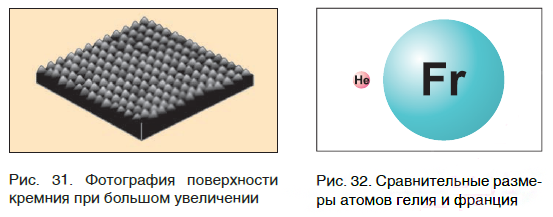
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Что означает атомная масса в таблице менделеева
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Что означает атомная масса в таблице менделеева
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.


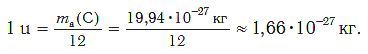
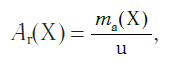
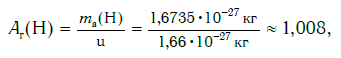
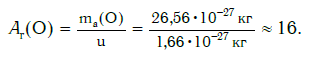
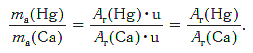
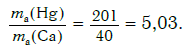

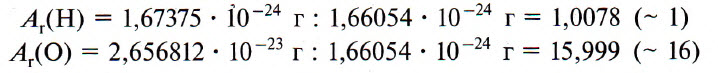



.jpg)

.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)















