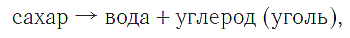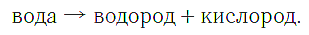Что означает качественный состав в химии
Качественный и количественный состав вещества
Отличие качественного и количественного состава
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав.
Любое сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ до тех пор, пока не получатся вещества, каждое из которых будет являться простым.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать в обычных условиях в различных агрегатных состояниях: газообразном, жидком, твердом
Вещества немолекулярного строения при обычных условиях — твердые кристаллы. При нагревании, достигающем несколько тысяч градусов, такие вещества плавятся, а затем переходят и в парообразное состояние.
Чтобы описать качественный состав вещества, перечисляют, атомы каких элементов входят в состав этого вещества.
При описании количественного состава молекулярного вещества указывают, атомы каких элементов и в каком количестве образуют молекулу данного вещества. При описании количественного состава немолекулярного вещества указывают отношение числа атомов каждого из элементов, входящих в состав этого вещества.
Количественный анализ — совокупность методов определения количественного состава тел, т. е. количественных соотношений, в которых находятся химические элементы или отдельные соединения в анализируемом веществе. Важнейшей характеристикой каждого метода количественного анализа является точность. Она выражается значением относительной ошибки, которая не должна в большинстве случаев превышать 1-2%. Такой показатель как чувствительность, в количественном анализе выражают в процентах.
Количественный анализ первоначально основывался на реакциях осаждения определяемых элементов в виде малорастворимых соединений, массу которых далее взвешивали.
Методы исследований
Для проведения качественного и количественного анализа состава вещества применяются идентичные методы исследования, но их результаты, в зависимости от поставленных задач, будут различны; это химические, физико-химические и физические.
Весь комплекс исследований в максимально короткие сроки и с высоким качеством проведут специалисты независимой лицензированной компании.
Качественный и количественный состав веществ.
Простые вещества – это вещества, образованные одним химическим элементом. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество. Количественный состав –это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Химические знаки и формулы.
Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу. Посмотреть видеоролик.
Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.
Широко используются несколько видов химических формул:
Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество.
Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру. Графическая формула отражает порядок соединения атомов, т. е. связи между ними. Посмотреть видеоролик получения формулы по названию
Относительные атомная и молекулярная массы.
Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода : Единая углеродная атомная единица массы (а. е. м.) равна:
Количество вещества.
Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( ) и массу ( ) отдельной молекулы (или атома): Массу молекулы (атома) в килограммах можно рассчитать по уравнению следовательно из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое называют постоянной Авогадро. Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества;
Вопросы для самоконтроля
1. Что является предметом изучения химии?
2. Какие законы и теории составляют основу химии?
3. Назовите Основные положения АМУ
4. Приведите примеры известных вам аллотропных модификаций.
5. По какой формуле можно вычислить количество вещества?
7. В каких единицах измеряется относительная молекулярная масса и молекулярная масса?
ПЛАН ЗАНЯТИЯ № 3
Дисциплина: Химия.
Тема: Основные законы химии.
Цель занятия: Повторить основные законы химии: стехиометрия, закон сохранения массы веществ, закон постоянства состава веществ молекулярной структуры, закон Авогадро и следствия их него.
Предметные: знать основные законы химии: стехиометрия, закон сохранения массы веществ, владеть основополагающими химическими понятиями, теориями, законами и закономерностями;
Метапредметные: работать с теоретическим материалом, анализировать, делать выводы.
Личностные: уверенное пользование химической терминологией и символикой.
Норма времени:2 часа
Вид занятия:Лекция.
Тип занятия: Урок повторения.
План занятия:
1. Стехиометрия. Закон сохранения массы веществ.
2. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия их него.
Оснащение:Учебник.
Литература:
Преподаватель:Тубальцева Ю.Н.
Тема 3.Основные законы химии.
1. Стехиометрия. Закон сохранения массы веществ.
2. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия их него.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Урок 4. Сложные вещества
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Лекция №1 Состав веществ
Тема: Состав веществ
В лекции освещены следующипе вопросы:
Основные понятия и законы химии
Просмотр содержимого документа
«Лекция №1 Состав веществ»
Тема: Состав, измерение, агрегатные состояния, смеси веществ
Основные понятия и законы химии
Относительная атомная масса
Относительная молекулярная масса
Химия — это наука о составе, строении, свойствах и превращениях веществ.
Исходя из современного определения химической науки, которое удивительно близко к ломоносовскому, рассмотрим некоторые основные первоначальные понятия: вещество, атом, молекула, химический элемент и др.
Какой же вид материи нельзя назвать веществом? Какой вид материи не имеет массы покоя? Из курса физики вы знаете, что к такому виду материи относятся различные поля, в том числе электромагнитное и гравитационное.
Очень интересно, а в настоящее время и практически значимо превращение одной аллотропной модификации углерода (графита) в другую (алмаз):
Этот процесс используют для получения искусственных алмазов. В 1954 г. ученые лаборатории знаменитой американской фирмы «Дженерал Электрик» получили черные кристаллики искусственных алмазов массой 0,05 г при экстремальных условиях: давлении 100000 атм и температуре 2600 О С. Такие алмазы стоили в сотни раз дороже природных. Но уже в течение 10 лет были разработаны технологии, позволяющие получить в одной камере за несколько минут 20 и более граммов алмазов. Современное производство искусственных алмазов основано на их получении из графита не только при сверхвысоких, но и при низких давлениях. Такие алмазы сравнительно дешевы, однако используются преимущественно в технических целях в металлургии и машиностроении, радиоэлектронике и приборостроении, геологоразведке и горной промышленности.
Причиной трагического исхода некоторых экспедиций покорителей полярных (арктической и антарктической) «шапок» Земли явилось то, что исследователи не учли взаимопревращение аллотропных модификаций олова:
При этом изделие из белого блестящего металла превращается в серый невзрачный порошок. Такой процесс носит образное название «оловянная чума». Именно он и стал причиной гибели экспедиции Р. Скотта, пытавшегося в 1912 г. покорить Южный полюс. Экспедиция Скотта использовала для хранения продуктов и керосина железные канистры, запаянные оловом. На сильном морозе оловянный припой канистр рассыпался, и экспедиция осталась без топлива.
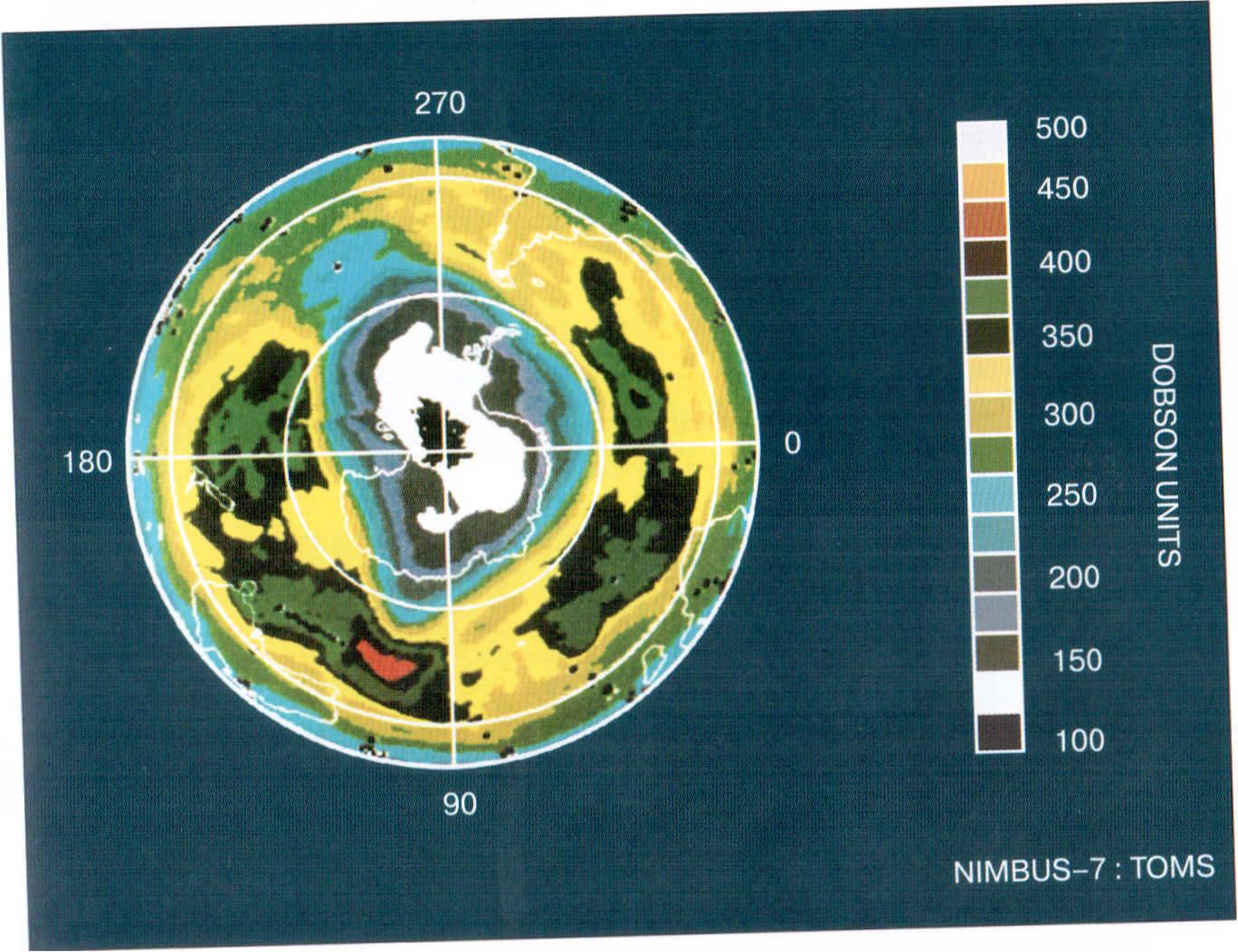
Озон содержится в верхних слоях атмосферы и интенсивно поглощает коротковолновые ультрафиолетовые лучи. Таким образом, атмосфера защищает жизнь на Земле от коротковолновых лучей.
Рис. 1. Озоновый слой Земли на фото со спутника.
Аллотропия является одним из факторов, обусловливающих многообразие веществ. Она вызывается двумя основными причинами:
1) переходом количественных изменений в качественные, в чем нетрудно убедиться на примере аллотропии кислорода;
2) различным кристаллическим строением аллотропных модификаций; например, все модификации углерода имеют атомную кристаллическую решетку, но у алмаза она объемная тетраэдрическая, а у графита слоистая, потому так непохожи свойства алмаза и графита.
Вещества, состоящие из двух и более химических элементов, называют сложными.
Различают качественный и количественный состав веществ.
Основные понятия и законы химии
Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Химический знак (символ) несет значительную информацию. Он обозначает название элемента, один атом его, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Валентность — это способность атомов одного химического элемента соединяться со строго определенным числом атомов другого химического элемента.
Широко используются несколько видов химических формул.
1. Простейшая (эмnирическая) формула показывает качественный состав и соотношения, в которых находятся частицы: атомы, ионы, группы атомов, образующие данное вещество. Например, простейшая формула этана (органического вещества) СН4·
3. Графическая формула отражает порядок соединения атомов
Естествознание. 10 класс
Конспект урока
Естествознание, 10 класс
Перечень вопросов, рассматриваемых в теме:
Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого химического элемента в составе мельчайшей частицы вещества – его молекулы.
Запись, выражающая качественный и количественный состав вещества с помощью хими-ческих знаков, называется химической формулой.
Закон постоянства состава: Многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Химическая связь – это совокупность сил, связывающих и удерживающих атомы или другие частицы в устойчивых структурах (молекулах и др.).
Гибридизация атомных орбиталей – это их перемешивание в пространстве с целью выравнивания и обеспечения наиболее полного перекрывания.
Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ. Простые вещества, образованные одним элементом – это аллотропные модификации (видоизменения) этого элемента.
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Основная и дополнительная литература по теме урока:
Теоретический материал для самостоятельного изучения
Учение о молекуле лежит в основе всех
других обобщений, так что современную химию
можно по праву назвать молекулярной химией.
А. М. Бутлеров, (1828-1886), русский химик, создатель теории химического строения органических веществ, учёный-пчеловод и лепидоптеролог, общественный деятель
Установление взаимосвязи между свойствами веществ и строением молекул составляет фундаментальную научную проблему химии. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении порядка расположения атомов (связей) в исходных соединениях и характера изменений при образовании из них других соединений.
Первые представления о структуре молекул основывались на химическом анализе. Со времен М.В. Ломоносова (1741), который высказал мысль, что свойства вещества зависят от рода, числа и расположения «элементов» (атомов), составляющих его «корпускулу» (молекулу), представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволило определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле, составленной на основе качественного и количественного анализа, а также закона постоянства состава (Ж.Пруст). В дальнейшем А.М. Бутлеров (1861) ввел понятие химического строения (как порядка связи атомов в молекуле) и показал, что свойства вещества определяются его составом и химическим строением. Стереохимическая гипотеза Я. Вант-Гоффа и Ле Беля (1874) расширила понятие строения. Оказалось, что свойства вещества зависят как от химического (в топологическом плане), так и пространственного строения молекул. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. В таблице 1 отражена зависимость пространственного строения веществ от типа гибридизации.
«Пространственное строение частиц в зависимости от типа гибридизации». Приведите свои примеры веществ.
Тип гибриди-зации центрального атома