Что означает конст в физике
const
Смотреть что такое «const» в других словарях:
const — or Const abbrev. 1. constable 2. constant 3. constitution 4. constitutional 5. construction * * * … Universalium
const — or Const abbrev. 1. constable 2. constant 3. constitution 4. constitutional 5. construction … English World dictionary
Const. Ap. — Const. Ap. † Catholic Encyclopedia ► Ecclesiastical Abbreviations ► Abbreviation in general use, chiefly Ecclesiastical Constitutio Apostolica ( Apostolic Constitution ) The Catholic Encyclopedia, Volume VIII. New York: Robert… … Catholic encyclopedia
CONST — in nummo Arcadii: Consh. in Horii, Constantinopoli notat. T. et h. Monetarium indicante Car. du Fresne, d. l … Hofmann J. Lexicon universale
const — (constant) permanent quantity, quantity that does not change … English contemporary dictionary
Const. — Constitution. * * * abbrev 1. Constant 2. Constitution * * * const., 1. constable. 2. Mathematics. constant. 3. constitution. Const., 1. Constable. 2. Constantinople … Useful english dictionary
const. — 1. constable. 2. constant. 3. constitution. 4. constitutional. 5. construction. * * * abbrev 1. Constant 2. Constitution * * * const., 1. constable. 2. Mathematics … Useful english dictionary
const — constant * * * const abbr constant … Medical dictionary
const. — 1) constable 2) constant 3) Also, Const. constitution 4) constitutional 5) construction … From formal English to slang
const — abbreviation 1. constant 2. constitution; constitutional 3. construction … New Collegiate Dictionary
Const. — Constitution. * * * … Universalium
Так вы думаете, что знаете Const?
Думаете, что вы знаете все правила использования const для С? Подумайте еще раз.
Основы const
Скалярные переменные
Вы знакомы с простым правилом const в С.
const перед hello означает, что во время компиляции происходит проверка того, что hello никогда не меняется.
Кроме того, C не сильно беспокоится о том, где расположен const до тех пор пока он находится перед идентификатором, так что объявления const uint32_t и uint32_t const идентичны:
Скалярные переменные в прототипах
Сравните прототип и реализацию следующей функции:
Однако, ваш компилятор будет жаловаться на несоответствие const для параметров, являющихся указателями или массивами, так как в таком случае ваша функция будет иметь возможность манипулировать данными на которые ссылается передаваемый указатель.
Массивы
Вы можете указать const для всего массива.
const также может указываться после объявления типа:
Структуры
Обычные структуры
Вы можете указать const для всей структуры.
Если мы попытаемся изменить какой-либо член someStructA :
const внутри структуры
Вы можете указать const для отдельных членов структуры:
Если мы попытаемся изменить какие-либо члены someOtherStructB :
Указатели
const для указателей — вот где начинается веселье.
Один const
Давайте использовать указатель на целое число в качестве примера.
Два const
Давайте добавим ещё один const и посмотрим как пойдут дела.
Ага, у нас получилось сделать и данные, и сам указатель неизменяемыми.
Интерлюдия — объясняем объявления const
Но подождите, дальше — больше!
Это распространенный шаблон для перебора последовательностей данных: переходить к следующему элементу, увеличивая указатель, но не позволяя указателю изменять данные.
Допустимое значение указателя это всегда скалярный адрес памяти ( uintptr_t ), поэтому здесь const оказывает тот же эффект, как и в случае с обычными целочисленными значениями, т.е. совершенно нормально, если ваша реализация использует const для определения параметров, но прототип вашей функции не обязан включать их, так как этот const защищает только адрес, но не данные.
Три const
Сколько способов мы можем использовать, чтобы добавить const к двойному указателю?
Давайте быстро это проверим.
Какие из этих операций допускаются, исходя из объявления выше?
Только первое присваивание не сработало, потому что, если мы прочитаем наше объявление справа налево:
Что, если мы хотим добавить еще один модификатор const на уровень глубже?
Теперь мы дважды защищены от изменений, потому что, если мы прочитаем наше объявление справа налево:
Что если мы хотим заблокировать все изменения при объявлении двойного указателя?
Что теперь мы (не)можем сделать?
Ничего не работает! Успех!
Дополнительные правила
Хаки приведения типов
Что если вы умны и создали изменяемый указатель на неизменяемое хранилище?
Поскольку это C, вы можете отбросить квалификатор const явным преобразованием типа и избавиться от предупреждения (а также нарушения инициализации const ):
Хаки памяти
Что если структура содержит const члены, но вы измените хранящиеся в ней данные после объявления?
Давайте объявим две структуры, различающиеся только константностью их членов.
Будет ли это работать?
Неа, это не работает, потому что прототип 6 для memcpy выглядит так:
memcpy не позволяет передавать ей неизменяемые указатели в качестве dst аргумента, так как dst изменяется при копировании (а someStructA неизменяема).
Заключение
Не создавайте изменяемых значений без необходимости. Будьте внимательны к тому, чтобы ваша программа на самом деле работала так, как вы планировали.
Многоликий const
Ключевое слово const — одно из самых многозначных в C++. Правильно использование const позволяет организовать множество проверок ещё на этапе компиляции и избежать многих ошибок из числа тех, которые бывает трудно найти при помощи отладчиков и/или анализа кода.
Первая половина заметки рассчитана скорее на начинающих (надеюсь мнемоническое правило поможет вам запомнить, где и для чего используется const), но, возможно, и опытные программисты смогут почерпнуть интересную информацию о перегрузке методов по const.
Константы и данные
Самый простой случай — константные данные. Возможно несколько вариантов записи:
Все они правильные и делают одно и тоже — создают переменную, значение которой изменить нельзя.
Константы и указатели
При использовании const с указателями, действие модификатора может распространяться либо на значение указателя, либо на данные на которые указывает указатель.
Работает (const относится к данным):
Тоже самое и тоже работает:
А вот это уже не работает:
Если бы операция присвоения изменяла бы не указатель, а данные:
то ситуация была бы диаметрально противоположной.
Существует мнемоническое правило, позволяющее легко запомнить, к чему относится const. Надо провести черту через «*», если const слева, то оно относится к значению данных; если справа — к значению указателя.
Ну и конечно, const можно написать дважды:
Константы и аргументы/результаты функций
C функциями слово const используется по тем же правилам, что при описании обычных данных.
Константы и методы (перегрузка)
А вот с методами есть одна тонкость.
Во-первых, для методов допустимо использование const, применительно к this. Синтаксис таков:
Кроме того, этот const позволяет перегружать методы. Таким образом, вы можете писать оптимизированные варианты методов для константных объектов.
То есть для константного объекта (с x=2) был вызван соответствующий метод.
Осталось только добавить, что если вы планируете использовать const-объекты, то вам надо обязательно реализовать const-методы. Если вы в этом случае не реализуете не-const-методы, то во всех случаях будут молча использоваться const-методы. Одним словом, const лучше использовать там, где это возможно.
И ещё… я собрался в отпуск… возможно, не смогу ответить на комментарии до понедельника-вторника. Не сочтите за невнимание 🙂
График изотермического процесса. Основные термодинамические процессы
Главным предметом изучения термодинамики газовых систем является изменение термодинамических состояний. В результате таких изменений газ может совершать работу и запасать внутреннюю энергию. Изучим в приведенной ниже статье разные термодинамические переходы в идеальном газе. Особое внимание будет уделено изучению графика изотермического процесса.
Идеальные газы
Уже судя по самому названию, можно сказать, что 100-процентных идеальных газов в природе не существует. Однако многие реальные вещества удовлетворяют этой концепции с приемлемой для практики точностью.

Идеальным называется любой газ, в котором можно пренебречь взаимодействиями между его частицами и их размерами. Оба условия удовлетворяются только в том случае, если кинетическая энергия молекул будет намного превышать потенциальную энергию связей между ними, а расстояния между молекулами будут намного больше размеров частиц.
Чтобы определить, является ли изучаемый газ идеальным, можно воспользоваться простым эмпирическим правилом: если температура в системе выше комнатной, давление не сильно отличается от атмосферного или меньше него, а составляющие систему молекулы являются химически инертными, то газ будет идеальным.
Главный закон
Речь идет об уравнении идеального газа, которое также называется законом Клапейрона-Менделеева. Записано это уравнение было в 30-е годы XIX века французским инженером и физиком Эмилем Клапейроном. Спустя несколько десятилетий оно было приведено русским химиком Менделеевым к современному виду. Это уравнение имеет следующий вид:
Закон Клапейрона-Менделеева впервые был получен из результатов предыдущих газовых законов, то есть в его основе лежала исключительно экспериментальная база. С развитием современной физики и кинетической теории текучих сред уравнение идеального газа может быть выведено из рассмотрения микроскопического поведения частиц системы.
Изотермический процесс
Касательно газа идеального отметим, что изотермический переход для него называется законом Бойля-Мариотта. Обнаружен этот закон был экспериментальным путем. Причем он стал первым в этой области (вторая половина XVII века). Его может получить каждый школьник, если рассмотрит поведение газа в закрытой системе (n = const) при постоянной температуре (T = const). Пользуясь уравнением состояния, получаем:
Последнее равенство представляет собой закон Бойля-Мариотта. В учебниках по физике можно также встретить такую форму его записи:
При переходе из изотермического состояния 1 в термодинамическое 2 произведение объема на давление остается постоянным для закрытой газовой системы.
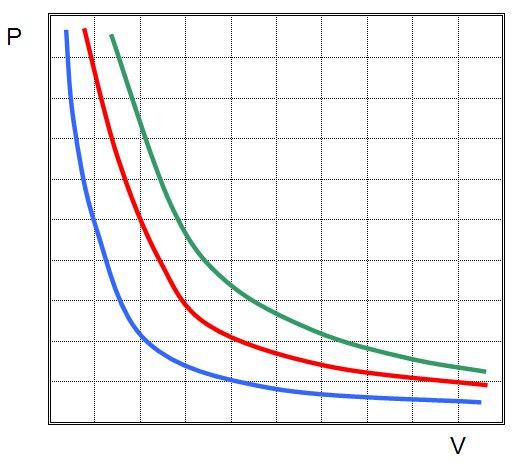
Изучаемый закон говорит об обратной пропорциональности между величинами P и V:
Это означает, что графиком изотермического процесса в идеальном газе будет кривая гипербола. Три гиперболы изображены на рисунке ниже.
Изменение внутренней энергии при изотермическом процессе
В физике идеальных газов под внутренней энергией понимают энергию кинетическую, связанную с вращательным и поступательным движением молекул. Из кинетической теории несложно получить следующую формулу для внутренней энергии U:
В случае процесса изотермического температура остается постоянной, значит, единственной причиной изменения внутренней энергии является выход или приход в систему частиц вещества. Таким образом, в закрытых системах во время изотермического изменения их состояния внутренняя энергия сохраняется.
Изобарный и изохорный процессы
Помимо закона Бойля-Мариотта, существуют еще два основных газовых закона, которые также были открыты экспериментальным путем. Они носят фамилии французов Шарля и Гей-Люссака. Математически их записывают так:
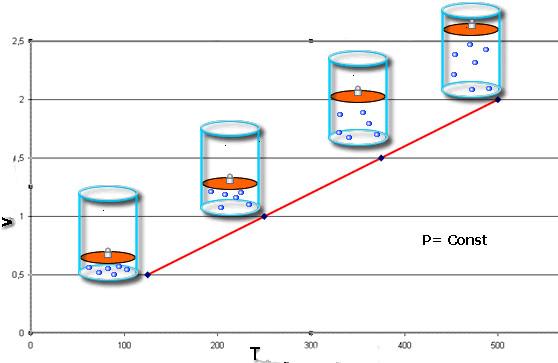
V / T = const при P = const;
P / T = const при V = const.
Закон Шарля говорит о том, что во время изобарного процесса (P = const) объем линейно зависит от абсолютной температуры. Закон Гей-Люссака свидетельствует о линейной зависимости между давлением и абсолютной температурой при изохорном переходе (V = const).
Из приведенных равенств следует, что от процесса изотермического графики изобарного и изохорного переходов отличаются существенным образом. Если изотерма имеет форму гиперболы, то изобара и изохора являются прямыми линиями.
Изобарно-изотермический процесс
Рассматривая газовые законы, иногда забывают, что, помимо величин T, P и V, также может изменяться и величина n в законе Клапейрона-Менделеева. Если зафиксировать давление и температуру, то мы получим уравнение изобарно-изотермического перехода:
n / V = const при T = const, P = const.
Линейная зависимость между количеством вещества и объемом говорит о том, что при одинаковых условиях разные газы, содержащие одно и то же количество вещества, занимают равные объемы. Например, при нормальных условиях (0 oC, 1 атмосфера) молярный объем любого газа составляет 22,4 литра. Рассмотренный закон называется принципом Авогадро. Он лежит в основе закона Дальтона об идеальных газовых смесях.
Уравнение Клапейрона-Менделеева
Что такое уравнение Клапейрона-Менделеева
Идеальный газ — это газ, в котором пренебрегают взаимодействием молекул газа между собой.
Идеальными считают разреженные газы. Особенно близкими к идеальным считают гелий и водород.
Идеальный газ — это упрощенная математическая модель, которая широко применяется для описания свойств и поведения реальных газов при атмосферном давлении и комнатной температуре.
Давление, объем и температура — это основные параметры состояния системы, и они связаны друг с другом. Соотношение, при котором определяется данная связь, называется уравнением состояния данного газа.
Существует эквивалентная макроскопическая формулировка идеального газа — это такой газ, который одновременно будет подчиняться закону Бойля-Мариотта и Гей-Люссака, то есть:
В представленном выше уравнении состоянии газа под const подразумевается количество молей.
Свойства классического и квазиклассического идеального газа описываются уравнением состояния идеального газа, которое называется уравнением Менделеева-Клапейрона, ниже представлена формула Менделеева-Клапейрона.
Таким образом давление и объем прямо пропорциональны количеству молей и температуре.
Также уравнение Клапейрона-Менделеева можно записать в ином виде:
Какое значение имеет универсальная газовая постоянная
Универсальная газовая постоянная (R) — это величина, которая является константой, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 K.
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения, тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
Связь с другими законами состояния идеального газа
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один трех макропараметров (давление, температура или объем) — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном третьем параметре называют газовыми законами, которые связывают эти параметры.
Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из макропараметров состояния: давление, объем, температура или энтропия — остается неизменным.
В зависимости от того, какой параметр остается неизменным различают разные процессы, которые выражаются законами, являющимися следствием уравнения состояния газа:
Изотермический процесс (T=const)
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. Им может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.
Согласно уравнению Клапейрона-Менделеева, в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же, то есть постоянно:
Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Именно поэтому он называется закон Бойля-Мариотта.
Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха).
Зависимость давления газа от объема при постоянной температуре изображается графической кривой — изотермой. Изотерма для различных температур представлена в координатах pV на рис.1. и представляет собой гиперболу.
Рис.1. Изотерма в pV — координатах.
Изохорный процесс (V=const)
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Из уравнения состояния следует, что отношение давлений газа данной массы при постоянно объеме равно отношению его абсолютных температур:
Газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
Так, если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, тогда
p = p 0 T T 0 = p 0 γ T
Коэффициент γ называют температурным коэффициентом давления газа. Он одинаков для всех газов.
Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (Рис.2).
Рис.2 Изображение изохоры в pT-координатах.
Изобарный процесс (p=const)
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Из уравнения Клапейрона-Менделеева вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур.
Если в качестве второго состояния газа выбрать состояние при нормальных условиях (нормальном атмосферном давлении, температуре таяния льда) следует:
V = V 0 T T 0 = V 0 α T
Этот газовый закон был установлен экспериментально в 1802 г французским ученым Гей-Люссаком.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Коэффициент α называют температурным коэффициентом объемного расширения газов.
Зависимость объема газа от температуры при постоянном давлении изображается графической прямой, которая называется изобарой (Рис.3).
Рис. 3. Изобара в VT-координатах.
Использование универсального уравнения для решения задачи
В реальности проводятся различные физико-химические процессы. Рассмотрим каким образом уравнение состояния идеального газа и законы, связанные с ним находят применение для решения физических и химических задач.
Так как в уравнении даны объем и температура — два из трех макроскопических параметров, а третий (давление) нужно определить, то мы можем использовать уравнение Клапейрона-Менделеева:
p V = n R T = m M R T
Не забываем перевести температуру в Кельвины:
T = t + 273 = 27 + 273 = 300 K
Молярная масса кислорода известна из таблицы Менделеева:
Выразим из уравнения состояния давления и поставим все имеющиеся данные:
Используем уравнение Менделеева-Клапейрона, из которого выражаем объем кислорода, который нужно найти:
p = n R T V = m R T M V
Молярная масса кислорода предполагается равной:
M ( O 2 ) = 2 * 16 = 32 г / м 3
Не забываем перевести температуру в Кельвины:
T = t + 273 = 20 + 273 = 293 K
Переводим давление: p = 15680000 Па
Выражаем из уравнения Клапейрона-Менделеева объем и подставляем значения, данные в условиях задачи:
Согласно уравнению Менделеева-Клапейрона:
p = n R T V = m R T M V
Плотность — это величина, характеризующая массу некоторого объема и находится по формуле:
ρ = m V и л и V = m ρ
Тогда p m ρ = n R T = m R T M
Откуда выражаем плотность газа:
Для водорода эта формула запишется следующим образом:
ρ H 2 = p M H 2 R T
По условию задачи водород и любой другой газ находятся при одинаковых условиях, откуда следует, что:
ρ H 2 M H 2 = p R T
Поставим последнее выражение в выражение для плотности любого газа:
Молярная масса водорода, исходя из таблицы Менделеева равна 2 г/моль и тогда. Молекулярная масса численно равная молярной и представляет собой массу молекулы в атомных единицах, поэтому в дальнейшем мы совершили переход к молекулярной массе.
Рассмотрим несколько задач на законы, связанные с уравнение Клапейрона-Менделеева, то есть на изотермические, изохорные, изобарные процессы.
При уменьшении давления газа в 2,5 раза его объем увеличился на 12 л. Какой объем занимал газ в начальном состоянии, если температура на протяжении всего процесса оставалась постоянной?
По условию задачи температура в ходе всего процесса оставалась постоянной, откуда следует, что у нас изотермический процесс, и мы можем воспользоваться для решения законом Бойля-Мариотта.
Откуда можем найти начальный объем:
Ответ: первоначальный объем газа был равен 8 л.
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
При 27°C объем газа равен 600 мл. Какой объем займет газ при 57°C, если давление будет оставаться постоянным?
Так как давление по условию остается постоянным, то можем использовать закон Гей-Люссака.
V_2 – искомый объем
Для правильного расчета необходимо перевести температуры из Цельсий в Кельвины:
T 1 = 273 + 27 = 300 K
T 2 = 273 + 57 = 330 K
V 2 = ( 600 * 330 ) / 300 = 660 м л
Так как по условию задания давления газа не изменяется, значит перед нами изобарный процесс. Для решения воспользуемся законом Гей-Люссака:
Перейдем к абсолютной температуре:
T 1 = 1150 + 273 = 1423 K
T 2 = 200 + 273 = 473 K
Масса газа: m = ρ 1 V 1 = ρ 2 V 2
Использование этих формул приводит к следующему: