Что означает появление резистентных к препарату вирусов
Антибиотики: современная точка зрения
Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам Насколько актуальна проблема резистентности? Можно ли (и если можно, то как) контролировать резистентность?
 |
| Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам |
Насколько актуальна проблема резистентности?
Можно ли (и если можно, то как) контролировать резистентность?
Так ли уж неотвратима эра «постантибиотиков»?
Повышение резистентности различных патогенных микроорганизмов к антибиотикам является серьезной проблемой, чреватой такими неприятными последствиями, как грядущая эра «постантибиотиков».
Кризис, наблюдаемый сегодня, не похож на предыдущие. Его особенность прежде всего в количестве вовлеченных микроорганизмов и в отсутствии немедленного ответа на антибактериальную терапию. В прошлом фармацевтическая промышленность решала проблему резистентности путем производства нового, более эффективного антибиотика. Однако на сегодняшний день не существует никакого принципиально нового класса антибиотиков, приемлемого для клинического применения, а разработка новых препаратов может занять 10 — 15 лет.
Расширение спектра используемых в популяции антибиотиков поддерживает выборочное воздействие на целый ряд микроорганизмов, и, в частности, на те из них, которые в настоящее время являются резистентными к большинству антибиотиков (см. табл. 1). Но растет и перечень антибактериальных препаратов, к которым вырабатывается резистентность.
Таблица 1. Бактерии, проявляющие резистентность к антибиотикам
В целом в Англии наблюдалось 45%-ное увеличение случаев назначения антибиотиков за период между 1980 и 1991 гг., что составляет 5%–ное увеличение в год и связано с использованием антибиотиков для лечения респираторных заболеваний.
Следует отметить участившиеся случаи назначения цефалоспоринов, макролидов и хинолонов. Повышение резистентности к этим препаратам вызывает особое беспокойство, так как они используются для лечения очень опасных заболеваний, причем ситуация может усугубиться в случае, если резистентность будет расти.
Последствиями возросшей резистентности микроорганизмов являются увеличение сроков госпитализации, большие затраты на лечение, растущий уровень заболеваемости и смертности.
При современных масштабах международного туризма проблема резистентности к антибиотикам носит не только локальный, но и глобальный характер. Например, путешествия в развивающиеся страны обычно связаны с риском приобретения резистентной бактерии — Escherichia coli.
Структура восприимчивости имеет свои географические особенности, так как показатели резистентности в разных странах разные, что само по себе отражает уровень использования антибиотиков. Например, если взять Европу, то к югу от Скандинавии, в сторону стран Средиземноморья, наблюдается увеличение резистентности патогенных микроорганизмов к антибиотикам.
Степень проявления резистентности зависит не только от географических условий, но и от типа патогенных микроорганизмов, которые теоретически попадают под воздействие антибиотиков. Например, резистентность к пенициллину очень быстро возникла у Staphylococcus aureus, но понадобилось целых 50 лет, чтобы ее обрела Streptococcus pneumoniae, а у Streptococcus pyogenes это явление вообще начало проявляться лишь недавно. В настоящее время никто не может адекватно объяснить такой временной разницы.
В целом существует несколько резервуаров формирования резистентности к антибиотикам, к примеру животноводческие фермы, человеческая облигатная и условно-патогенная флора, клиническая изоляция. Степень значимости каждого из резервуаров не выявлена.
Основными условиями существования упомянутых выше резервуаров является плохое качество питьевой воды, антисанитарные условия, бесконтрольное применение антибиотиков, продающихся без рецептов, и их использование на животноводческих фермах для лечения животных, а также в малых дозах для ускорения роста молодняка.
Таблица 2 Новые подходы к борьбе с инфекциями
Например, известно, что использование триметоприма для лечения скота является одной из вероятных причин появления триметоприм-резистентной сальмонеллы. Кроме того, вызывает тревогу лицензирование таких ветеринарных препаратов, как квинолон и энрофлоксацин, поскольку хинолины могут потерять свою эффективность как основные препараты для лечения инвазивного сальмонеллеза.
Каковы бы ни были причины резистентности Salmonella, фактически зафиксировано 4-кратное увеличение мультирезистентности к антибиотикам за последние 13 лет. Существует предположение, что использование авопарцина (в ветеринарии — гликопептида) могло спровоцировать появление ванкомицин-резистентных энтерококков, микроорганизмов, которые могут соперничать с метициллин-резистентными Staphylococcus aureus по возможному отрицательному воздействию на макроорганизм.
Настораживает увеличение резистентности у ряда часто встречающихся микроорганизмов. Одним из наиболее устойчивых к антибиотикам патогенных микроорганизмов является пенициллин-резистентный пневмококк, впервые выявленный в 1967 г., а в настоящее время являющийся мультирезистентным. Штаммы этого пневмококка в настоящее время распространены во всем мире, особенно часто они встречаются в Испании, Южной Африке и Болгарии.
В Великобритании масштабы бедствия не столь велики: резистентность к пенициллину здесь повысилась с 1,5% в 1990 до 4% в 1995 г. Следует особо отметить появление резистентности пневмококков к эритромицину (до 9 % в 1995 г.), что делает бессмысленным использование этого препарата у пациентов с аллергической реакцией на пенициллин.
 |
| Рисунок 2. Антибиотики используются для ускорения роста домашних животных и в терапевтических целях |
Механизм, формирующий устойчивость к эритромицину, вызывает перекрестную резистентность к азитромицину и кларитромицину, что означает способность данного патогенного микроорганизма противостоять двум наиболее часто используемым антибиотикам первейшей необходимости.
Сегодняшний уровень резистентности пневмококков пока не может повлиять на основные направления лечения инфекционных заболеваний. Но при непрерывном повышении устойчивости к антибиотикам ситуация в будущем может измениться. Пневмонию, вызванную пневмококком, резистентным к пенициллину, сейчас можно лечить с помощью больших доз пенициллина (порядка 18 мегаединиц), но в случае менингита, вызванного тем же микроорганизмом, целесообразно использовать цефалоспорины.
В 70-х годах с Haemophilus influensae успешно боролись с помощью ампициллина. Однако приобретение данным патогенным микроорганизмом бета-лактамазы, способной ферментативно расщеплять бета-лактамное кольцо пенициллина, привело к тому, что 23% H. Influenzae стало ампициллин-резистентным.
С резистентностью можно справиться, если использовать бета-лактамазные ингибиторы, такие как клавулановая кислота. Однако наблюдается повышение устойчивости к ко-амоксиклаву благодаря измененным пенициллин-связывающим белкам, что привело к появлению 14% резистентных H. Influenzae. При столь распространенной резистентности к бета-лактамазе новые макролиды могут стать главным средством для лечения заболеваний, вызванных H. Influenzae.
Недавно в Великобритании и во всем остальном мире были зарегистрированы вспышки туберкулеза. Туберкулез — «капитан смерти» — стал теперь резистентным ко многим противотуберкулезным препаратам, поэтому в настоящее время рекомендуется множественная терапия.
Согласно исследованиям британских ученых, примерно в 10% случаев туберкулезная палочка резистентна хотя бы к одному противотуберкулезному препарату, хотя в США ситуация еще хуже, там нормой становится резистентность, равная 30%. Эти мультирезистентные штаммы не менее вирулентны и плохо поддаются лечению — иногда требуется длительная (в некоторых случаях многолетняя) терапия нового типа.
Работники больниц, где на патогенные микроорганизмы оказывается мощное селективное воздействие при помощи антибиотиков, много сил отдают борьбе с метициллин-резистентным Staphylococcus aureus, ванкомицин-резистентным enterococcus, мультирезистентными Escherichia coli и мультирезистентными Pseudomonas.
В 60-х годах главный хирург США объявил победу над инфекционными заболеваниями. Конечно, он был не прав, но действительно ли мы стоим на пороге эры постантибиотиков?
Терапевтические возможности для лечения ряда заболеваний сейчас сильно ограничены.
Таблица 3. Схема приобретения резистентности организмов к антибиотикам
Энтерококки стали серьезным источником внутрибольничной инфекции, главным образом из-за того, что пациенты в больницах представляют из себя наиболее ослабленную часть населения, требующую серьезной защиты от инфекций. Энтерококки являются резистентными ко многим антибиотикам, таким как цефалоспорины, хинолоны, аминогликозиды и некоторые пенициллины. К тому же недавно они обрели способность вырабатывать бета-лактамазу, стали устойчивыми к повышенным дозам аминогликозидов и, самое главное, у них появилась резистентность к ванкомицину и тейкопланину.
В настоящее время микробиологи заняты исследованием гипотетической ситуации, при которой ванкомицин-резистентные гены от мультирезистентных энтерококков могут перейти в популяцию метициллин-резистентных стафилококков, что станет причиной появления нового микроорганизма «Судного Дня» — S. аuraeus, устойчивого ко всем известным антибиотикам и вызывающего неизлечимые заболевания.
Возможен ли такой сценарий? Уже известно, что гены, ответственные за резистентность к ванкомицину, способны в лабораторных условиях передаваться к S. aureus, хотя полученная резистентность нестабильна.
Также известно, что резистентность энтерококков к гентамицину была приобретена от стафилококка. Если это так, то генетические элементы у них совместимы и генетический барьер может быть легко перейден.
Как снизить вероятность формирования резистентности к антибиотикам? Главное — устранение селективного воздействия антибиотиков на бактерии путем. Для этого необходимо соблюдение следующих условий.
Привлечение к работе местной микробиологической лаборатории, которая располагает информацией о чувствительности к антибиотикам в данном регионе. Строгий контроль за применением антибактериальных препаратов в каждом конкретном регионе.
Время бездумного использования антибиотиков прошло. Сейчас особенно важен ответственный подход к назначению антибиотиков, позволяющий контролировать резистентность микроорганизмов в лечебных учреждениях и в обществе в целом.
1. Service R. F. Antibiotics that resist resistance. Science 1995; 270:724-727.
2. Davey P. G., Bax R. P., Reeves D., Rutherford D., Slack, et al. Growth in the use of antibiotics in the community in England and Scotland in 1980-93. Br Med J 1996; 312:613
3. Holmberg SSSSD, Solomon S. L, Blake P. A. Health and economic aspect of antimicrobial resistance. Rev Inf Dis 1987; 9:1065-1078.
4. Hughes V. M., Datta N. Conjugative plasmids in bacteria of the ‘pre-antibiotic’ era. Nature 1983; 302:725-726.
5. Shanahan P. M. A., Thomson C. J., Amyes S. G. B. The global inpact of antibiotic-resistant bacteria: their sources and reservoirs. Rev Med Micro 1994; 5:1740-1782.
6. Frost J. A, Threfall E. J., Rowe B. Antibiotic resistance in salmonellas from humans in England and Waales: the situation in 1994. PHLS Microbiologi Digest 1996; 12: 131-133.
7. Johson A. P., Speller D. C. E., George R. C., Warner M., Domingue G., Efstratiou A. Prevalence of antibiotic resistance and serotypes in pneumococci in England and Wales:: results of observational surveys in 1990 and 1995. Br Med JJ 1996; 312:: 1454-1456.
8. James P. A., Lewis D. A., Cribb J., Dawson S. J., Murray S. A. The incidence and epidemiology of Beta-lactam resistance in Haemophilus influenzae. J Antimicrobial Chemo 1996; 37: 737-746.
9. Warburton A. R. E., Jenkins P. A., Waight P. A., Watson J. M. Drug resistance in initial isolates of Mycobacterium tuberculosis in England and Wales 1982-1991. CDR Rev 1993; 13:175-179.
10. Young L. Mycobacterial disease in the 1990’s. J Antimicrobial Chemo 1993; 32:179-174.
11. Report of the Expert Group on animal feeding stuffs. HMSO 1992.
12. Noble W. C., Virani Z., Cree R. G. A. Co-transfer of vancomycin and other resistance genes from E faecalis NCCTTC 12201 to S aureus. FEMS Microbiol Lett 1992; 93:195-198.
Природа резистентности
Как удалось бактериям всего за 60 лет научиться противостоять всем известным антибактериальным препаратам? Антибиотики являются естественными субстанциями (или химически модифицированными), вырабатываемыми рядом микроорганизмов.
Эти микроорганизмы экскретируют антибиотикоподобные вещества в окружающую среду, чтобы получить преимущество в условиях естественного отбора. Однако сам микроорганизм должен обладать защитными механизмами против собственного токсина. Таким образом, механизмы, позволяющие ликвидировать воздействие антибиотиков, появились в природе задолго до того, как они стали широко использоваться человеком. Поэтому можно утверждать, что резистентность к антибиотикам является предвестником эры постантибиотиков.
Механизмы резистентности (см. табл. 3) получают все более широкое распространение и укрепляют прежде восприимчивые популяции микроорганизмов.
Распространение резистентности обусловлено не только способностью микроорганизмов развивать устойчивость и существовать в определенной экологической нише (клональная экспансия), но и возможностью независимого переноса механизмов резистентности между различными видами бактерий с помощью мобильных генетических элементов.
В качестве примера можно привести следующий факт: пенициллин-резистентные пневмококки развивались клонально, и рассеивание плазмидов (мобильных генетических элементов) обусловило появление способности вырабатывать бета-лактамазу у таких разных организмов, как E. coli и H. influenzae.
Мероприятия против бактериальной инфекции
Возможно ли контролировать резистентность? Главным условием сдерживания резистентности является улучшение качества питьевой воды и санитарных условий. Антибиотики, используемые для лечения людей, не должны применяться в ветеринарной практике, что и было рекомендовано 5 лет назад экспертной группой по питанию животных.
В ряде стран следует ввести жесткий контроль за безрецептурной продажей антибиотиков. Селективное воздействие антибактериальных препаратов, связанное с неправильным назначением, можно и следует свести до минимума.
Фармацевтическая промышленность ищет принципиально новые химические структуры, нуклеотиды, способные ингибировать клеточные функции микроорганизмов, а также стремится разработать препараты, основное назначение которых — ликвидация механизмов резистентности путем блокирования ферментов и создание условий, исключающих удаление антибиотиков при помощи клеточных насосов.
Многие актуальные на сегодня методы лечения потеряют свою эффективность в будущем. Таким образом, крайне необходим постоянный контроль на международном, национальном и региональном уровнях за использованием антибиотиков и формированием к ним бактериальной резистентности.
Что означает появление резистентных к препарату вирусов
Последнее десятилетие ознаменовалось значительными успехами в снижении заболеваемости острым гепатитом В, что стало возможным благодаря успешной реализации программ массовой вакцинопрофилактики. Однако проблема гепатита В и сегодня продолжает сохранять свою актуальность в России и мире. Это связано с огромным числом лиц, хронически инфицированных вирусом гепатита В (ВГВ), и сохраняющейся высокой заболеваемостью хроническими формами этой инфекции. Заболеваемость хроническим гепатитом В (ХГВ) с 2000 г. и по настоящее время не имеет тенденции к снижению и составляет от 14 до 16 случаев на 100 тыс. населения. За тот же период времени наблюдалось некоторое снижение частоты регистрации носительства ВГВ (в 2,6 раза), однако абсолютные цифры остаются высокими: в 2008 г. в России выявлено 51 635 новых случаев носительства. Если принять во внимание отсутствие четких критериев дифференциального диагноза ХГВ и носительства вируса, вероятность активации инфекции в любой момент времени, а также неблагоприятные исходы болезни – цирроз и рак печени, значимость проблемы становится еще более очевидной.
Несмотря на появление новых противовирусных препаратов (ПВП) для лечения ХГВ, полное его излечение с эрадикацией вируса остается труднодостижимой целью. Имеющиеся данные о течении ХГВ и эффективности продолжительных курсов лечения ПВП позволяют понять важность длительного и глубокого подавления вирусной репликации. Современные ПВП на основе аналогов нуклеозидов и нуклеотидов дают возможность достичь такого эффекта, однако, как показывает практика, длительные курсы лечения связаны с риском развития резистентности вируса к этим препаратам. Развитие резистентности значительно ухудшает результаты лечения и исходы болезни. В настоящем обзоре рассмотрены причины и механизмы развития устойчивости вируса к ПВП, типы мутаций и вероятность их возникновения при лечении современными аналогами нуклеозидов и нуклеотидов. Кроме того, обсуждаются современные методы обнаружения мутаций, представлены рекомендации, позволяющие снизить риск возникновения устойчивости, и подходы к лечению пациентов с ХГВ в случае, если устой-чивость все же возникла.
Репликация ВГВ и механизмы развития устойчивости
ВГВ относится к семейству Hepadnaviridae и является ДНК-содержащим вирусом, геном которого состоит из 3,2 тыс. пар нуклеотидов, представляя собой кольцевую молекулу ДНК с незавершенной двуцепочечной структурой. Геном ВГВ содержит четыре участка, кодирующих вирусные белки (открытые рамки считывания), названных по соответствующим, частично перекрывающимся генам: S, C, P и Х. После проникновения ВГВ в гепатоцит вирусная ДНК попадает в ядро клетки, где происходит ее преобразование в кольцевую ковалентно замкнутую ДНК, после чего начинается транскрипция вирусных матричных РНК, включая самую длинную, называемую прегеномной. Прегеномная РНК является промежуточной стадией в цикле репликации ДНК ВГВ, матрицей для синтеза геномной ДНК с помощью обратной транскриптазы – фермента, кодируемого одним из генов вируса.
В процессе вирусной репликации мутации в геноме ВГВ происходят постоянно. Это связано с особенностями обратной транскриптазы, не обладающей т. н. редактирующей активностью, т. е. не исправляет внесенные ею ошибки встраивания нуклеотидов в процессе обратной транскрипции. Оценочная скорость спонтанных мутаций для ВГВ равна 1,4–3,2 × 10-5 нуклеотидных замен на сайт в одном цикле репликации [1, 2]. С учетом очень высокой скорости репликации ВГВ, составляющей более 1011 вирусных частиц в день, минимум 1010 точечных мутаций возникают в геноме ВГВ ежедневно [3]. Далеко не все мутации эволюционно закрепляются в вирусной популяции. Большинство спонтанно возникших мутаций приводит к тому, что новые варианты вируса оказываются менее репликативно активными или вовсе не способными к размножению и вытесняются т. н. диким вариантом вируса, т. е. вариантом без
мутаций. Однако при некоторых условиях, например в присутствии ПВП, когда репликация “дикого” варианта вируса подавлена, мутантные варианты, обладающие способностью к репликации в присутствии препарата, начинают доминировать в популяции вируса. Данные варианты вируса называются устойчивыми к противовирусному лечению, а мутации в геноме, обусловливающие такие их свойства, – мутациями устойчивости.
Механизм возникновения устойчивости вируса к ПВП, как правило, связан с тем, что возникшая мутация нарушает пространственное взаимодействие молекулы препарата с молекулой обратной транскриптазы вируса, несколько изменяя ее конформацию, что неоднократно было продемонстрировано в исследованиях с помощью трехмерного моделирования [4].
Устойчивость к противовирусным препаратам: терминология
На протяжении последних нескольких лет, когда накопился достаточный опыт использования ПВП в лечении ХГВ, рядом авторов были предприняты попытки стандартизации понятий, используемых при описании явлений, связанных с эффективностью лечения и развитием устойчивости к ПВП [5–10]. Наиболее важными являются понятия ответа на лечение, резистентности или устойчивости к лечению, рецидива на фоне лечения.
Поскольку при ХГВ полная эрадикация вируса практически невозможна, целью лечения является снижение риска развития неблагоприятных исходов заболевания (цирроза и рака печени), что может быть достигнуто при стойком подавлении репликации вируса [8, 9]. Именно поэтому измерение концентрации ДНК ВГВ в крови, которая отражает активность вирусной репликации, и стало основным критерием оценки ответа на лечение. Наиболее часто используется термин “вирусологический ответ”. Вирусологическим ответом на лечение аналогами нуклеозидов и нуклеотидов при ХГВ считают отсутствие ДНК ВГВ в плазме крови на 48-й неделе лечения при исследовании современными высокочувствительными методами [8]. Большинство современных методов выявления ДНК ВГВ в плазме крови имеют чувствительность 10–20 МЕ/мл, что ориентировочно равно 50–100 копиям вирусной ДНК на мл.
Частичный вирусологический ответ определяется как наличие ДНК ВГВ на 24-й (для препаратов с низким генетическим барьером) или 48-й неделе лечения (для препаратов с высоким генетическим барьером или низким риском развития устойчивости на ранних этапах лечения) при условии, что ее концентрация снизилась более чем на 1 log10 МЕ/мл (более чем в 10 раз) от начального уровня [8]. Генетический барьер определяется минимальным количеством мутаций, которые одновременно должны возникнуть в геноме ВГВ, чтобы вирус приобрел устойчивость к данному препарату [11]. Так, ламивудин (ЛМВ) и телбивудин (ТБВ) являются препаратами с низким генетическим барьером, т. к. достаточно всего лишь одной мутации в геноме ВГВ для развития устойчивости к ним. Энтекавир (ЭТВ) относят к препаратам с высоким генетическим барьером, ибо необходимо не менее трех одновременно возникших мутаций в геноме ВГВ для развития устойчивости к нему. Подробнее этот вопрос будет рассмотрен далее.
Вирусологический рецидив определяют как возрастание концентрации ДНК ВГВ в плазме крови более чем на 1 log10 МЕ/мл (более чем в 10 раз) от минимального уровня, достигнутого в процессе лечения, на фоне продолжающегося приема препарата [5–10]. О вирусологическом рецидиве можно говорить только у пациента, сохраняющего приверженность лечению и ранее достигшего вирусологического ответа. Факт возрастания концентрации вируса должен быть подтвержден повторным исследованием с интервалом в месяц. Если возрастание концентрации ДНК ВГВ сопровождается подъемом уровня трансаминаз, повторное подтверждающее исследование может не проводиться.
Биохимическим рецидивом называют возрастание уровня аланинаминотрансферазы (АЛТ) в сыворотке крови после его нормализации в процессе лечения на фоне продолжающегося приема препарата у пациента, приверженного лечению [5–10]. Биохимический рецидив обычно наступает после вирусологического рецидива. Однако АЛТ может быть в пределах нормальных значений в течение длительного времени после развития устойчивости к препарату, поэтому данный параметр нельзя считать достаточно чувствительным к обнаружению резистентности.
О первичной резистентности говорят, если на 12-й неделе лечения наблюдается снижение концентрации ДНК ВГВ менее чем на 1 log10 МЕ/мл (менее чем в 10 раз) от начального ее уровня [6, 8, 10]. Причинами первичной резистентности к лечению могут быть факторы, связанные с особенностями пациента, вируса или препарата. Так, это может быть генетический полиморфизм ферментов, участвующих в превращении действующего вещества ПВП в активную форму или фосфорилировании аналогов нуклеозидов до трифосфатов [12]. Доза препарата и его способность подавлять репликацию вируса также играют немаловажную роль [13]. Кроме того, не исключена возможность заражения штаммом вируса, изначально обладающим генетическими факторами устойчивости к препарату.
Генотипической резистентностью ВГВ к аналогам нуклеозидов и нуклеотидов называют факт обнаружения мутаций в геноме вируса, связь которых с возникновением устойчивости к данному ПВП была ранее подтверждена в исследованиях in vitro [5, 7, 9, 10]. Как правило, мутации устойчивости возникают в гене обратной транскриптазы и приводят к аминокислотным заменам в структуре фермента, что в свою очередь нарушает его взаимодействие с препаратом. Возникновение мутаций устойчивости является наиболее частой причиной вирусологического рецидива в процессе лечения.
Под фенотипической резистентностью понимают сниженную чувствительность ВГВ к ПВП при исследовании in vitro [5, 9, 10]. Такие исследования проводят для подтверждения связи мутации в геноме ВГВ с устойчивостью к лекарственному препарату.
Номенклатура мутаций устойчивости
Ключевым понятием при обсуждении вопроса устойчивости ВГВ к ПВП являются мутации устойчивости. Как упоминалось ранее, мутации устойчивости ВГВ к аналогам нуклеозидов и нуклеотидов, как правило, возникают в гене обратной транскриптазы вируса, являющейся мишенью для препаратов этих групп. Мутации, связанные с устойчивостью, подразделяют на первичные и вторичные. Первичные мутации устойчивости приводят к замене аминокислот в структуре фермента, снижая его чувствительность к препарату [5, 6]. Тем самым вирус приобретает способность к репликации в присутствии ПВП. Однако в большинстве случаев такие мутации приводят одновременно и к снижению репликативной активности вируса по сравнению с его “диким” вариантом. Вторичные, компенсаторные мутации ведут к аминокислотным заменам в структуре фермента, которые восстанавливают функциональные дефекты его активности, возникшие вследствие первичных мутаций устойчивости [5, 6].
Современная система обозначения мутаций устойчивости ВГВ была предложена Stuyver и соавт. в 2001 г. [14]. Так как длина генома ВГВ для разных генотипов вируса несколько отличается, во избежание путаницы авторы предложили нумеровать мутации устойчивости в соответствии с номером аминокислоты в домене обратной транскриптазы. Регион обратной транскриптазы гена вирусной полимеразы (P) имеет одинаковую длину для всех генотипов вируса. Обозначение мутации устойчивости начинается с букв “rt” (от reverse transcriptase – обратная транскриптаза), затем следует однобуквенное обозначение аминокислоты, которая стоит в данном положении у “дикого” варианта вируса, затем – номер кодона (аминокислоты) в домене обратной транскриптазы и наконец – обозначение аминокислоты, которая оказывается в данном положении в результате мутации. Так, например, одна из первичных мутаций устойчивости к ЛМВ обозначается как rtM204V, что означает замену метионина на валин в 204-м положении домена обратной транскриптазы ВГВ. Ранее мутация в этом положении называлась YMDD-мутацией (соответственно, мутантный вариант обозначали как YVDD). Однако данная система обозначения устарела.
Факторы, связанные с формированием устойчивости
Вероятность возникновения устойчивости к ПВП при ХГВ зависит от ряда факторов, связанных с особенностями пациента, характеристиками вируса и курса лечения, а также со свойствами самого препарата.
В ряде исследований показано, что мужской пол, более старший возраст, высокий индекс массы тела, повышенный уровень аминотрансфераз, высокие уровень вирусной нагрузки и индекс гистологической активности, а также наличие мутаций в области coreпромотора генома ВГВ связаны с повышенным риском развития устойчивости к ЛМВ [15–20]. Нельзя полностью исключать влияния генотипа вируса на
риск развития мутаций устойчивости. В нескольких исследованиях наблюдалась более высокая частота возникновения мутаций устойчивости к ЛМВ и адефовиру (АДВ) для генотипов А и D соответственно [21–24]. Однако в большинстве исследований связи генотипа ВГВ с ответом на лечение аналогами нуклеозидов и нуклеотидов отмечено не было [25–27].
Недостаточное подавление вирусной репликации в процессе лечения также является фактором, предрасполагающим к развитию лекарственной устойчивости. Как было показано в исследовании Yuen и соавт., частота возникновения мутаций устойчивости к ЛМВ тем выше, чем выше концентрация ДНК ВГВ на 24-й неделе лечения [28].
Мутации устойчивости ВГВ к аналогам нуклеозидов и нуклеотидов
Накопившийся опыт изучения мутаций устойчивости ВГВ к аналогам нуклеозидов и нуклеотидов показывает, что существует некоторая зависимость между химической структурой препарата и спектром возникающих мутаций устойчивости [29].
По химической структуре аналоги нуклеозидов и нуклеотидов подразделяются на три группы:
• группа аналогов L-нуклеозидов: ЛМВ, ТБВ, эмтрицитабин (МТБ) *, клевудин (КЛВ) *;
• группа карбоциклических аналогов нуклеозидов: ЭТВ;
• группа ациклических С-фосфонатов нуклеотидов: АДВ *, тенофовир (ТФВ) *.
* На январь 2010 г. в России не зарегистрированы.
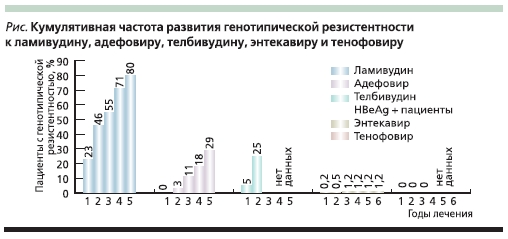
Частота развития резистентности к аналогам нуклеозидов и нуклеотидов приведена на рисунке. Резистентность к ЛМВ прогредиентно нарастает с каждым годом лечения и достигает 80 % к пятому году [30]. Частота развития резистентности к ТБВ несколько ниже, но по сравнению с препаратами других групп достаточно высока. Уже на втором году лечения частота генотипической резистентности достигает 11 % при HBeAg-негативном и 25 % при HBeAg-позитивном ХГВ [31, 32]. Скорость развития устойчивости к АДВ ниже, чем для препаратов из группы аналогов L-нуклеозидов, но было показано, что к 5-му году лечения HBeAg-негативного ХГВ устойчивость к препарату развивается почти у 30 % пациентов [33]. Опыт применения ТФВ при ХГВ пока невелик, однако клинические исследования не выявили развития резистентности к данному препарату в течение 144 недель лечения, что свидетельствует о его хороших перспективах [34, 35]. Очень низкая частота развития мутаций устойчивости характерна для ЭТВ. Через 6 лет лечения у пациентов, ранее не получавших ПВП, частота возникновения генотипической резистентности не превышала 1,2 % [36, 37]. Однако у пациентов, ранее получавших ЛМВ, частота мутаций устойчивости к ЭТВ была значительно выше и достигала почти 60 % на 6-м году лечения [36, 37]. Эти данные подчеркивают целесообразность применения ЭТВ для лечения ХГВ в качестве препарата первой линии. Частота развития резистентности к ПВП в основном определяется двумя главными факторами: способностью препарата подавлять репликацию вируса и его генетическим барьером к резистентности (см. таблицу).
Таблица. Характеристика аналогов нуклеозидов и нуклеотидов по противовирусной активности
и генетическому барьеру к резистентности.
Мутации устойчивости к аналогам L-нуклеозидов
Все препараты данной группы имеют сходную структуру молекулы и механизм действия, как следствие – сходный спектр мутаций устойчивости в геноме ВГВ [38, 39]. Очевидно, что внутри группы наблюдается перекрестная резистентность. Аналоги L-нуклеозидов имеют низкий генетический барьер, следовательно, характеризуются высоким риском развития устойчивости к ним. Достаточно всего одной мутации в геноме ВГВ, чтобы возникла устойчивость к препаратам данной группы. Основными первичными мутациями устойчивости к ЛМВ являются rtM204V и rtM204I (могут обозначаться как rtM204V/I) [40]. Для ТБВ более характерна первичная мутация устойчивости rtM204I [41]. Однако мутация rtM204V совместно с компенсаторной мутацией rtL180M приводит к снижению чувствительности к ТБВ [www.fda.gov]. В исследованиях in vitro показано, что мутация rtM204V/I снижает чувствительность обратной транскриптазы ВГВ к ЛМВ более чем в 1000 раз [40]. В ряде исследований выявлено, что мутация rtA181T/V также вызывает резистентность к ЛМВ и ТБВ, а также является первичной мутацией [42]. Было замечено, что данная мутация вызывает перекрестную резистентность к АДВ [43]. Вторичными компенсаторными мутации для этой группы препаратов являются rtL80V/I, rtV173L и rtL180M [44–46].
Мутации устойчивости к карбоциклическим аналогам нуклеозидов
Единственным представителем данной группы препаратов для лечения ХГВ является ЭТВ. Он обладает высоким генетическим барьером, как следствие – риск развития устойчивости к нему очень низок. В геноме ВГВ должно произойти не менее трех мутаций, чтобы возникла устойчивость к ЭТВ. Для возникновения вирусологического рецидива в процессе лечения ЭТВ обязательно наличие классической мутации резистентности к аналогам L-нуклеозидов rtM204V/I [47]. В отсутствие нее все остальные мутации, характерные для устойчивости к ЭТВ, приводят к умеренному снижению чувствительности ВГВ к препарату (менее чем в 10 раз). Тогда как при наличии данной мутации совместно с несколькими другими чувствительность к препарату может снижаться более чем в 1000 раз [47, 48]. Развитие резистентности к ЭТВ сопровождается возникновением следующих мутаций помимо описанных выше: rt169T, rtL180M, rtT184A/F/G/I/L/S, rtS202G/I и rtM250V. Описано два основных сочетания мутаций
устойчивости к ЭТВ, подтвержденных исследованиями in vitro. К ним относятся rtI69T + rtL180M + rtM204V +rtM250V и rtL180M + rtT184G + rtS202I + rtM204V [47, 48]. Сообщалось также о некоторых других возможных сочетаниях мутаций [49].
Мутации устойчивости к ациклическим С-фосфонатам нуклеотидов
В ряде исследований установлено, что первичными мутациями устойчивости к АДВ являются rtA181T/V и rtN236T [43, 50]. Было отмечено, что данные мутации приводят к умеренному снижению чувствительности вируса к препарату. В in vitro-исследованиях требовалось лишь 3–8-кратное увеличение концентрации препарата для подавления вирусной репликации на 50 % [51]. В исследованиях in vitro было также доказано, что мутация rtN236T практически не влияет на чувствительность ВГВ к ЛМВ, ТБВ и ЭТВ, однако снижает эффективность ТФВ [52]. Мутация rtA181T/V снижает чувствительность ВГВ к АДВ и ТФВ, частично вызывает перекрестную резистентность к ЛМВ и ТБВ [43]. В одном из исследований отмечено, что мутация rtI233V также может вызывать устойчивость к АДВ [53], однако данный факт требует дополнительного изучения, т. к. в других исследованиях такой связи выявлено не было [54, 55]. Sheldon J. и соавт. в своем исследовании выявили мутацию rtA194T, в сочетании с rtL180V + rtM204V связанную с развитием устойчивости к ТФВ [56]. Однако другим авторам данную находку подтвердить не удалось, что свидетельствует о необходимости дальнейших исследований [57].
Методы обнаружения мутаций устойчивости
Наиболее часто для обнаружения мутаций устойчивости используют методы на основе секвенирования (определения последовательности нуклеотидов) фрагмента генома ВГВ, в котором возникают такие мутации (ген полимеразы/обратной транскриптазы ВГВ), или методы на основе гибридизации. Наиболее простым и доступным в России является метод прямого секвенирования.Метод позволяет выявлять любые мутации устойчивости, если доля мутантного варианта вируса превышает 20 % [6, 7]. Предварительное клонирование продукта амплификации и последующее секвенирование большого количества клонов могут значительно повысить чувствительность метода к минорным вариантам вируса, однако такая модификация метода крайне трудоемка. Примером коммерческой технологии выявления мутаций устойчивости на основе секвенирования является разработка компании Visible Genetics TRUGENE HBV (Siemens Health Care Diagnostics Solutions).
Гибридизационные методы основаны на использовании специфических к данным мутациям ДНК-зондов для выявления мутаций. Особенностью методов на основе гибридизации является их более высокая чувствительность к мутантным вариантам вируса. Достаточно 5–10 %-мутантного варианта в вирусной популяции, чтобы он мог быть обнаруженным с помощью методов гибридизации [6]. Примером коммерческой тест-системы на основе гибридизационной технологии для обнаружения мутаций устойчивости в геноме ВГВ является INNO-LiPA HBV DR v.3 (компания Innogenetics). Обнаружение мутаций с помощью ДНК-чипов также основано на технологии гибридизации с ДНК-зондами.
Перспективной технологией выявления мутантных вариантов в вирусной популяции является пиросеквенирование. Большим преимуществом данного метода является его высокая чувствительность к минорному варианту вируса, который может быть выявлен, даже если его доля не превышает 0,1 %.
Однако пока данная технология малодоступна [6].
Для научных исследований иногда используют и другие методы обнаружения мутаций устойчивости, включая MALDI-TOF масс-спектрометрию, однако такие методы, как правило, требуют сложного оборудования и малопригодны к использованию в клинической практике.
Как избежать развития устойчивости ВГВ к лечению?
Снизить риск развития устойчивости ВГВ к лечению возможно. Для этого следует строго следовать ряду правил, выработать которые позволили достаточно длительная практика использования ПВП при ХГВ и результаты широкомасштабных клинических исследований. Одно из главных правил – избегать лечения ПВП, если в этом нет абсолютной необходимости [6–10]. Правильно принять решение относительно назначения лечения позволяет следование международным рекомендациям, которые практически ежегодно обновляются ведущими профессиональными ассоциациями (например, Американской ассоциацией по изучению заболеваний печени [AASLD] и Европейской ассоциацией по изучению печени [EASL]) с учетом современных представлений и новых данных.
Второе правило – если лечение необходимо, правильно подбирать ПВП с учетом его свойств и данных о риске развития устойчивости. Поскольку мутации возникают в процессе репликации вируса, начатое лечение должно как можно быстрее и глубже ее подавить. Очевидно, что в качестве первой линии следует отдавать предпочтение препаратам с высокой эффективностью подавления репликации ВГВ и низким риском развития устойчивости – ЭТВ и ТФВ [6–10].
Третье важное правило – по возможности избегать последовательного лечения несколькими ПВП [6–9], что может способствовать возникновению вариантов вируса с множественной лекарственной устойчивостью. Возможным решением является лечение комбинацией нескольких препаратов,
не имеющих перекрестной устойчивости. Однако данных об эффективности и безопасности такого лечения пока недостаточно [10].
Четвертое правило – регулярно и правильно следить за эффективностью проводимого лечения.
Детальные рекомендации по мониторингу эффективности лечения приводятся в международных рекомендациях [8, 9]. Общим принципом является исследование концентрации ДНК ВГВ в плазме крови каждые 3–6 месяцев в процессе лечения. Особенно внимательно необходимо следить за эффективностью, если лечение все же было начато препаратами с высоким риском развития устойчивости (ЛМВ, ТБВ).
В этом случае исследование вирусной нагрузки необходимо проводить каждые три месяца. Если вирусная нагрузка возрастет в 10 раз и более относительно минимального значения достигнутого в процессе лечения, необходимо провести исследование на мутации устойчивости и подобрать оптимальную схему дальнейшего лечения. Последнее, но крайне важное правило – убедить пациента в необходимости быть приверженным лечению. Отсутствие приверженности – самая частая причина безуспешного противовирусного лечения [6–10].
Лечение ХГВ, вызванного резистентным штаммом вируса
Если в процессе лечения возник вирусологический рецидив, необходимо провести исследование на выявление мутаций устойчивости в геноме ВГВ. Выявленный спектр мутаций является крайне важным при определении дальнейшей тактики лечения пациента. Для определения дальнейшей тактики важно также учитывать данные о ранее проводившемся лечении и его эффективности. Международные рекомендации по выбору препаратов для лечения ХГВ, вызванного устойчивыми штаммами, опираются на результаты исследований перекрестной резистентности [8, 9]. Как правило, рекомендуется добавлять к лечению препарат, не имеющий перекрестной резистентности. В ряде случаев может быть выбрана тактика переключения на другой препарат или их комбинацию. Однако тактика добавления всегда предпочтительней тактики переключения во избежание формирования вариантов вируса с множественной лекарственной устойчивостью. Особенностью ситуации в России является отсутствие зарегистрированных препаратов из группы ациклических С-фосфанатов нуклеотидов (АДВ и ТФВ). Данные препараты являются ключевыми при лечении ХГВ, вызванного вариантами вируса, устойчивыми к ЛМВ, ТБВ и ЭТВ [8, 9]. В этой ситуации единственным вариантом лечения при устойчивости к ЛМВ и ТБВ является назначение ЭТВ в дозе 1 мг в сутки, что не представляется идеальной тактикой, поскольку со временем неуклонно ведет к формированию ЭТВ-резистентных штаммов ВГВ. Для лечения ХГВ, вызванного ЭТВ-резистентными вариантами вируса,
препаратов, доступных на российском рынке, нет. С учетом этого крайне актуальным становится соблюдение описанных выше правил, позволяющих предотвращать развитие лекарственной устойчивости.
Заключение
С расширением спектра ПВП для лечения ХГВ проблема резистентности становится все более и более актуальной. С учетом уроков, полученных при использовании ПВП в лечении ВИЧ-инфекции, следует принимать всевозможные меры для предотвращения развития резистентности к лечению
и распространения вариантов вируса, обладающих мутациями устойчивости к лечению. Кроме того, очевидной является необходимость обеспечения регулярного мониторинга за циркуляцией резистентных к ПВП штаммов ВГВ. Использование в клинической практике современных молекулярных методов диагностики, таких как измерение вирусной нагрузки и выявление мутаций устойчивости в геноме вируса, позволяет своевременно оценивать эффективность проводимого лечения и при необходимости обоснованно корректировать его. Дальнейшие исследования проблемы устойчивости при использовании имеющихся ПВП и их комбинаций позволят разработать научно обоснованные рекомендации по наиболее эффективной тактике лечения ХГВ. Крайне актуальной является разработка новых ПВП с механизмами действия, отличными от таковых существующих аналогов нуклеозидов и нуклеотидов.
Литература
1. Okamoto H, Imai M, Kametani M, et al. Genomic heterogeneity of hepatitis B virus in a 54-yearold woman who contracted the infection through materno-fetal transmission. Jpn J Exp Med 1987;57:231–36.
2. Girones R, Miller RH. Mutation rate of the hepadnavirus genome. Virology 1989;170:595–97.
3. Nowak MA, Bonhoeffer S, Hill AM, et al. Viral dynamics in hepatitis B virus infection. Proc Natl Acad Sci USA 1996;93:4398–402.
4. Chong Y, Stuyver L, Otto MJ, et al. Mechanism of antiviral activities of 30-substituted L-nucleosides against 3TC resistant HBV polymerase: a molecular modelling approach. Antivir Chem Chemother 2003;14:309–19.
5. Lok AS, Zoulim F, Locarnini S, et al. Antiviral drug-resistant HBV: Standardization of nomenclature and assays and recommendations for management. Hepatology 2007;46:254–65.
6. Zoulim F, Locarnini S. Hepatitis B virus resistance to nucleos(t)ide analogues. Gastroenterology 2009;137:1593–608.
7. Ghany MG, Doo EC. Antiviral resistance and hepatitis B therapy. Hepatology 2009; 49:174–84.
8. European Association For The Study Of The Liver: EASL Clinical Practice Guidelines: management of chronic hepatitis B. J Hepatol 2009;50:227–42.
9. Lok AS, McMahon BJ: Chronic hepatitis B: update 2009. Hepatology 2009;50:661–62.
10. Zoulim F, Durantel D, Deny P. Management and prevention of drug resistance in chronic hepatitis B. Liver Int 2009;29:108–15.
11. Yuen MF, Fung J, Wong DK, et al. Prevention and management of drug resistance for antihepatitis B treatment. Lancet Infect Dis 2009;9:256–64.
12. Hulgan T, Haas DW: Toward a pharmacogenetic understanding of nucleotide and nucleoside analogue toxicity. J Infect Dis 2006;194:1471–74.
13. Marcellin P, Chang TT, Lim SG, et al. Adefovir dipivoxil for the treatment of hepatitis B e antigenpositive chronic hepatitis B. N Engl J Med 2003;348:808–16
14. Stuyver LJ, Locarnini SA, Lok A, et al. Nomenclature for antiviral-resistant human hepatitis B virus mutations in the polymerase region. Hepatology 2001;33:751–57.
15. Lai CL, Dienstag J, Schiff E, et al. Prevalence and Clinical Correlates of YMDD Variants during Lamivudine Therapy for Patients with Chronic Hepatitis B. Clin Infect Dis 2003;36:687–96.
16. Yuen MF, Chow DH, Tsui K, et al. Liver histology of Asian patients with chronic hepatitis B on prolonged lamivudine therapy. Aliment Pharmacol Ther 2005;21:841–49.
17. Chae HB, Hann HW. Baseline HBV DNA level is the most important factor associated with virologic breakthrough in chronic hepatitis B treated with lamivudine. World J Gastroenterol 2007;13:4085–90.
18. Chang ML, Chien RN, Yeh CT, et al. Virus and transaminase levels determine the emergence of drug resistance during long-term lamivudine therapy in chronic hepatitis B. J Hepatol 2005;43:72–7.
19. Zoulim F, Buti M, Lok AS. Antiviral-resistant hepatitis B virus: can we prevent this monster from growing? J Viral Hepat 2007;14:29–36.
20. Zoulim F, Poynard T, Degos F, et al. A prospective study of the evolution of lamivudine resistance mutations in patients with chronic hepatitis B treated with lamivudine. J Viral Hepat 2006;13:278–88.
21. Kobayashi M, Suzuki F, Akuta N, et al. Response to long-term lamivudine treatment in patientsinfected with hepatitis B virus genotypes A, B, and C. J Med Virol 2006;78:1276–83.
22. Schildgen O, Sirma H, Funk A, et al. Variant of hepatitis B virus with primary resistance to adefovir. N Engl J Med 2006;354:1807–12.
23. Osiowy C, Villeneuve JP, Heathcote EJ, et al. Detection of rtN236T and rtA181V/T mutations associated with resistance to adefovir dipivoxil in samples from patients with chronic hepatitis B virus infection by the INNO-LiPA HBV DR line probe assay (version 2). J Clin Microbiol 2006;44:1994–97.
24. Fung SK, Chae HB, Fontana RJ, et al. Virologic response and resistance to adefovir in patients with chronic hepatitis B. J Hepatol 2006;44:283–90.
25. Westland C, Delaney W 4th, et al. Hepatitis B virus genotypes and virologic response in 694 patients in phase III studies of adefovir dipivoxil1. Gastroenterology 2003;125:107–16.
26. Zollner B, Petersen J, Puchhammer-Stockl E, et al. Viral features of lamivudine resistant hepatitis B genotypes A and D. Hepatology 2004; 39:42–50.
27. Yuen MF, Wong DK, Sablon E, et al. Hepatitis B virus genotypes B and C do not affect the antiviral response to lamivudine. Antivir Ther 2003;8:531–34.
28. Yuen MF, Sablon E, Hui CK, et al. Factors associ ated with hepatitis B virus DNA breakthrough in patients receiving prolonged lamivudine therapy. Hepatology 2001;34:785–91.
29. Locarnini S. Primary resistance, multidrug resistance, and cross-resistance pathways in HBV as a consequence of treatment failure. Hepatol Int 2008;2:147–51.
30. Lai CL, Dienstag J, Schiff E, et al. Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B. Clin Infect Dis 2003;36:687–96.
31. Lai CL, Gane E, Liaw YF, et al. Globe Study Group Telbivudine versus lamivudine in patients with chronic hepatitis B. N Engl J Med. 2007;357(25):2576–88.
32. Liaw YF, Gane E, Leung N, et al. GLOBE Study Group 2-Year GLOBE trial results: telbivudine Is superior to lamivudine in patients with chronic hepatitis B. Gastroenterology 2009;136(2):486–95.
33. Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years. Gastroenterology 2006;131:1743–51.
34. Marcellin P, M Buti, Z Krastev, et al. Three Years of Tenofovir Disoproxil Fumarate (TDF) Treatment in HBeAg-Negative Patients with Chronic Hepatitis B (Study 102); Preliminary Analysis. 60th Annual Meeting of the American Association for the Study of Liver Diseases (AASLD 2009). Boston. 2009.
35. Heathcote EJ, Gane, RA De Man, at al. Three Years of Tenofovir Disoproxil (TDF) Treatment in HBeAg-Positive Patients (HBeAg+) with Chronic Hepatitis B (Study 103), Preliminary Analysis. 60th Annual Meeting of the American Association for the Study of Liver Diseases (AASLD 2009). Boston. 2009.
36. Tenney DJ, Rose RE, Baldick CJ, et al. Longterm monitoring shows hepatitis B virus resistance to entecavir in nucleoside-naive patients is rare through 5 years of therapy. Hepatology 2009;49:1503–14.
37. Tenney DJ, Pokornowski KA, Rose RE, et al. Entecavir maintains a high genetic barrier to HBV resistance through 6 years in nave patients. J Hepatol 2009;50:10.
38. Locarnini S, Hatzakis A, Heathcote J, et al. Management of antiviral resistance in patients with chronic hepatitis B. Antivir Ther 2004;9:679–93.
39. Ghany M, Liang TJ. Drug targets and molecular mechanisms of drug resistance in chronic hepatitis B. Gastroenterology 2007;132:1574–85.
40. Allen MI, Deslauriers M, Andrews CW, et al. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Lamivudine Clinical Investigation Group. Hepatology 1998;27:1670–77.
41. Seifer M, Patty A, Serra I, et al. Telbivudine, a nucleoside analog inhibitor of HBV polymerase, has a different in vitro cross-resistance profile than the nucleotide analog inhibitors adefovir and tenofovir. Antiviral Res 2009;81:147–55.
42. Yeh CT, Chien RN, Chu CM, et al. Clearance of the original hepatitis B virus YMDD-motif mutants with emergence of distinct lamivudineresistant mutants during prolonged lamivudine therapy. Hepatology 2000;31:1318–26.
43. Villet S, Pichoud C, Billioud G, et al. Impact of hepatitis B virus rtA181V/T mutants on hepatitis B treatment failure. J Hepatol 2008; 48:747–55.
44. Ono SK, Kato N, Shiratori Y, et al. The polymerase L528M mutation cooperates with nucleotide binding-site mutations, increasing hepatitis B virus replication and drug resistance. J Clin Invest 2001;107:449–55.
45. Delaney WE 4th, Yang H, Westland CE, et al. The hepatitis B virus polymerase mutation rtV173L is selected during lamivudine therapy and enhances viral replication in vitro. J Virol 2003;77:11833–41.
46. Gutfreund KS, Williams M, George R, et al. Genotypic succession of mutations of the hepatitis B virus polymerase associated with lamivudine resistance. J Hepatol 2000;33:469–75.
47. Tenney DJ, Levine SM, Rose RE, et al. Clinical emergence of entecavir-resistant hepatitis B virus requires additional substitutions in virus already resistant to Lamivudine. Antimicrob Agents Chemother 2004;48:3498–507.
48. Baldick CJ, Tenney DJ, Mazzucco CE, et al. Comprehensive evaluation of hepatitis B virus reverse transcriptase substitutions associated with entecavir resistance. Hepatology 2008;47:1473–82.
49. Yim HJ, Hussain M, Liu Y, et al. Evolution of multidrug resistant hepatitis B virus during sequential therapy. Hepatology 2006;44:703–12.
50. Angus P, Vaughan R, Xiong S, et al. Resistance to adefovir dipivoxil therapy associated with the selection of a novel mutation in the HBV polymerase. Gastroenterology 2003;125:292–97.
51. Shaw T, Bartholomeusz A, Locarnini S. HBV drug resistance: Mechanisms, detection and interpretation. J Hepatol 2006;44:593–606.
52. Brunelle MN, Jacquard AC, Pichoud C, et al. Susceptibility to antivirals of a human HBV strain with mutations conferring resistance to both lamivudine and adefovir. Hepatology 2005;41:1391–98.
53. Schildgen O, Sirma H, Funk A, et al. Variant of hepatitis B virus with primary resistance to adefovir. N Engl J Med 2006;354:1807–12.
54. Carrouee-Durantel S, Durantel D, WerleLapostolle B, et al. Suboptimal response to adefovir dipivoxil therapy for chronic hepatitis B in nucleoside-naive patients is not due to pre-existing drug-resistant mutants. Antivir Ther 2008;13:381–88.
55. Curtis M, Zhu Y, Borroto-Esoda K. Hepatitis B virus containing the I233V mutation in the polymerase reverse-transcriptase domain remains sensitive to inhibition by adefovir. J Infect Dis 2007;196:1483–86.
56. Sheldon J, Camino N, Rodes B, et al. Selection of hepatitis B virus polymerase mutations in HIV-coinfected patients treated with tenofovir. Antivir Ther 2005;10:727–34.
57. Delaney WE 4th, Ray AS, Yang H, et al. Intracellular metabolism and in vitro activity of tenofovir against hepatitis B virus. Antimicrob Agents Chemother 2006; 50:2471–77.