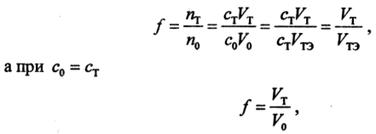Что показывает кривая титрования
Что показывает кривая титрования
В методах, основанных на реакциях кислотно-основного взаимодействия, кривые титрования обычно показывают зависимость pH раствора от объема добавленного титранта. Для построения кривой титрования рассчитывают значения pH : 1) до точки эквивалентности (т.э.); 2) в т.э.; 3) после т.э.
Кривая титрования сильной кислоты сильным основанием

Прямую, параллельную оси абсцисс и пересекающую ось ординат при pH 7,0, называют линией нейтральности. Прямую, параллельную оси ординат и пересекающую ось абсцисс при значении эквивалентного объема щелочи ( VNaOH =100,0 мл), называют линией эквивалентности. Точку пересечения кривой титрования с линией эквивалентности, называют точкой эквивалентности, а пересечение кривой титрования с линией нейтральности – точкой нейтральности.
При титровании сильной кислоты сильным основанием точка эквивалентности и точка нейтральности совпадают.
В начале титрования pH изменяется очень медленно. Например, если оттитровать половину имеющегося количества кислоты ( V NaOH =50,0 мл), pH среды изменится примерно на 0,5 единицы по сравнению с исходным (от 1,00 до 1,48). Даже если оттитровать 90% кислоты, изменение pH составит всего 1,28. С уменьшением концентрации остающейся кислоты возрастание pH при титровании становится более резким. Титрование последних 0,1% кислоты приводит к резкому изменению pH на 2,7 единицы (от 4,30 до 7,00). Введение избытка в 0,1% NaOH по сравнению с эквивалентным количеством вызывает рост pH раствора также на 2,7 единицы.
Резкое изменение pH в области точки эквивалентности называют скачком титрования.
Это наиболее важный участок кривой титрования, так как по нему осуществляется выбор индикатора и решается ряд других важных вопросов, связанных с процессом титрования.
Погрешности многих титриметрических методов не превышают 0,1%, поэтому величиной скачка считают изменение pH от состояния, когда раствор недотитрован на 0,1%, к состоянию, когда он на 0,1% перетитрован. В рассматриваемом случае при интервале ± 0,1% скачок титрования составляет 5,4 единиц (от 4,3 до 9,7). Расчеты показывают, что величина скачка титрования зависит от концентрации реагирующих веществ. Чем ниже концентрация реагентов, тем меньше скачок титрования. Повышение температуры также уменьшает скачок титрования.
Кривая титрования сильного основания сильной кислотой рассчитывается аналогично и представляет собой зеркальное отображение (относительно линии нейтральности) кривой титрования сильной кислоты сильным основанием.
Кислотно-основные индикаторы и их выбор
Для обнаружения точки эквивалентности применяют индикаторы. В кислотно-основном титровании наиболее широкое распространение получили цветные индикаторы, окраска которых зависит от pH раствора.
Равновесие диссоциации индикатора характеризуется константой диссоциации K HInd

Чтобы его найти, подставим предельные значения отношения [ Ind ‑ ]/[ HInd ], равные 10 и 0,1, в уравнение ( 3 )
Основные операции объёмного анализа. Кривые и диаграммы
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Основные операции объёмного анализа
Реакция, положенная в основу титриметрического определения, должна удовлетворять следующим требованиям:
Титрование
Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют раствор реагирующего с ним вещества известной концентрации (титранта) до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования).
Следует различать экспериментально наблюдаемую конечную точку титрования и истинную точку эквивалентности, соответствующую стехиометрическим соотношениям реагирующих веществ. В идеальном случае обе точки совпадают, однако на практике между ними существует различие (погрешность титрования). Для большинства титриметрических определений допустима погрешность не более ±0,1%.
С точки зрения способа осуществления различают следующие виды титрований:
2. Кривые и диаграммы титрования
Ход реакции титрования может быть изображен графической моделью, называемой кривой титрования, отражающей зависимость между концентрацией компонентов и каким-либо свойством системы с титруемым веществом — титрантом. По мере добавления титранта в системе происходит изменение количественного соотношения исходных веществ и продуктов реакции и вследствие этого изменение свойства системы. В титриметрии строят логарифмические кривые в координатах «логарифм свойства – концентрация». По оси абсцисс откладывают либо объём, либо % добавленного титранта, либо степень оттитровывания; по оси ординат — свойство системы
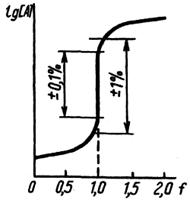
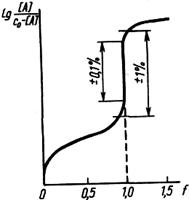
Практическое значение для анализа имеет область кривой титрования, называемая скачком титрования, в которой происходит резкое (скачкообразное) изменение свойства системы. Это связано с тем, что в области скачка происходит изменение концентрации реагирующих веществ на несколько порядков. Началом скачка титрования считают момент добавления 99,9% титранта (т. е. недотитровано 0,1% анализируемого вещества), концом скачка — добавление 100,1% (т. е. вещество перетитровано на 0,1%). При визуальном фиксировании точки конца реакции с помощью вводимых в систему индикаторов необходимо провести предварительный расчет области скачка титрования, чтобы правильно выбрать индикатор (интервал перехода окраски индикатора должен полностью или частично укладываться в пределы скачка титрования).
Величина скачка титрования определяется константой равновесия реакции, концентрациями реагирующих веществ (обычно скачок тем больше, чем больше концентрация), температурой, природой титруемого вещества и титранта (их константами диссоциации или устойчивости, значениями стандартных окислительно-восстановительных потенциалов, растворимостью), присутствием в системе посторонних веществ и т. п. Знание пределов скачка титрования может существенно помочь в выборе условий проведения реакции и концентрации титранта. Величина скачка титрования должна быть достаточно большой. Увеличить ее можно введением в систему веществ, реагирующих с компонентами, которые определяют свойства системы. Таким путем можно осуществить реакции, не протекающие в обычных условиях. Численное значение свойства в точке эквивалентности необходимо знать для того, чтобы оценить погрешность анализа. Положение точки эквивалентности по отношению к началу и концу скачка титрования зависит от стехиометрического соотношения реагирующих компонентов. Если в уравнении реакции между А и В стехиометрические коэффициенты равны, то точка эквивалентности будет находиться посередине скачка титрования, в противном случае, она будет смещена в ту или иную сторону.
В некоторых случаях более удобна линейная модель хода реакции титрования, называемая диаграммой титрования. Линейные модели получают в системе координат, в которой на оси ординат отложены равновесные концентрации. Если константы равновесия реакции достаточно велики, то на графике получаются две прямые, пересекающиеся в точке эквивалентности (рис. 3). Линейные диаграммы кислотно-основного титрования позволяют получать дополнительную информацию для разработки методики анализа. На рис.2 приведено сопоставление концентрационно-логарифмической диаграммы, построенной по способу с логарифмической кривой титрования 0,1 н. раствора муравьиной кислоты раствором NaOH. Следует иметь в виду, что реальные кривые и диаграммы титрования несколько отличаются от теоретически рассчитанных. Полный расчет процесса титрования с учетом всех параметров, меняющихся в ходе реакции, сложен и требует применения вычислительной техники.
3. Индикация
Теоретические кривые титрования служат для выбора индикатора, с помощью которого будет фиксироваться конец реакции. Очевидно, что чем ближе интервал перехода окраски индикатора к рН точки эквивалентности, тем точнее будет установлена эта точка. Однако важны и другие факторы, например четкость изменения окраски, устойчивость растворов индикаторов и др. В общем случае при выборе индикатора следует придерживаться следующих правил: 1) предпочтение следует отдавать индикатору, у которого значение рТ близко к значению рН в точке эквивалентности; 2) величина интервала перехода рН окраски индикатора должна полностью или большей своей частью входить в пределы скачка титрования; 3) при титровании слабых кислот нельзя применять индикаторы с интервалами перехода, лежащими в кислой области; 4) при титровании слабых оснований нельзя применять индикаторы с интервалами перехода, лежащими в щелочной области; 5) при титровании сильных кислот и оснований можно применять практически любые индикаторы, однако при титровании разбавленных электролитов с концентрацией меньше 0,01 н. следует выбирать индикатор, придерживаясь правила 2, так как скачок титрования становится малым.
При работе с индикаторами, интервал перехода окраски которых лежит в кислой области, следует помнить, что на результаты определения может оказать влияние угольная кислота, получающаяся при поглощении анализируемым раствором CO2 из воздуха. Поэтому при особо точных определениях рекомендуется раствор предварительно нагреть до кипения, чтобы удалить CO2.
В некоторых случаях конец реакции титрования может быть установлен непосредственно по какому-либо аналитическому эффекту, сопровождающему реакцию. Например, при перманганато-метрическом титровании бесцветных анализируемых растворов точку эквивалентности определяют по розовой окраске, появляющейся от добавления 1 капли избытка раствора KMnO4. Такое титрование называют безиндикаторным. Однако в большинстве случаев в химических методах анализа прибегают к введению в исходную систему титруемого вещества — титрант другой системы — индикаторной, реагирующей с исходной. Эта вторичная реакция, сопровождающаяся определенным аналитическим эффектом (изменением окраски, выпадением осадка), начинает протекать только тогда, когда основная прошла уже почти полностью. Значение, при котором наблюдается резкое изменение окраски индикатора, называют показателем индикатора или показателем титрования рТ.
Кислотно-основные индикаторы представляют собой слабые органические кислоты или основания, т.е. сопряженную пару, кислотная и основная форма которых различается по цвету. Индикаторы более слабые кислоты или основания, чем титруемые вещества, поэтому они вступают в реакцию с титрантом только после того, как основная масса анализируемого вещества уже прореагирует. Изменение окраски индикатора наступает при определенном значении рН раствора: