Что показывает орбитальное квантовое число
Квантовые числа электронов.
Квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квантовое число n характеризует общую энергию электрона и размер орбитали. Оно принимает целочисленные значения от 1: n = 1, 2, 3, 4, 5, 6, 7.
2. Орбитальное (побочное) квантовое число l характеризует форму атомной орбитали и принимает значения от 0 до n-1: 0, 1, 2, 3, …, n-1.
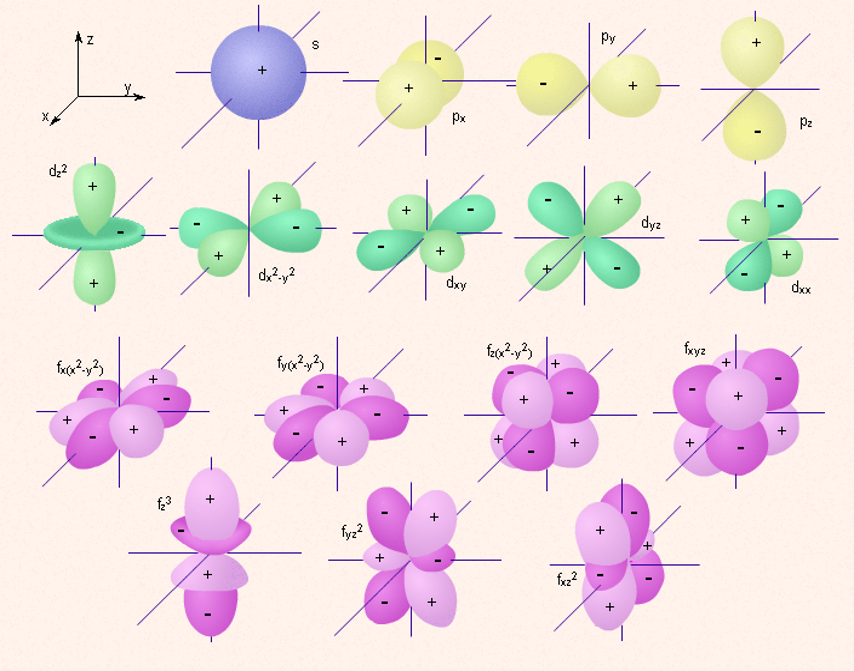
Электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна.
Если l=0 (s-орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве.
Если l=1 (p-орбиталь) то электронное облако имеет форму гантели.
d- и f-орбитали имеют более сложную форму.
3. Магнитное квантовое число m характеризует количество орбиталей одинаковой формы и их ориентацию относительно внешнего электрического или магнитного поля. Квантовое число m принимает целочисленные значения в интервале –l, … –1, 0, +1, … +l. Для каждого значения разрешено 2l+1 значений числа m. Например, если l=1, то m имеет 2×1+1, т.е. 3 значения: –1, 0, +1.
4. Спиновое квантовое число s характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 (↑) и –1/2 (↓).
Что показывает орбитальное квантовое число
В квантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции 
Главное квантовое числоn характеризует расстояние электрона от ядра – радиус орбиты.
Согласно (7.1.4) n определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы.
В атомной физике состояния электрона, соответствующие главному квантовому числу n, (n = 1, 2, 3, 4,…) принято обозначать буквами K, L, M, N,….
Два типа орбиталей s (она одна), p (их три), по которым «размазан» электронный заряд, показаны на рис. 7.4.
Орбитали часто называют подоболочками оболочек, поскольку они характеризуют формы разных орбит, на которых можно обнаружить электроны, находящиеся в одной оболочке (при заданном квантовом числе n).
Решая последовательно задачу об электроне в прямоугольной потенциальной яме, мы доказали, что энергия и положение электрона квантуются, т.е. принимают дискретные значения.
Решая уравнения Шредингера для атома, можно получить выражения для энергии, момента импульса и других динамических переменных электрона без привлечения каких-либо постулатов.
Рассмотрим (без вывода) движение электрона в потенциальном поле 
Обратимся вновь к стационарному уравнению Шредингера:
Так как электрическое поле – центрально-симметрично, то для решения этого уравнения воспользуемся сферической системой с координатами (r, θ, φ), которые связаны с декартовыми координатами, как это следует из рис. 7.5, соотношениями:



Подставим в (7.2.1) выражение оператора Лапласа в сферических координатах и получим уравнение Шредингера в следующем виде:
Уравнение (7.2.2) имеет решение при всех значениях полной энергии E > 0, что соответствует свободному электрону. При Е
Орбитальное квантовое число 0 1 2 3 4



K L M N O P Q
Квантовые числа
Главное квантовое число (n) определяет энергию и размеры электронных орбиталей, удаленность уровня от ядра. Принимает целые значения (n = 1, 2, 3. до ¥) и соответствует номеру периода. Число n показывает, сколько подуровней имеет каждый уровень, и какой энергетический уровень является внешним. Чем больше n, тем выше энергия. Оболочки (уровни) имеют буквенные обозначения
Пример. Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное (побочное или азимутальное (l))квантовое число определяет форму атомной орбитали и характеризует энергетические подуровни. Величина l принимает целочисленные значения от 0 до (n – 1) и может обозначаться буквами.
Подоболочка (подуровень) s р d f g
Каждому значению l соответствует орбиталь особой формы, например s-орбиталь имеет сферическую форму, р-орбиталь – гантель.
В одной и той же оболочке энергия подуровней возрастает в ряду Es
Магнитное квантовое число (ml) характеризует ориентацию орбиталей в пространстве относительно внешнего магнитного или электрического поля и их максимального количества для подуровней. В отсутствие внешнего магнитного поля все орбитали одного подуровня имеют одинаковое значение энергии. Величина ml принимает целочисленные значения от –l до +l, включая ноль, и меняется скачкообразно. Это означает, что для каждой формы орбитали существует (2l + 1), энергетически равноценных ориентации в пространстве.
Строение атома, главное квантовое число. Побочное (орбитальное) квантовое число. Магнитное квантовое число. Спиновое квантовое число
Страницы работы
Фрагмент текста работы
определяет пространственное расположение атомной орбитали и принимает целые значения от –l до + l через нуль, то есть 2l + 1 значений.
Изображение с помощью граничных поверхностей s-, p-, d- и f-орбиталей.
Заполнение атомных орбиталей
Принцип наименьшей энергии
Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам:
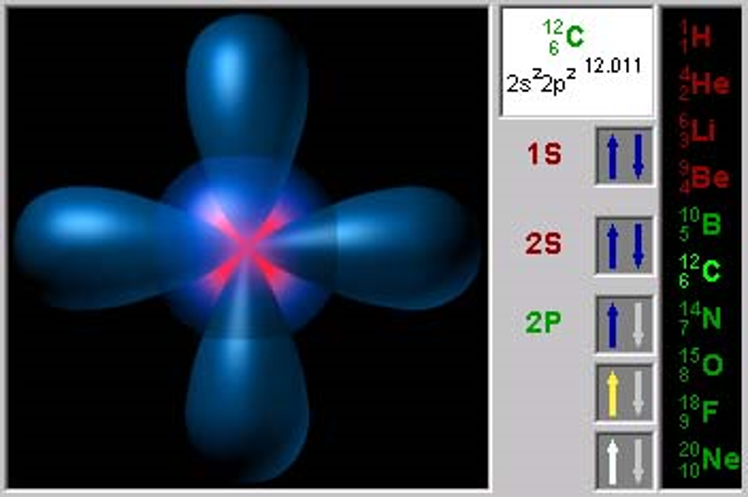
Электронные формулы 8О 1s22s22p4 16S 1s22s22p63s23p4
В=4 *S 1s22s22p63s23p33d1
В=6 *S 1s22s22p63s13p33d2
Орбитальное квантовое число
Орбитальное квантовое число — в квантовой физике квантовое число ℓ, определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения
Является собственным значением оператора орбитального момента электрона, отличающегося от момента количества движения электрона j лишь на оператор спина s:
Разность орбитального квантового числа и квантового числа полного момента не превосходит, по абсолютной величине, 
Полезное
Смотреть что такое «Орбитальное квантовое число» в других словарях:
орбитальное квантовое число — orbitinis kvantinis skaičius statusas T sritis fizika atitikmenys: angl. orbital quantum number vok. Bahnimpulsquantenzahl, f rus. орбитальное квантовое число, n pranc. nombre quantique azimutal, m; nombre quantique orbital, m … Fizikos terminų žodynas
Квантовое число — в квантовой механике численное значение какой либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует… … Википедия
Магнитное квантовое число — Магнитное квантовое число параметр, который вводится при решении уравнения Шрёдингера для электрона в водородоподобном атоме (и вообще для любого движения заряженной частицы). В 1896 году голландский физик Питер Зееман поместил в… … Википедия
АЗИМУТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО — (орбитальное квантовое число) см. в ст. Квантовые числа. АЗОТ (от греч. а приставка, здесь означающая отсутствие, и жизнь; лат. Nitrogenium), N, хим. элемент V группы периодич. системы элементов; ат. номер 7, ат. масса 14,0067. Природный А.… … Физическая энциклопедия
Главное квантовое число — Главное (радиальное) квантовое число целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Является первым в ряду квантовых чисел, который включает в себя главное … Википедия
ОРБИТАЛЬНОЕ КВАНТОВОЕЧИСЛО — (азимутальное квантовое число) квантовое число l, определяющеевеличину орбитального момента кол ва движения (момента импульса) L микрочастицыв сферически симметричном поле: где l = 0,1,2,3. Проекция Lz на произвольновыбранное направление (ось… … Физическая энциклопедия
СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ — взаимодействие между магн. моментами, связанными со спиновыми и орбитальными моментами кол ва движения электронов и ядер в квантовой системе атоме, молекуле, кристалле и т. п. С. о. в. обусловливает вклад в энергию системы, к рому отвечают три… … Химическая энциклопедия
АТОМА СТРОЕНИЕ — раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся… … Энциклопедия Кольера
Атомная орбиталь — У этого термина существуют и другие значения, см. Орбиталь. Атомная орбиталь одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома[1], задается главным n, орбитальным l и магнитным m квантовыми числами … Википедия