Что показывает побочное квантовое число
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p-, d-элементы
Содержание:
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон. Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
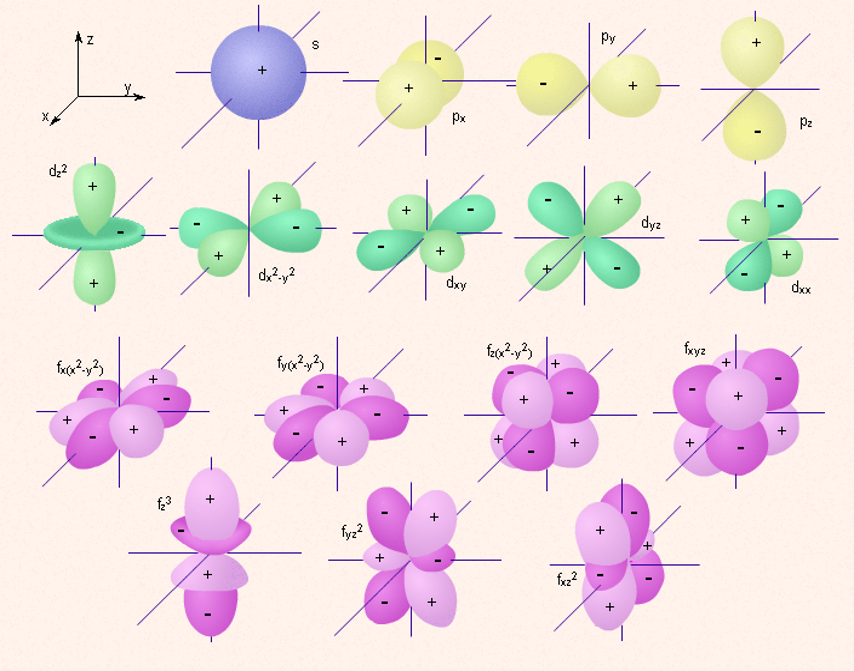
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
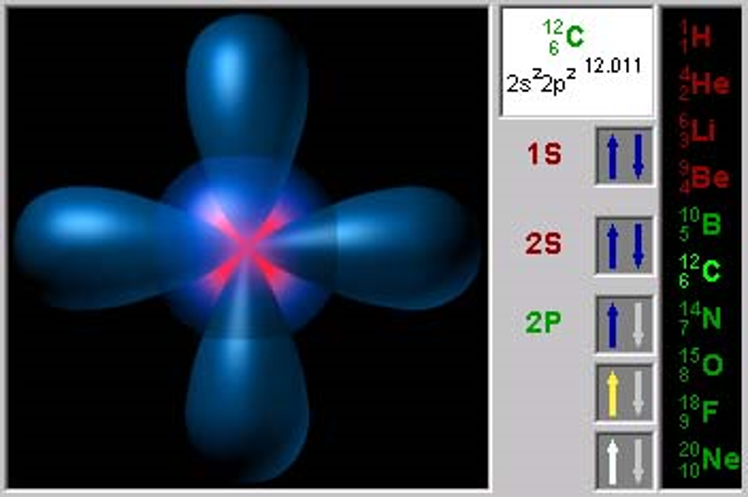
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
Строение атома, главное квантовое число. Побочное (орбитальное) квантовое число. Магнитное квантовое число. Спиновое квантовое число
Страницы работы
Фрагмент текста работы
определяет пространственное расположение атомной орбитали и принимает целые значения от –l до + l через нуль, то есть 2l + 1 значений.
Изображение с помощью граничных поверхностей s-, p-, d- и f-орбиталей.
Заполнение атомных орбиталей
Принцип наименьшей энергии
Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам:
Электронные формулы 8О 1s22s22p4 16S 1s22s22p63s23p4
В=4 *S 1s22s22p63s23p33d1
В=6 *S 1s22s22p63s13p33d2
Что показывает побочное квантовое число
Орбитальное квантовое число `l` показывает, сколько энергетических подуровней составляют данный уровень и характеризует форму орбиталей. Принимает значения от `0` до `(n-1)`.
При `n=3`, `l` принимает уже три значения: `0` `(s)`; `1` `(p)` и `2` `(d)`. Таким образом, на третьем уровне три подуровня. Орбитали `d`-подуровня имеют форму двух перекрещённых объёмных восьмёрок либо объёмной восьмерки с перемычкой (рис. 1).
При `n=4`, значений `l` уже четыре, следовательно, и подуровней на четвёртом уровне четыре. К перечисленным выше добавляется `3` `(f)`. Орбитали `f`-подуровня имеют более сложную, объёмную, форму.
Магнитное квантовое число `ml` определяет число орбиталей на каждом подуровне и характеризует их взаимное расположение.
Принимает значения `-l` до `+l`, включая `0`.
При `l=1`, `m_l` принимает три значения: `−1`; `0`; `+1`. Значит, орбиталей на данном подуровне (`p`-подуровне) три. Так как `p`-орбитали представляют из себя объёмные восьмёрки (то есть линейной структуры), располагаются они в пространстве по осям координат, перпендикулярно друг другу (`p_x`, `p_y`, `p_z`).
При `l=2`, `m_l` принимает уже пять значений: `−2`; `−1`; `0`; `+1`; `+2`. То есть на `d`-подуровне располагаются пять орбиталей. Это плоскостные структуры, в пространстве занимают пять положений.
Спиновое квантовое число `m_s` характеризует собственный момент количества движения электрона и принимает только два значения: `+1//2` и `-1//2`.
Всё вышесказанное можно обобщить в Таблице 2.
Таблица 2. Квантовые числа, атомные орбитали и число электронов на подуровнях (для `n
Квантовые числа электронов.
Квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квантовое число n характеризует общую энергию электрона и размер орбитали. Оно принимает целочисленные значения от 1: n = 1, 2, 3, 4, 5, 6, 7.
2. Орбитальное (побочное) квантовое число l характеризует форму атомной орбитали и принимает значения от 0 до n-1: 0, 1, 2, 3, …, n-1.
Электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна.
Если l=0 (s-орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве.
Если l=1 (p-орбиталь) то электронное облако имеет форму гантели.
d- и f-орбитали имеют более сложную форму.
3. Магнитное квантовое число m характеризует количество орбиталей одинаковой формы и их ориентацию относительно внешнего электрического или магнитного поля. Квантовое число m принимает целочисленные значения в интервале –l, … –1, 0, +1, … +l. Для каждого значения разрешено 2l+1 значений числа m. Например, если l=1, то m имеет 2×1+1, т.е. 3 значения: –1, 0, +1.
4. Спиновое квантовое число s характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 (↑) и –1/2 (↓).
Квантовые числа (электронные оболочки)
Квантовые числа это числовое значение квантовой переменной определенного объекта (пример: электронная частица, ядра, атомы), которое характеризует его.
Квантовое число (полностью) характеризует состояние этой частицы.
Согласно современным взглядам стационарные состояния атома или термы характеризуются четырьмя квантовыми числами:
Что такое квантовые числа
При развитии теории Бора оказалось, что для полной характеристики стационарных состояний атома должно учитываться наличие у электронов не только круговых, но и эллиптических орбит (Зоммерфельд), а также и некоторые другие условия, которые увеличивают количество дозволенных энергетических уровней.
Главное квантовое число п определяет дозволенные энергетические уровни атома или в соответствии с моделью Резерфорда—Бора порядковые номера орбит и их радиусы (для эллиптических орбит — большую полуось).
Главное квантовое число может принимать значение любого числа натурального ряда:
Орбитальное или побочное квантовое число l определяет дозволенные значения момента количества движения lэ электрона по орбите.
В модели Бора—Зоммерфельда — дозволенные соотношения малой b и большой а полуосей эллиптических орбит (рис. , а):
где п — главное квантовое число.
Орбитальное квантовое число
Для основной орбиты атома водорода (квантовые числа атома водорода) п = 1 и l = (п — 1) = 0; b/a = 1/n = 1; эта орбита — круговая.
Если п > 1, то орбита имеет форму круга при l = (п — 1). Для примера на рис. , б показана группа орбит с главным квантовым числом n = 3 при трех значениях орбитального квантового числа:
Магнитное квантовое число
Магнитное квантовое число т1 определяет пространственную ориентировку электронных орбит, которая должна удовлетворять дозволенный значениям проекции орбитального момента, на некоторое направление.
В качестве такого направления рассматривается направление внешнего (действующего на атом) магнитного поля.
Движущийся вокруг ядра электрон образует элементарный круговой ток, имеющий собственное магнитное поле.
В результате взаимодействия внешнего магнитного поля с этим полем плоскость орбиты электрона ориентируется в пространстве определенным образом.
Дозволенными являются те положения орбиты, при которых численное значение l‘ э проекции вектора l Э момента количества движения электрона на направление магнитного поля (рис, справа) кратно величине h/2π : l ‘ э = ml (h/2 π), где ml — магнитное квантовое число.
Пример магнитного квантового числа
Для примера на рис. (справа) показано расположение орбиты электрона с некоторыми заданными главным и орбитальным квантовыми числами п и l и различным магнитным квантовым числом, которое изменяется в пределах тl = +1; тl = + 2 и тl — +3 (при отрицательных значениях этих чисел плоскости орбит поворачиваются на 180°).
Таким образом, при данных главном п и орбитальном l квантовых числах электрон в атоме, находящемся под действием магнитного поля, может двигаться по орбитам, имеющим в пространстве (2l + 1) различных положений. Этим положениям соответствуют свои энергетические уровни и, следовательно, линии в спектре (расщепление спектральных линий в магнитном поле называется явлением Зеемана).
Спиновое квантовое число

Тело, вращающееся вокруг своей оси (как, например, волчок), имеет собственный момент количества движения или момент вращения, с которым связаны особые механические свойства тела.
Такие же свойства имеет электрон (и другие элементарные частицы), хотя понятие о вращении вокруг своей оси к ним не применимо, вследствие отсутствия у них определенной внутренней структуры.
Поэтому электрону так же приписывается собственный момент количества движения, который называется спином.
Отсюда следует, что спиновое квантовое число электрона имеет только два значения:
Эти значения обусловливают две дозволенные ориентировки проекции S’ вектора спина S электрона на направление орбитального момента l: параллельную ms= +1/2 (рис. 2, а) и антипараллельную ms = — 1/2 (рис. 2, б).
Квантовые числа сохраняют свое значение и в атомах с большим числом электронов, хотя общая система обозначения состояний (термов) атома при этом усложняется.
Электронные оболочки
Группировка энергетических уровней атома (или орбит электронов по Боровской модели) происходит в соответствии со значением главного и побочного квантовых чисел.
Электроны с одинаковым главным числом п образуют электронные оболочки, которые принято обозначать следующими буквами:
n=1 2 34567.
К L М N О Р Q
Электроны, принадлежащие к определенной оболочке, образуют несколько подоболочек в соответствии с их орбитальным квантовым числом l. Значение этого числа и соответствующих ему подоболочек часто обозначают следующими буквами (буквы заимствованы из названий спектральных линий):
l = 0 1 2 3 4 5
s р d f g h
Поскольку орбитальное квантовое число принимает значения от 0 до (п — 1), число подоболочек равняется порядковому номеру п оболочки. Оболочка К состоит из одной подоболочки s: Оболочка L состоит из двух подоболочек s и р, оболочка М — из трех: s, р,d, и т. д.
Количество электронов в подоболочке обусловливается магнитным и спиновым квантовыми числами.
При этом выполняется принцип Паули: в атоме не может быть двух электронов, находящихся в тождественных состояниях движения, другими словами, не может быть больше одного электрона с четырьмя одинаковыми квантовыми числами.
Поскольку при заданном орбитальном числе l магнитное число тl может иметь (2l + 1) значений и при каждом из них спиновое число ms может иметь два значения, отличающихся знаком, общее количество возможных состояний при этом будет 2•(2l + 1).
Следовательно, подоболочка s (l = 0) может содержать только два электрона, различающиеся знаком спина; подоболочка р (l = 1) — шесть электронов, различающихся тремя магнитными числами и при каждом из них двумя спиновыми; подоболочка d (l = 2) — десять, и т. д.
Число электронов в подоболочке указывается как показатель степени у буквы, ее обозначающей.
Электронная оболочка пример

У гелия на этой же оболочке находится два электрона, отличающиеся спиновыми числами:
1s 2
(рис. 3, а, на котором слева показано схематическое, а справа — условное изображение оболочек).
У элементов второго периода таблицы Менделеева появляется вторая оболочка L. Она может состоять из двух подоболочек s и р.
Сначала запол няется подоболочка 2s (эллиптическая орбита): у лития одним электроном 1s 2 2s, у бериллия — двумя (с разными спиновыми числами) ls 2 2s 2 (рис. 3, б).
Затем заполняется подоболочка 2р (круговые орбиты) электронами с разными значениями магнитного квантового числа: у бора и углерода с ml = 0, у азота и кислорода с ml = + 1, у фтора и неона с тl = —1 (см. таблицу).
Таким образом, у неона подоболочка 2р заполнена шестью электронами:
ls 2 2s 2 2p 6
У натрия появляется третья оболочка М с одним электроном 1s 2 2s 2 2p 6 3s (рис. 3, г), и т. д.
Последовательность заполнения электронных оболочек сохраняется только у атомов первых 18 элементов.
Затем этот порядок усложняется: в одних случаях новый слой может начинать заполняться раньше, чем окончится заполнение предыдущего, в других случаях, наоборот, происходит заполнение оставшихся мест в предыдущей оболочке при неизменном числе электронов в наружном слое.
Количество электронов в наружной оболочке во всех случаях изменяется только от 1 до 8.
Наибольшее возможное число N электронов в оболочке соответствует условию:
N = 2п 2 ,
где п — главное квантовое число (для оболочки К —2, для L — 8, М — 18).
Это условие выполняется только для первых че тырех оболочек (К — N), для остальных — полное число электронов не достигает максимально возможного.
Сопоставление модели строения электронной оболочки атомов отдельных элементов с расположением их в периодической системе Д. И. Менделеева показывает, что периодичность повторения свойств элементов связана со сходством строения их электронных оболочек.
Число электронных оболочек соответствует номеру периода таблицы, к которому данный элемент принадлежит. В каждом периоде физико-химические свойства элементов связаны с числом электронов во внешнем слое, поэтому при образовании каждого нового слоя они повторяются.
Таким образом установленная Менделеевым периодичность свойств элементов получила новое обоснование в строении электронных оболочек атомов.
Спектр электромагнитного излучения
В связи с тем что радиусы электронных оболочек у атомов различных элементов обратно пропорциональны их порядковому номеру, у элементов с высоким номером орбиты электронов расположены значительно ближе к ядру.
Поэтому разность энергий между соседними уровнями, на которых находятся внутренние электроны, значительно выше, чем для внешних электронов, и для перевода их с одной орбиты на другую, особенно у атомов с высоким порядковым номером, требуется энергия, измеряемая сотнями и тысячами электрон-вольт.
Излучение, которое получается при этом, имеет значительно более высокую частоту и относится уже к дальнему ультрафиолетовому и рентгеновскому.
Имеется еще один механизм электромагнитного излучения — это торможение быстро движущихся электронов электрическим полем атома, внутри которого они пролетают. Фотоны излучения при этом имеют высокую энергию и относятся преимущественно к рентгеновскому излучению.
Еще большую энергию фотонов, чем рентгеновское излучение, и, следовательно, меньшую длину волны имеет гамма-излучение радиоактивных веществ, источником которого является атомное ядро.
Виды оптического излучения
В таблице приведены некоторые данные (частота, длина волны, энергия фотонов), характеризующие различные виды оптического излучения, рентгеновского и гамма-излучения.
| Элемент | Квантовые числа | Обозначение | |||
| п | l | тl | тs | ||
| Н | К (l = 0) | 0 | + 1/2 | 1s | |
| Не | -1/2 | 1s 2 | |||
| Li | L (l = 0) | 0 | + 1/2 | 1s 2 2s | |
| Be | -1/2 | 1s 2 2s 2 | |||
| В | р (l = 1) | 0 | + 1/2 | ls 2 2s 2 2p | |
| С | -1/2 | 1s 2 2s 2 2p 2 | |||
| N | +1 | + 1/2 | 1s 2 2s 2 2p 3 | ||
| О | -1/2 | 1s 2 2s 2 2p 4 | |||
| F | —1 | + 1/2 | 1s 2 2s 2 2p 5 | ||
| Ne | -1/2 | ls 2 2s 2 2p 6 | |||
| Вид излучения | Длина волны | Частота в гц | Энергия фотона в ЭВ | |||
| от | до | от | до | от | до | |
| Инфракрасное | 400 мк | 0,76 мк | 7,5•10 11 | 3,94• 10 14 | 0,0031 | 1,65 |
| Видимое | 760 ммк | 380 ммк | 3,94• 10 14 | 7,9• 10 14 | 1,65 | 3,3 |
| Ультрафиолетовое | 380 ммк | 10 ммк | 7,9• 10 14 | 3,0• 10 16 | 3,3 | 124 |
| Рентгеновское | 10 ммк | 0,001 ммк | 3,0•10 16 | 3,0•10 20 | 124 | 1,2•10 6 |
| Гамма | 0,1 ммк | не определен | 3,0•10 18 | 1,2•10 4 | ||
На рис. 3 приведен общий спектр электромагнитных волн, расположенных в порядке убывания длины волны. Разделение спектра на отдельные участки имеет условный характер, поэтому во многих случаях отдельные виды излучения перекрывают границы участков.
Статья на тему Квантовые числа
Похожие страницы:
Понравилась статья поделись ей