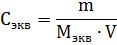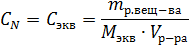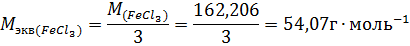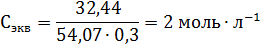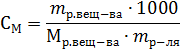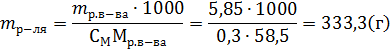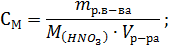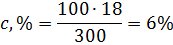Что показывает процентная молярная концентрация
Способы выражения концентрации растворов



Для количественной характеристики растворов используют понятие концентрации:
Концентрация – величина, выражающая относительное содержание данного компонента в системе (смеси, растворе).
Из концентраций растворов наибольшее применение в химии находят следующие:
Процентная концентрация растворов показывает число единиц массы растворенного вещества, содержащееся в 100 единицах массы раствора, и для его приготовления следует взять 12 единиц массы СаСl2 и 88 единиц массы растворителя.
Молярная концентрация раствора (молярность) – отношение количества этого вещества, содержащегося в растворе (в молях), к объему раствора:
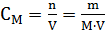
Молярным называется раствор, в 1л которого содержится 1 моль растворенного вещества.
Эквивалентная (нормальная) концентрация раствора (нормальность) – отношение числа эквивалентов вещества, содержащегося в растворе, к объему раствора:
где m – масса растворенного вещества; Мэкв – молярная масса эквивалента растворенного вещества.
Основная особенность моляльного способа выражения концентрации заключается в том, что моляльная концентрация раствора не зависит от температуры, поскольку для определения моляльности не привлекается объем.
Массовой долей растворенного вещества называют отношение массы растворенного вещества к общей массе раствора. Массовую долю обычно выражают в долях единицы и обозначают W.
Мольная доля – отношение числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор.
Для приготовления растворов заданных концентраций должны проводиться соответствующие расчеты.
Пример 1. Какой массы кристаллогидрат ВаCl2?2H2O надо взять для приготовления раствора объемом 0,5л, в котором массовая доля ВаСl2 составляет 0,1 (10%-ный раствор)?
Пример 3. Определите эквивалентную концентрацию хлорида железа (3), если в 0,3л раствора содержится 32,44г PeCl3.
Решение. Эквивалентная концентрация (нормальность раствора) рассчитывается по формуле:
Молярная масса эквивалента PeCl3 равна:
Решение. Моляльность раствора рассчитывается по формуле:
где mр-ля – масса растворителя в г. Отсюда:
Пример 5. Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие.
Решение. Определим молярную массу и молярную массу эквивалента СиSO4.
В 100 г раствора с ω(СиSO4)=0,1 содержится 10,0г СиSO4 и 90 г H2O. Следовательно, СМ раствора СиSO4 равна:
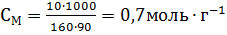
Пример 6. Расчеты, связанные с приготовлением разбавленных растворов из концентрированных.
Решение. Сначала определяем массу азотной кислоты в 20л 0,5 М раствора:
Так как 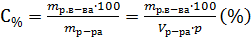
Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см 3 воды модно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно:
б) молярная (мольно-объемная)% концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения
Молярную концентрацию раствора получим делением числа граммов Н3РО4 в 1 л раствора на молярную массу Н3РО4 (97,99 г/моль):
в) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса Н3РО4 = М/ 3 = 97,99/3 = 32,66 г/моль, то
г) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3РО4 в 1000 г растворителя находим из
соотношения 282 – 18
Отсюда см = 63,83/97,99 = 0,65 м.
Титром раствора называют число граммов растворенного вещества в 1 см 3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т=61,86/1000 = 0,06186 г/см 3
Зная молярную концентрацию эквивалента и молярную массу эквивалента (тэ) растворенного вещества, титр легко найти по формуле
Пример 8. На нейтрализацию 50 см 3 раствора кислоты израсходовано 25 см 3 ‘ 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
Пример 9. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см 3 ) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см 3 ). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Пример 10. Какой объем 96%-ной серной кислоты плотностью 1,84 г/см 3 потребуется для приготовления 3 л 0,4 н. раствора?
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848 : 1,766 = 33,32 см 3 этой кислоты.
Способы выражения концентрации
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = 41,2/76 = 0,54 моль
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mH2O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Концентрация растворов
Способы выражения концентрации растворов
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) V),
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«. Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (12 1,08 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (12 1,08 10) / 49 = 2,64 H.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N Э) / m
Пример
Нормальная концентрация 1 М раствора серной кислоты N = (1 98) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,5 53) / 106 = 0,25 M. Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Концентрирование раствора
Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы приготовить раствор с массовой долей растворенного вещества w2?
Решая полученное уравнение относительно х получаем:
w2 m + w 2 x = w 1 m + x
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1 / m2 = (w3— w2 ) / (w1— w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
Пример
Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% \ | 5% / | m1 | |
| 10% | |||
| / 5% | \ 30% | m2=210-m1 |
Разбавление раствора
Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1 V 1 ) откуда V 1 = m 1 /( w 1 r 1 )
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2 r 2 V 2 ) / (w 1 r 1 )
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2 / w1
50 / x = 3 / 30
3x = 50
x = 500 г
Последнюю задачу можно также решить, используя «правило креста»:
| 30% \ | 3% / | 50 | |
| 3% | |||
| / 0% | \ 27% | X |
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г