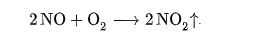Что получается при горении водорода
Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.

Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).

Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).

С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
Процентное содержание газов в горючей смеси

Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 oC для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 oC (для других концентраций она может достигать 2500 oC), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 oC). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 oC).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м3 этого газа весит всего 90 грамм. Если сжечь этот 1 м3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Экологические проблемы сжигания водорода
Все мы знаем формулу Н2О. Некоторые еще знают, что при сжигании водорода выделяется энергия (около 140 МДж/кг). Особо упоротые еще знают, что водород производят на водородных станциях, а кислород на кислородных станциях.
Еще кто-то слышал, что это самое экологичное топливо, так как выхлоп целиком состоит из водяного пара Н2О.
На этом «знания» заканчиваются.
Про то, что водяной пар — это главный парниковый газ я писал тут:
https://smart-lab.ru/blog/659641.php
Теперь перейдем непосредственно к самому процессу сжигания.
Приблизительно процесс описывается формулой 2H2 + O2 = 2H2O + E
Проблема в том, что при сжигании водорода используют не чистый водород, а атмосферный воздух.
атмосферный воздух состоит из азота на 78%, кислорода на 21 % — кислород. 1% приходится на другие газы, включая ныне нелюбимый всеми СО2.
Так что же происходит?
Всё дело в том, что при температуре горения более 600 оС, а особенно после 1500оС начинается реакция азота и кислорода: 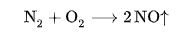
тепловой эффект реакции −180,9 кДж
NO не имеет запаха, но при вдыхании может связываться с гемоглобином, подобно угарному газу переводя его в форму, не способную переносить кислород.
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
Оксид азота (IV) NO2 (диоксид азота; двуокись азота) в высоких концентрациях раздражает лёгкие и может привести к серьёзным последствиям для здоровья. NO2 соединяется с водой, хорошо растворяется в жире и может проникать в капилляры лёгких, где он вызывает воспаление и астматические процессы. Концентрация NO2 свыше 200 ppm считается летальной, но уже при концентрации свыше 60 ppm могут возникать неприятные ощущения и жжение в лёгких. Долговременное воздействие более низких концентраций может вызывать головную боль, проблемы с пищеварением, кашель и лёгочные заболевания.
В клинике острого отравления оксидами азота различают четыре периода: латентный, нарастания отёка лёгких, стабилизации и обратного развития[3]. В скрытом периоде мнимого благополучия, который может продолжаться 4—12 часов, больного может беспокоить конъюнктивит, ринит и фарингит за счёт раздражения слизистых оболочек, проявляющиеся кашлем, слезотечением, общим недомоганием, однако его общее состояние в целом удовлетворительное. Затем состояние больного ухудшается: по мере развития отёка лёгких появляется влажный кашель со слизистой или кровянистой мокрота, одышка, цианоз, тахикардия, субфебрильное или фебрильное повышение температуры. Возникает чувство страха, психомоторное возбуждение и судороги. В отсутствие квалифицированной медицинской помощи это может привести к летальному исходу.
Токсичность! Оксид азота (II) — ядовитый газ с удушающим действием.
Ответствен за смог!
Смог — это чрезмерное загрязнение воздуха вредными веществами, выделенными в результате работы промышленных производств, транспортом и теплопроизводящими установками при определённых погодных условиях. Выбросы NOx считаются одной из основных причин образования фотохимического смога:
ru.wikipedia.org/wiki/%D0%A1%D0%BC%D0%BE%D0%B3
Но это мелочи!
Соединяясь с парами воды в атмосфере, NOx образуют азотную кислоту, и, вместе с оксидами серы, являются причиной образования кислотных дождей.
Лес после кислотного дождя:
Именно по оксидам азота сильно ударили экологические нормы ЕВРО, начиная с ЕВРО-3: 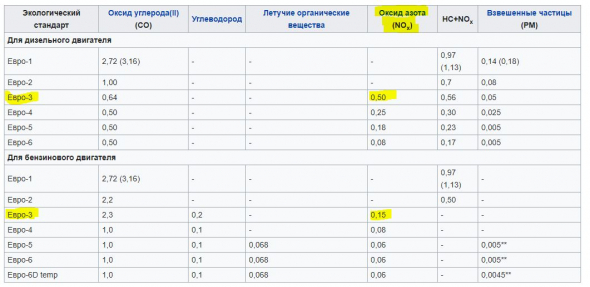
ru.wikipedia.org/wiki/%D0%95%D0%B2%D1%80%D0%BE-6
И так, а что же при сжигании водорода?
Температура более 1500 градусов, что приводит к недопустимо высоким выбросам NOx.
при горении водорода в воздухе достигается температура около 2000°С.
(Кстати, эти любимые всеми клапана EGR в автомобилях как раз и призваны снижать образование оксидов азота)
Особо забавно читать выводы по эксплуатации экспериментальных энергических установок на водороде:
Газовая турбина на водороде
Ключевая технология, необходимая для масштабного использования водорода в газовой электроэнергетике, – водородная турбина. По оценке компании Mitsubishi Hitachi Power Systems (MHPS), на существующих газотурбинных установках можно увеличить долю водорода до 20% в смеси его с природным газом без существенных изменений в конструкции. MHPS успешно испытала в Японии сверхмощную газовую турбину серии J в работе на топливной смеси из природного газа (70%) и водорода (30%). Испытания были проведены на заводе в Такасаго на парогазовой установке мощностью 700 МВт (КПД – 63% с температурой газов после камеры сгорания ГТУ – 1600°C). Для сжигания топлива использовались горелки с вихревым перемешиванием. Благодаря водороду выбросы CO2 сократились на 10%, а выбросы оксидов азота, по мнению компании, «остались на удовлетворительном уровне».
Т.е. если мы меняем смесь природного газа и водорода на (60%) и (40%), то очевидно что выбросы оксидов азота, даже по мнению компании оказываются уже на каком-то совершенно неприличном уровне!
Кстати, ранее именно из-за оксидов азота был похоронен проект автомобиля на газотурбинном двигателе:
Энергия сгорания водорода в кислороде

Водород – рождающий воду. Вода получается при горении водорода – при соединении водорода с кислородом. В ходе реакции выделяется очень большое количество энергии.
Значит, водород – топливо. И как со всяким топливом с водородом нужно обращаться осторожно. Получаем водород реакцией цинка с соляной кислотой.
Оборудование: штатив, пробирка, пробирка с газоотводной трубкой, пинцет, лучина.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Расчет необходимых энергозатрат на электролиз воды можно вести многими способами. Ограничимся тремя принципиально различными. Во-первых, памятуя о существовании закона сохранения энергии, можно рассчитать энергозатраты на электролиз через данные о теплотворной способности водорода как топлива. Используются результаты, полученные методом калориметрии — сколько энергии выделяется при горении водорода, столько же ее должно быть поглощено при его получении путем электролиза. Во-вторых, расчет энергозатрат можно вести по данным резонансной спектроскопии, поскольку при электролизе разрываются одни связи (с разрушением молекул воды) и замыкаются другие (с образованием молекул газов), а в настоящее время энергии каждого вида связи известны. В-третьих, можно произвести расчет, используя законы электролиза Фарадея и некоторые физические константы. Каждый метод имеет свои плюсы и минусы, а также погрешности.
Первый способ (по теплотворной способности водорода)
Продуктами сгорания любого углеводородного топлива являются углекислый газ и вода. В термодинамике и теплотехнике различают низшую и высшую удельную (т.е. отнесенную к единице количества) теплотворную способность топлив. Низшая теплотворная способность включает в себя тепло, полученное при горения топлива и охлаждения продуктов реакции до температуры топлива без учета теплоты конденсации паров воды. Высшая теплотворная способность включает в себя помимо низшей еще и теплоту конденсации паров воды в жидкую фазу и охлаждения ее до температуры топлива. Температура топлива принимается равной 15°C. Критерий низшей теплотворной способности используется в теплотехнике, поскольку продукты горения топлив как правило удаляются из теплообменников с заведомо высокой температурой и теплота конденсации паров воды для потребителей недоступна. В нашем же случае необходимо воспользоваться критерием высшей теплотворной способности водорода. Логика очевидна – для электролиза мы берем в составе электролита жидкую воду, следовательно после всего круговорота поглощения и выделения энергии мы к ней же должны и вернуться.
Высшая теплотворная способность водорода составляет 33850 ккал/кг = 33850 ккал/кг * 4,2 Дж/кал = 142,2 Мдж/кг (источник). Один килограмм водорода при н.у. (нормальные условия — давление 101325 Па, температура 273,15К) при плотности 0,0899 г/л (источник) имеет объем 11124 литра. Гремучий газ по объему на 2/3 состоит из водорода и на 1/3 из кислорода. Поскольку горючим компонентом является только водород, то при сгорании гремучего газа выделяется энергия = 2/3 * 142,2 Мдж/кг : 11124 л/кг = 8522 Дж / л = 8522 Вт*сек / л = 8522 Вт * (час / 3600) / л = 2,37 Вт*час / л.
Второй способ (по энергиям связей в молекулах).
Энергия связи в молекуле водорода составляет 432 кДж/моль (источник), в молекуле кислорода — 493 кДж/моль (источник). В молекуле воды есть две равноценных связи O-H. При последовательном их разрыве энергия первой разрываемой из них составит 495 кДж/моль, второй – 435 кДж/моль. В расчетах берут среднее значение 465 кДж/моль (источник).
При электролизе 2 моль воды превращаются в 2 моль водорода и 1 моль кислорода — суммарное уравнение реакции:
В двух молекулах воды разрываются 4 связи О-Н, в образовавшихся продуктах замыкаются две связи Н-Н и одна О-О. Уравнение энергобаланса должно выглядеть следующим образом:
Энергия электролиза – Энергия разрыва связей + Энергия образования связей = 0
Энергия электролиза — 2*465 кДж/моль * 2 моль + (432 кДж/моль * 2 моль + 493 кДж/моль * 1 моль) = 0
Энергия электролиза = 503 кДж.
Эта энергия идет на образование гремучего газа (2 моль водорода и 1 моль кислорода). Один моль любого газа при нормальных условиях занимает обьем 22,4 л (источник). Таким образом, суммарный объем гремучего газа, полученного из двух молей воды, составит 2 моль * 22,4 л/моль + 1 моль * 22,4 л/моль = 67,2 л.
Энергия получения гремучего газа = 503 кДж/67,2 л = 7,485 кДж/л = 7,485 * 1000 * Вт * сек / л = 7485 * Вт * (час/3600) / л = 2,08 Вт*час/л.
Третий способ (из законов электролиза).
По закону электролиза Фарадея для получения одного грамм-эквивалента любого вещества в электрохимической ячейке необходимо перенести 96485 Кл заряда (источник).
Электрохимический процесс – это всегда совокупность двух (групп) реакций – окисления и восстановления. Заряд при этом переносится от одной химической сущности, находящейся на аноде, к другой, пребывающей на катоде. Таким образом, правильнее будет сказать, что при переносе 96485 Кл заряда получается один грамм-эквивалент вещества на аноде и один грамм-эквивалент вещества на катоде. В случае электролиза воды – это совокупность водорода и кислорода, т.е. гремучий газ.
Масса одного грамм-эквивалента водорода – 1 грамм (1/2 моль), что соответствует объему 11,2 литра (н.у.). Масса одного грамм-эквивалента кислорода – 8 граммов (1/4 моль), что соответствует объему 5,6 литра (н.у.). Следовательно, при прохождении 96485 Кл заряда выделяется 11,2 л + 5,6 л = 16,8 литров гремучего газа, а значит для его получения удельные затраты электричества (заряда) составят 96485 Кл : 16,8 л = 5743 Кл / л.
Теперь необходимо вспомнить, что заряд в электрохимической ячейке переносится сторонними силами (ЭДС источника для электролиза) против градиента электрохимического потенциала. Говоря проще, для переноса заряда в данном случае нужно приложить некоторое электрическое напряжение, минимально необходимая величина которого равна сумме равновесных потенциалов реакций на противоположных электродах. В случае воды минимальная ЭДС составляет 1,23 В (Якименко Л.М. Электролиз воды, стр.38) и не зависит от рН среды используемого электролита.
Энергозатраты на получение гремучего газа:
1,23 В * 5743 Кл / л = 7064 В*А*сек / л = 7064 Вт*(час / 3600) / л = 1,96 Вт*час/л.
Метод расчета Энергозатраты, Вт*час/л
1. По теплотворной способности водорода 2.37
2. По энергиям связей в молекулах 2.08
3. Из законов электролиза 1.96
В качестве эталона энергозатрат мы предпочитаем минимальную теоретически необходимую для электролиза энергию 1,96 Вт*час/л. Оценка КПД в данном случае – самая худшая из всех возможных, но в случае с проверкой КПД наших установок мы идем на это намеренно.
Попутно с освещением вопроса энергозатрат при электролизе воды необходимо вспомнить о таких понятиях как выход реакции по току и энергетическая эффективность процесса (КПД).
Выход реакции по току.
Выход электрохимической реакции по току представляет собой отношение количества электричества (в кулонах, ампер-часах или любых других внесистемных единицах), потраченного на получение некоторого количества вещества, к теоретически необходимому для этого получения количеству электричества.
Выход по току не может превышать 100%. Причиной снижения этого показателя (в отсутствие прямых утечек тока при коротком замыкании через электролит) может быть прохождение на электроде других электрохимических реакций, не дающих данного целевого продукта. При электролизе воды в электролите всегда есть некоторое количество растворенных кислорода и водорода в молекулярной форме, т.е. в форме незаряженных молекул, не образующих отдельной фазы. Отсутствие заряда и процессы диффузии приводят к тому, что часть выделившегося при электролизе кислорода может восстанавливаться на катоде, а часть полученного водорода – окисляться на аноде. При отсутствии в ячейке разделительной диафрагмы и сравнительно небольшой толщине слоя электролита затраты тока на эти конкурирующие реакции могут составлять от 3 до 5%. Таким образом, токовый выход бездиафрагменных электролизеров не может превышать 95-97%. Все конструкции электролизеров для получения гидроксигаза на борту авто именно бездиафрагменные и с тонким слоем электролита в ячейках. Кроме того подавляющее большинство из них — проточные, а значит имеющие утечки тока еще и по конструктивным причинам — вследствие шунтирования по электролиту. Вследствие этого токовые выходы должны быть еще ниже, особенно на малых токах (подробнее).
Миф I. Одноатомный водород.
Многие производители систем для получения гидроксигаза на борту авто уверяют потенциальных покупателей в том, что в их системах получается именно химически активный одноатомный газ (ННО), состоящий в основном из атомов водорода и кислорода, а не молекул. При этом приводятся такие данные о соответствии скорости выработке газа и потребляемого системой тока, которые соответствуют почти 200%- ному токовому выходу. Если поверить в одноатомность этого газа, которая неявно предполагает удваивание объема по сравнению с обычным двухатомным, то данные о производительности по току выглядят как будто бы убедительно. Попробуем разобраться.
При повышении температуры все большая доля молекул распадается на атомы. Порядок энергии связи в молекулах таков, что даже при температуре в 2000°C степень диссоциации (распада) молекул на атомы составляет для водорода и кислорода 0,081% и 0,03% соответственно, полная диссоциация наблюдается при температуре на короне Солнца – выше 6000°C (источник (водород), источник (кислород)). Таким образом говорить об одноатомном гидроксигазе при температуре заведомо более низкой невежественно до неприличия. Учитывая это, нужно с необходимостью признать, что если предлагаемые системы и тестировались производителями, то приведенные значения результатам этих тестов не соответствуют и явно завышены.
Миф II. Сверхэффективный электролиз.
Существуют прецеденты, когда производители публикуют данные о производительности своих систем, не ссылаясь на одноатомность получаемого газа, но анализ этих данных также приводит к выводу о токовой сверхэффективности. В качестве объяснения этого феномена, если об этом и возникает разговор, предлагается невыполнение законов электролиза Фарадея, в частности в системах, разработанных для так называемого резонансного электролиза в объеме электролита или даже просто чистой воды. Несмотря на обилие в Интернете материалов, посвященных данным технологиям, в том числе и патентов на изобретения, нигде не описана достаточно внятная и научно обоснованная теория вопроса и не проведено результатов сколько-нибудь серьезной экспериментальной экспертизы. Таким образом, приведенные данные о производительности систем также кажутся подозрительными.
Производительность системы по гидроксигазу.
Какова же должна быть зависимость между величиной тока, подаваемого в электролизер, и его производительностью по гремучему газу в идеале?
Вспомним из предыдущего изложения, что для получения при нормальных условиях одного литра газа в одной электрохимической ячейке через нее необходимо пропустить 5743 Кл электричества. Какая сила тока должна быть подана на ячейку, чтобы это количество заряда прошло через нее за одну минуту?
5743 Кл = 5743 А*сек = 5743 А*(мин/60) = 95,72 А*мин.
Т.е. для производительности одной ячейки по газу в один литр в минуту необходима сила тока 95,72 А. Это достаточно большая величина. Уменьшить ее можно, набирая ячейки в секцию с последовательным электрическим подключением. Тогда во сколько раз увеличено количество ячеек, во столько же раз можно уменьшить ток для получения того же объема газа в минуту.
При последовательном соединении проводников суммарное падение напряжения в цепи равно сумме падений на элементах. В реальных условиях падение напряжения на одной ячейке составляет нескольким более 2 вольт. Целесообразно собирать системы в среднем из 6 (коммерческие варианты от 5 до 7) или 12 (10-14) ячеек — при бортовом напряжении автомобилей 12(14) или 24(28) вольт.
Предположим, мы имеем идеальный по токовому выходу электролизер, имеющий 6 последовательно соединенных ячеек. Для получения производительности этого электролизера по газу в один литр в минуту он должен потреблять ток 95,72/6 = 15,95 ампер. Если учитывать, что при электролизе в предлагаемых системах получаемый газ имеет как минимум комнатную температуру, то получается очень просто запоминаемое соотношение:
6 ячеек — потребление тока 15 ампер — выход газа 1 литр в минуту.
Если используется идеальный по токовому выходу электролизер с 12 ячейками, то производительность по газу при том же токе удваивается:
12 ячеек — потребление тока 15 ампер — выход газа 2 литра в минуту.
Энергетическая эффективность процесса электролиза (КПД электролизера).
Как было отмечено выше, минимальное напряжение, при котором процесс электролиза воды может происходить в одной электролизной ячейке, составляет 1,23 вольта – это так называемый равновесный потенциал обратимой реакции. В реальных условиях для электрохимического получения достаточных количеств продуктов необходима существенно большая разность потенциалов, связанная с явлениями поляризации электродов (перенапряжение). Но мы не будем вникать в тонкости электрохимической кинетики.
КПД электролизера численно равен отношению минимально необходимой для получения единицы массы вещества электрической энергии к практически затрачиваемой, выраженному в процентах.
Приложение разности потенциалов (напряжения) к электродам позволяет перенести некоторый заряд, поддерживая некоторую силу тока через ячейку в течение некоторого промежутка времени. Очевидно, чем меньшее напряжение будет приложено и чем больший токовый выход будет иметь место при всех прочих равных условиях, тем больше будет и энергетическая эффективность процесса. Таким образом, максимальный КПД может быть получен при напряжении на ячейке, равном равновесному потенциалу (1,23В), при 100%- ном токовом выходе.
Основываясь на предыдущем изложении, получаем формулу:
U — среднее напряжение на электролизере [В], I — ток через электролизер [А], t — время [сек], в течение которого производится объем газа V[л], 7060 Дж/л — минимальная энергия для производства одного литра газа при нормальных условиях.
Поскольку в реальных условиях одна и та же масса газа будет иметь разный объем в зависимости от его температуры и атмосферного давления, необходимо делать соответствующую поправку (источник)
В следующем выражении учтены температура газа и атмосферное давление:
Когда нами проводились эксперименты с целью отработки конструкции электролизной системы, было сделано несколько опытов для проверки правильности расчетов ее КПД. Для этого в лабораторных условиях электролизер какой-либо очередной конструкции, соединенный с ним резервуар электролита (термостатирующий контур не подключен), а также газоотводящий шланг и барботер с водой для промывки газа термоизолировались пенопластом или вспененным полиэтиленом, после чего через электролизер подавали постоянный ток 25-35 ампер (стабилизация по току) в течение продолжительного времени – 30-50 минут. Поскольку КПД электролизера заведомо был ниже 100%, часть мощности тратилась на нагревание. Были известны –время эксперимента (электронный секундомер), исходная и конечная температура электролита и всех частей установки, включая технологические жидкости (прямое измерение), а также их масса (прямое измерение) и теплоемкости (справочные данные по использованным материалам), кроме того, в течение эксперимента через короткие интервалы времени регулярно измерялись рабочее напряжение (мультиметр) и стабилизированный ток (амперметр с шунтом 50А, 75 мВ). Производительность по газу определялась с помощью газовых часов. Атмосферное давление определялось бытовым барометром. После очередного эксперимента по данным о темпе газовыделения, токе и усредненном по времени напряжении делался расчет КПД (метод законов электролиза). Параллельно производился и расчет калориметрическим способом – по темпу тепловыделения. Последний метод всегда давал завышенное значение КПД системы по сравнению с первым, очевидно, вследствие неучтенных теплопотерь. Однако, расхождение результатов расчетов не превышало 10-12%.
3.1. Механизм горения водорода в кислороде
Стехиометрическое уравнение реакции записывается в виде:
Прямое взаимодействие молекул водорода и кислорода не происходит, и механизм процесса носит цепной характер.
Реакция зарождения цепи.
Возможны три варианта реакции зарождения цепи:
Разложение молекул водорода при столкновении с возбужденной молекулой:
Столкновение возбужденных молекул водорода и кислорода:
В газообразной смеси, как правило, содержатся пары воды:


Если сложить реакции (15) – (18) получим брутто-реакцию:
В реакции (16) образуется частица с двумя неспаренными электронами – бирадикал. В этой реакции одна активная частица образует две новых, поэтому реакция (16) является реакцией разветвления цепи.
Реакции (15-17) имеют разные энергии активации – соответственно 22, 71 и 41 кДж/моль. Так как наибольший энергетический барьер имеет реакция (16), то она наиболее медленная и является лимитирующей.
Схематически цепная реакция горения водорода представлена на рис. 3:
Рис. 3. Механизм горения водорода в кислороде
Пределы воспламенения. Полуостров воспламенения.
Для разветвленных цепных реакций существует зависимость способности гомогенной смеси к воспламенению от температуры и давления смеси. Эта зависимость называется полуостровом воспламенения. Типичный график зависимости выглядит так:
Рис. 5. Полуостров воспламенения водорода в кислороде
Верхняя и нижняя кривая образуют верхний и нижний пределы воспламенения. При условиях выше верхнего предела или ниже нижнего предела воспламенение невозможно.
Объяснение существования пределов воспламенения связано с соотношением скорости разветвления и скорости обрыва цепи. Если первая больше второй, то воспламенение произойдет. В противном случае при постоянно действующем источнике зажигания реакция переходит в стационарный режим.
Существование нижнего предела связано с тем, что при снижении давления скорость реакции разветвления уменьшается, так как она пропорциональна концентрации веществ. В то же время скорость обрыва цепи на стенках увеличивается из-за снижения концентрации молекул и числа столкновений, препятствующих достижению стенок активными частицами. Увеличивается длина свободного пробега активных частиц. Все большая доля активных частиц может достигнуть стенок сосуда. При некотором давлении скорость обрыва цепей на стенке окажется больше скорости разветвления цепей, и реакция перейдет в стационарный режим.
Существование верхнего предела связано с тем, что с ростом давления скорость обрыва цепи в объеме, которая пропорциональна квадрату давления (см. реакцию 21, в которой участвуют 2 обычных молекулы), начинает преобладать над скоростью разветвления, которая пропорциональна первой степени давления. Реакция в условиях выше верхнего предела также переходит в стационарный режим, при котором скорость обычно очень мала.
Конкретные значения величин давления и температуры отличаются для разных систем. Например, точка, в которой соединяются верхняя и нижняя кривая (мыс полуострова воспламенения), для смеси водорода и кислорода, соответствует давлению 5 мм рт. ст. и температуре 385°С, а конец верхней кривой соответствует давлению 400 мм рт. ст. и температуре 580°С.
Верхний предел значительно зависит от температуры. На него оказывает также сильное влияние природа и количество примесей, играющих роль третьей частицы при обрыве. На него мало влияет форма и размер сосуда.
Напротив, на нижний предел оказывает влияние форма сосуда, его диаметр и материал его стенок. Влияние температуры на нижний предел незначительно.
Поэтому каждому составу смеси и каждому реакционному сосуду отвечает своя область воспламенения. При постоянном общем давлении горючего и окислителя изменение их соотношения также приводит к изменению пределов воспламенения. При снижении концентрации горючего (при сохранении постоянным общего давления) весь график смещается вправо параллельно оси температуры. При добавлении в горючую смесь инертного газа пределы воспламенения также будут изменяться. Например, нижний предел будет снижаться. Смесь, которая могла находиться вне пределов воспламенения, при добавлении инертного газа может попасть внутрь полуострова и воспламениться.
3.2. Механизм горения оксида углерода (II)
Оксид углерода СО является одним из важнейших и широко применяемых в промышленности видов газообразного топлива. Он применяется в металлургии, где получается при коксовании углей. Он является основным компонентом горючей газовой смеси при газификации углей (превращении углей в газообразное топливо).
Особенностью реакции является то, что она идет очень медленно, если в смеси отсутствуют пары воды. Константа скорости горения сухого и влажного СО отличается на шесть порядков. Объясняется это тем, что молекула СО имеет очень прочную химическую связь, и не распадается при обычных условиях зажигания. Выше сообщалось, что молекула кислорода также очень прочная и не может служить источником радикалов. Поэтому процесс резко ускоряется в присутствии паров воды.
Реакция (26) является основной реакцией образования конечного продукта горения оксида углерода СО2.
На первый взгляд, реакция (25) является реакцией разветвления цепи. Однако особенность механизма горения СО заключается в том, что бирадикал кислорода улавливается оксидом углерода и далее не дает никаких активных частиц:
Поэтому реакция горения, несмотря на наличие стадии разветвления цепи, не считается разветвленной цепной реакцией.
Экспериментально полученная зависимость скорости горения СО выглядит так:

Важная роль воды для реакции горения СО подтверждается тем, что ее концентрация входит в кинетическое уравнение реакции.
Энергия активации реакции равна 28,3кДж/моль.