Что представляет модель атома томсона
Модель атома Томсона
«Существование атомов невозможно доказать. Их нельзя увидеть, нельзя потрогать, они существуют только в нашем воображении. Это абстракция.»
Эрнст Мах
Со времен Демокрита атом считался элементарной структурной единицей вещества. А так ли это? Оказывается, нет. И первым, кто это доказал, был английский физик Джозеф Томсон.
Преддверие открытия
Плюккер поставил довольно простой эксперимент. В герметичную стеклянную трубку с разреженным газом были помещены два электрода. Катод подключался к отрицательному полюсу батареи, анод—к положительному. При подаче высокого напряжения газ в трубке начинал светиться. Откачивая газ из трубки, Плюккер наблюдал постепенное исчезновение свечения, и лишь слегка оно оставалось в области анода. Так в 1859 году было открыто новое излучение.
Немецкий физик Ойген Гольдштейн продолжил работу Плюккера, он высказал идею о волновой природе открытого излучения и назвал его катодными лучами. Англичанин Уильям Крукс не согласился с ним и предположил, что катодные лучи являются потоками частичек вещества. Его правоту уже 1895 году подтвердил французский физик Жан Перрен, который экспериментально доказал, что этот поток движется прямолинейно, но может отклоняться магнитным полем.
Можно сказать, что подготовительные работы к раскрытию тайны атома были уже проведены. В этом же году к исследованию катодных лучей в Кавендишской лаборатории Кембриджского университета приступает ее директор Джозеф Томсон. Изучая отклонение лучей в магнитном поле, он приходит к выводу, что все частицы, образующие катодные лучи, одинаковы, или, говоря языком физики, тождественны, и являются составляющими вещества. Измерив скорость их движения, которая была значительно ниже скорости света, Томсон понял, что они обладают массой и находятся в составе атомов. А значит, атом не такой уж и неделимый.
«Каша в голове — так поделись с ближним!» (Джозеф Джон Томсон)
Атом-пудинг. Как это по-английски!
После открытия электрона неделимость атома уже стала доказанным фактом, и пришла пора построить модель атома. К построению этой модели и приступил Джозеф Томсон. И лишь спустя семь лет, в 1904 году, он предложил один из ее вариантов.
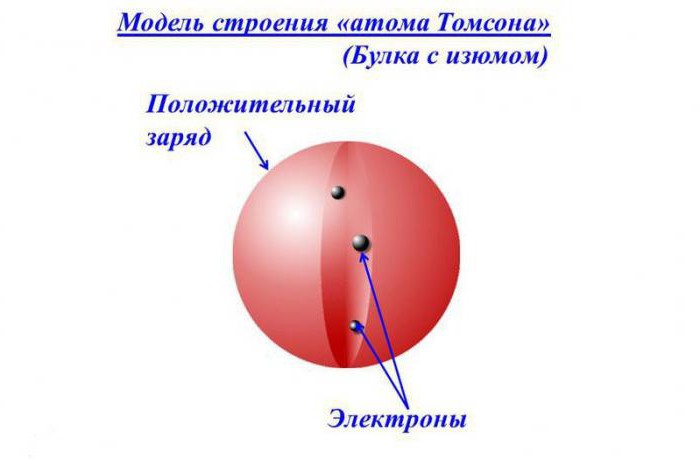
Согласно его модели, атом состоит из отрицательно заряженных электронов (хотя сам Томсон называл их «корпускулами»), обладающих наименьшим квантованным зарядом — то есть не может быть заряда меньше, чем у электрона, и не может быть заряда в полтора электрона, — и положительно заряженного «шара» (или облака), компенсирующего отрицательные заряды электронов. Так что в целом атом электронейтрален.
Модель напоминала пудинг, в котором находились изюминки, впоследствии она получила название «пудинговая модель атома». Справедливости ради следует заметить, что сам ученый никогда не давал ей такое название.
В соответствии с этой моделью электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что при удалении электрона от центра положительно заряженного облака он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи. В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а наличие спектров объясняло энергетические различия между различными кольцевыми орбитами.
Модель Томсона была способна объяснить излучение атомом электромагнитных волн определенной частоты колеблющимися электронами, выведенными из положения равновесия, но она не смогла объяснить излучение большого числа спектральных линий. Также модель Томсона не давала возможности понять, что определяет размеры атомов. Но это был только первый шаг в познании структуры атома. Поскольку выяснилось, что электрон обладает наименьшим квантованным зарядом, открытие Томсона еще раз доказало существование квантовой природы физических процессов в микромире.
Электрон как частица был обнаружен в 1897 году английским физиком Джозефом Джоном Томсоном. Через 9 лет ученому присудили Нобелевскую премию с формулировкой «за исследования проводимости электричества газами». Его сын, Джордж Паджет Томсон, в 1927 году обнаружил волновые свойства электрона и впоследствии тоже удостоился Нобелевки «за экспериментальное открытие дифракции электронов на кристаллах».
Модель атома Томсона
Модель Томсона (иначе называемая «пудинговая модель атома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. Открыв в 1897 году электрон, Томсон предположил, что «корпускулы»(так Томсон называл электроны, хотя ещё в 1894 году Дж. Дж. Стоуни предложил называть «атомы электричества» электронами [1] ) являются составными частями атома и решил создать модель атома, отражающую это предположение.
Содержание
Описание модели
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд… [2]
Атом по Томсону состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий отрицательные заряды электронов, подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Электроны, как предполагалось, были распределены по всему атому. Было несколько вариантов возможного расположения электронов внутри атома, в частности вращающиеся кольца электронов. В некоторых вариантах модели вместо «супа» предлагалось «облако» положительного заряда.
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что, при удалении электрона от центра положительно заряженного облака, он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи (по закону Гаусса). В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Статья Томсона была опубликована в марте 1904 года в Философском журнале (Philosophical Magazine), ведущем британском научном журнале того времени. Томсон позднее пытался объяснить с помощью своей модели яркие спектральные линии некоторых элементов, но не особо в этом преуспел.
Тем не менее, модель Томсона (также как подобная модель сатурнианских колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла) стала ранним предвестником более поздней и более успешной модели Бора, представляющей атом как подобие Солнечной системы.
Опровержение модели Томсона
Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
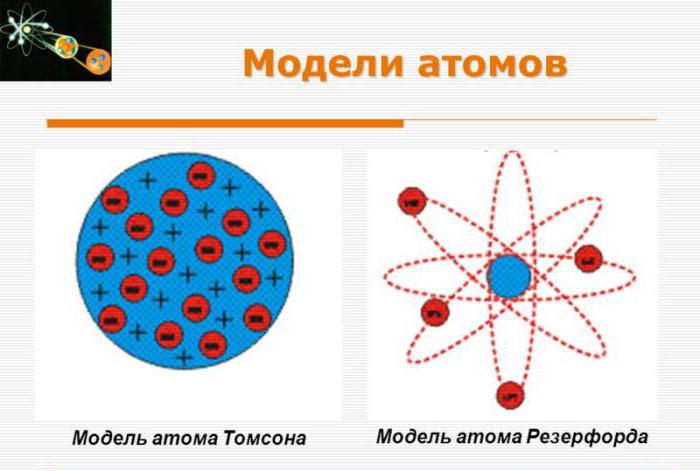
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Планетарная модель атома
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Модель атома Томсона: описание и опровержение
Модель атома Томсона – одна из ранних моделей строения атома, впоследствии признанная несостоятельной. Впервые предложена Д.Д. Томсоном в 1904 году вскоре после открытия электронов, но до открытия атомного ядра.
Предыстория
В 1897 году в физике произошло знаменательное событие: Томпсон Джозеф Джон открыл электроны, тем самым экспериментально подтвердив предположение, что атом не является «монолитной» частицей. Однако точного представления, что же из себя представляют элементарные частицы, не было. Лишь в 1911 году будет представлена более точная модель атома Резерфорда, а до этого научный мир лихорадочно бился над «загадкой столетия».
Поиск ответа
После серии экспериментов выяснилось, что электроны отрицательно заряжены, а между тем уже было известно, что атомы имеют нейтральный заряд. Томсон разумно предположил, что в атоме должен быть некий источник положительного заряда для компенсации отрицательного заряда электронов.
Английский физик представил три возможных механизма взаимодействия внутри частиц.
Внимание общественности
Модель атома Томсона в 1904 году была опубликована в мартовском выпуске Philosophical Magazine – авторитетном научном журнале Британии. По мнению автора, атомы элементов состоят из ряда отрицательно наэлектризованных корпускул (электронов), заключенных в сферу равномерной положительной электризации. Томсон отказался от более ранней своей гипотезы «туманного атома», в которой частицы состояли из нематериальных вихрей.
Публикация вызвала неподдельный интерес у научного сообщества. Однако прочных доказательств она не имела, а, следовательно, критиковалась многими авторитетными физиками. Впрочем, она соответствовала тем представлениям и экспериментальным данным, которые были известны на то время.
Описание модели
Будучи проницательным и практичным ученым, Томсон основывал свою атомную модель на известных экспериментальных данных. Предложение о положительном объеме заряда отражает характер его научного подхода к открытию, которое стало руководством к действию для будущих экспериментов.
Согласно теории, орбиты электронов внутри атомной модели Томсона были стабилизированы тем, что, когда электрон удалялся от центра положительно заряженной сферы (облака), он подвергался воздействию увеличивающейся силы притяжения. Эта сила возвращает электрон обратно, поскольку по закону Гаусса, внутри сферы более высокая концентрация положительного заряда. Согласно модели, электроны могли свободно вращаться по кольцам, которые были дополнительно стабилизированы взаимодействием между электронами, а спектроскопические значения объясняли энергетические различия между отдельными кольцевыми орбитами.
Согласно представлению того времени, электроны располагались в положительно заряженной сфере словно изюминки в пироге, или кусочки фруктов в любимом англичанами десерте – сливовом пудинге. Поэтому концепцию еще называют «пудинговой» моделью атома.
Дилемма несоответствия
По мере накопления экспериментальных данных все отчетливее наблюдалось несоответствие данной теории. Томсон безуспешно пытался переделать свою модель, чтобы объяснить некоторые из основных спектральных линий, экспериментально выявленных для нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда провели эксперименты с тонким листом золота, рассеивая альфа-частицы на золотой фольге. Данные оказались отличными от ожидаемых. В 1911 году Резерфорд после долгих размышлений опубликовал собственную концепцию, названную впоследствии моделью атома Резерфорда. Он предположил наличие очень маленького ядра с сильнейшим положительным зарядом в центре атомов золота, достаточного для удержания порядка ста электронов.
Дальнейшее развитие
Данная работа послужила базисом для создания Нильсом Бором полуклассической модели атомов в 1913 году. Она напоминает взаимодействие светила и планет в Солнечной системе, но только с квантовыми ограничениями.
Значение для науки
Модель атома Томсона послужила толчком для стремительного развития ядерной физики. Концепция «сливового пудинга» с одним электроном использовалась физиком Артуром Эрихом Хаасом в 1910 году для оценки численного значения постоянной Планка и боровского радиуса атомов водорода. Работа Хааса была опубликована за три года до выводов Нильса Бора. Следует отметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон.
Кроме того, теория «пудинга» позволяет определить оптимальное распределение равных точечных зарядов на единичной сфере, называемой проблемой Томсона. Кстати, физическая система, воплощенная в проблеме Томсона, является частным случаем одной из восемнадцати нерешенных математических задач, предложенных математиком Стивом Смейлом – «Распределение точек на двумерной сфере».
Проблема Томсона является естественным следствием модели «пучкового пудинга» в отсутствие равномерного положительного фонового заряда. Электростатическое взаимодействие электронов, ограниченных сферическими квантовыми точками, также аналогично их обработке в атомной модели Томсона. В этой классической задаче квантовая точка моделируется как простая диэлектрическая сфера (вместо однородной, положительно заряженной сферы, как в модели «пучкового пудинга»), в которой находятся свободные или избыточные электроны.
Атомная модель томсоновских характеристик, экспериментов, постулатов
Атомная модель Томсона был признан в мире за то, что впервые осветил конфигурацию протонов и электронов в структуре атома. Благодаря этому предложению Томсон предположил, что атомы были однородными и содержали положительный заряд однородным образом со случайными вставками электронов внутри каждого атома..
Чтобы описать это, Томсон сравнил свою модель со сливовым пудингом. Это сравнение позже использовалось в качестве альтернативного имени для модели. Однако из-за ряда несоответствий (теоретических и экспериментальных) в отношении распределения электрических зарядов внутри атома модель Томсона была отброшена в 1911 г..
происхождения
Эта атомная модель была предложена английским ученым Джозефом Джоном «Дж. Дж.» Томсоном в 1904 г. с целью объяснения состава атомов на основе представлений, о которых мы знали к тому времени..
Кроме того, Томсон был ответственным за открытие электрона в конце 19-го века. Стоит отметить, что модель атома Томсона была предложена вскоре после открытия электрона, но до того, как стало известно о существовании атомного ядра..
Поэтому предложение состояло в рассредоточенной конфигурации всех отрицательных зарядов внутри атомной структуры, которая, в свою очередь, состояла из однородной массы положительного заряда..
черты
— Атом имеет нейтральный заряд.
— Существует источник положительного заряда, который нейтрализует отрицательный заряд электронов.
— Этот положительный заряд равномерно распределен в атоме.
— По словам Томсона, «отрицательно электрифицированные корпускулы», то есть электроны, содержатся в однородной массе положительного заряда.
— Электроны могли свободно выводиться внутри атома.
— Электроны имели стабильные орбиты, аргумент, основанный на законе Гаусса. Если электроны перемещались через положительную «массу», внутренние силы внутри электронов были уравновешены положительным зарядом, который автоматически генерировался вокруг орбиты..
— Модель Томсона была широко известна в Англии как модель черносливного пудинга, поскольку предложенное Томсоном распределение электронов было похоже на расположение слив в указанном десерте..
Эксперименты по разработке модели
Томсон провел несколько испытаний с электронно-лучевыми трубками, чтобы проверить свойства субатомных частиц и заложить основы своей модели. Катодно-лучевые трубки представляют собой стеклянные трубки, содержание воздуха в которых опустошено почти полностью.
Эти трубки электрифицированы с помощью батареи, которая поляризует трубку, чтобы иметь отрицательный конец заряда (катод) и положительно заряженный конец (анод).
Они также герметизированы с обеих сторон и подвергаются воздействию высокого напряжения путем электрификации двух электродов, размещенных на катоде устройства. Эта конфигурация вызывает циркуляцию пучка частиц от катода к аноду трубки.
Катодные лучи
Существует происхождение названия этого типа инструментов, так как они называются катодными лучами из-за точки выхода частиц внутри трубки. Окрашивая анод трубки материалом, таким как фосфор или свинец, на положительном конце генерируется реакция как раз тогда, когда пучок частиц сталкивается с ним..
В своих экспериментах Томсон определил отклонение луча на пути от катода к аноду. Позже Томсон попытался проверить свойства этих частиц: в основном, электрический заряд и реакцию между ними..
Английский физик разместил две электрические пластины с противоположным зарядом на верхнем и нижнем концах трубки. Из-за этой поляризации луч был отклонен к положительно заряженной пластине, расположенной на верхнем упоре.
Таким образом, Томсон показал, что катодный луч состоит из отрицательно заряженных частиц, которые благодаря своему противоположному заряду притягиваются к положительно заряженной пластине..
Эволюция в исследованиях
Томсон развил свои предположения и, после этого открытия, поместил два магнита с обеих сторон трубки. Это включение также повлияло на некоторые отклонения катодного луча.
Анализируя соответствующее магнитное поле, Томсон смог определить отношение массы к заряду субатомных частиц и обнаружил, что масса каждой субатомной частицы была незначительной по сравнению с атомной массой..
Джей-Джей Томсон создал устройство, которое предшествовало изобретению и усовершенствовало то, что сейчас известно как масс-спектрометр.
Это устройство выполняет довольно точное измерение взаимосвязи между массой и зарядом ионов, что дает чрезвычайно полезную информацию для определения состава элементов, присутствующих в природе..
Повторение эксперимента
Томсон неоднократно проводил один и тот же эксперимент, модифицируя металлы, которые он использовал для размещения электродов в электронно-лучевой трубке..
Наконец, он определил, что свойства луча остаются постоянными, независимо от материала, используемого для электродов. То есть этот фактор не был определяющим при выполнении эксперимента.
Исследования Томсона были очень полезны для объяснения молекулярной структуры некоторых веществ, а также образования атомных связей.
постулаты
Модель Томсона объединила в одном заявлении благоприятные выводы британского ученого Джона Далтона о строении атома и намекала на присутствие электронов в каждом атоме.
Кроме того, Томсон также провел несколько исследований протонов в неоновом газе и тем самым продемонстрировал электрическую нейтральность атомов. Однако положительный заряд на атоме был предложен как однородная масса, а не как частицы.
Эксперимент Томсона с катодными лучами позволил сформулировать следующие научные постулаты:
— Катодный луч состоит из субатомных частиц с отрицательным зарядом. Томсон первоначально определил эти частицы как «корпускулы».
— Масса каждой субатомной частицы в 0,0005 раз превышает массу атома водорода..
— Эти субатомные частицы находятся во всех атомах всех элементов Земли.
— Атомы электрически нейтральны; то есть отрицательный заряд «корпускул» приравнивается к положительному заряду протонов.
Спорная модель
Модель атома Томсона оказалась весьма спорной в рамках научного сообщества, потому что это идет вразрез с моделью атома Дальтона.
Последний постулировал, что атомы являются неделимыми единицами, несмотря на комбинации, которые могут генерироваться в ходе химических реакций..
Напротив, Томсон нашел новую модель, которая обеспечивала альтернативное объяснение атомного и субатомного состава после открытия электрона..
Атомная модель Томсона была быстро обнаружена сравнением с популярным английским десертом «сливовый пудинг». Масса пудинга символизирует целостное представление об атоме, а сливы представляют каждый из электронов, составляющих атом.
ограничения
Модель, предложенная Томсоном, в то время пользовалась большой популярностью и признанием и послужила отправной точкой для исследования атомной структуры и точной настройки соответствующих деталей..
Основной причиной принятия модели было то, насколько хорошо она адаптировалась к наблюдениям экспериментов Томсона с катодными лучами..
Тем не менее, модель имела важные возможности для улучшения, чтобы объяснить распределение электрических зарядов внутри атома, как положительных, так и отрицательных зарядов.
Исследования Резерфода
Позже, в десятилетии 1910 года, научная школа под руководством Томсона продолжила исследования по моделям строения атома..
Так Эрнест Резерфорд, бывший ученик Томсона, определил ограничения атомной модели Томсона в компании британского физика Эрнеста Марсдена и немецкого физика Ганса Гейгера..
Трио ученых провело несколько экспериментов с альфа (α) частицами, то есть ионизированными ядрами молекул 4Не, без электронного покрытия вокруг них..
Частицы этого типа состоят из двух протонов и двух нейтронов, поэтому положительный заряд преобладает. Альфа-частицы образуются в ядерных реакциях или в результате экспериментов с радиоактивным распадом.
Резерфорд разработал схему, которая позволяла оценивать поведение альфа-частиц при пересечении твердых веществ, таких как, например, листы золота..
При анализе пути было обнаружено, что некоторые частицы имели угол отклонения при проникновении в листы золота. В других случаях незначительный отскок был также замечен на элементе удара.
После исследований с альфа-частицами Резерфод, Марсден и Гейгер противоречили атомной модели Томсона и предложили новую атомную структуру..
Новое предложение
Встречное предложение Резерфорда и его коллег состояло в том, что атом состоит из небольшого ядра высокой плотности, в котором вокруг него сосредоточены положительные заряды и кольцо электронов..
Открытие Резерфордом атомного ядра принесло с собой новый воздух для научного сообщества. Однако спустя годы эта модель также была аннулирована и заменена атомной моделью Бора..