Что принимать при недержании мочи
Лечение недержания мочи
Недержание мочи (инконтиненция) — это непроизвольное выделение мочи, являющееся не только медицинской, но и социальной проблемой (при наличии объективных проявлений неконтролируемого мочеиспускания) (ISC) (C. P. Bates, W. Bradley et al., 1981; M. Gray, 2
Недержание мочи (инконтиненция) — это непроизвольное выделение мочи, являющееся не только медицинской, но и социальной проблемой (при наличии объективных проявлений неконтролируемого мочеиспускания) (ISC) (C. P. Bates, W. Bradley et al., 1981; M. Gray, 2004).
На сегодняшний день недержание мочи принято разделять на следующие виды:
В клинической практике чаще всего встречаются три формы недержания мочи: стрессовое, ургентное и смешанное.
По данным последних эпидемиологических исследований, проведенных в разных странах мира, выявлено, что частота стрессового недержания мочи составляет 50%, императивного (ургентного) — 14% и смешанной формы — 32% (V. A. Mikassian, H. P. Dralz et al., 2003).
Стрессовое недержание мочи характеризуется непроизвольными потерями мочи, связанными с превышением внутрипузырного давления над максимальным уретральным в отсутствие сокращений детрузора, и возникает при кашле, смехе, чихании, подъеме тяжестей, беге, перемене положения тела из горизонтального в вертикальное. Часто это состояние именуется недержанием мочи при напряжении (НМПН) (A. E. Bent, 2003).
Императивное (ургентное) недержание мочи — непроизвольное подтекание мочи при внезапном, нестерпимом, повелительном позыве на мочеиспускание, обусловленном непроизвольными сокращениями детрузора, и характеризуется наличием частых дневных (поллакиурией) и ночных (ноктурией) мочеиспусканий, императивных (неудержимых) позывов к мочеиспусканию с потерей или без потери мочи.
Смешанное недержание мочи — это заболевание, в котором комбинируются с различной степенью тяжести симптомы стрессового и императивного недержания мочи.
Стрессовое недержание мочи — наиболее часто встречающийся тип инконтиненции у женщин в репродуктивном периоде и в перименопаузе. По данным разных авторов, им страдают от 20 до 30% пациенток. Факторы риска развития стрессового недержания мочи весьма разнообразны. Согласно последним данным, в развитии заболевания основную роль играет не количество, а характер родов (M. Gray, 2004). Недержание мочи при напряжении чаще возникает после родов, носивших травматичный характер, сопровождающихся разрывами мышц тазового дна, промежности, мочеполовой диафрагмы и при пользовании акушерскими пособиями (P. Toozs-Hjbson, A. Cutner, 2002). Однако НМПН встречается и у пациентов, не имевших в анамнезе причин, нарушающих функцию сфинктеров мочевого пузыря. В таких случаях заболевание может быть связано с врожденной неполноценностью соединительной ткани (С. Н. Буянова, 2002). Кроме того, причинами НМПН могут являться различные гинекологические и урологические операции: гистерэктомия, а также эндоуретральные операции (Y. S. Hannestad et al., 2000).
Одной из ведущих причин стрессового недержания мочи является эстрогенная недостаточность. C. S. Iosif и Z. Bekassy (1998) показали, что у большинства женщин недержание мочи начинается одновременно с наступлением менопаузы. Это связано со снижением содержания и изменения качества коллагена II типа в соединительной ткани мышечно-связочного аппарата органов малого таза, обусловленного состоянием эстроген-дефицита.
Кроме того, к НМПН могут привести такие факторы, как тяжелая физическая нагрузка и заболевания органов дыхания, сопровождающиеся сильным и длительным кашлем, а также ряд других причин, приводящих к хроническому повышению внутрибрюшного давления.
Исходя из патогенеза стрессового недержания мочи выделяют два основных его типа:
На основании этого E. McGuire и J. Blaivas в 1988 г. была разработана классификация, которая в дальнейшем претерпела многочисленные дополнения и изменения. Эта классификация рекомендована к применению ICS (International Continence Society) и является общепринятой по сегодняшний день.
А. В покое дно мочевого пузыря выше лонного сочленения.
Б. При кашле в положении стоя определяется незначительный поворот и дислокация уретры и дна мочевого пузыря. При открытии шейки мочевого пузыря самопроизвольного выделения мочи не наблюдается.
А. В покое дно мочевого пузыря выше лонного сочленения.
Б. При натуживании происходит опущение дна мочевого пузыря приблизительно на 1 см, при открытии шейки мочевого пузыря и уретры отмечается непроизвольное выделение мочи. Цистоцеле может не определяться.
А. В покое дно мочевого пузыря на уровне верхнего края лонного сочленения.
Б. При кашле отмечается значительное опущение мочевого пузыря и уретры ниже лонного сочленения. При широком открытии уретры отмечается самопроизвольное выделение мочи. Определяется цистоцеле.
А. В покое дно мочевого пузыря ниже лонного сочленения.
Б. При кашле отмечается значительное опущение мочевого пузыря и уретры, что сопровождается выраженным самопроизвольным выделением мочи. При широком открытии уретры отмечается самопроизвольное выделение мочи. Определяется цистоуретроцеле.
В покое дно мочевого пузыря находится незначительно ниже верхнего края лонного сочленения. Шейка мочевого пузыря и проксимальная уретра открыты в покое при отсутствии сокращений детрузора. Самопроизвольное выделение мочи отмечается вследствие незначительного повышения внутрипузырного давления.
При недержании мочи при напряжении типов 0, 1 и 2 происходит дислокация нормального уретровезикального сегмента и проксимальной части мочеиспускательного канала, что зачастую сопровождается развитием цистоцеле или является его следствием. Эти типы недержания мочи получили название анатомического недержания. В случае недержания мочи типа 3 уретра и шейка мочевого пузыря не функционируют более как сфинктер и представлены чаще ригидной трубкой и рубцово-измененным уретровезикальным сегментом (A. E. Bent, D. R. Ostergard, 2003).
Кроме анатомической классификации существует несколько классификаций недержания мочи (стресс-инконтиненции) по степени тяжести. Так, Д. В. Кан в 1978 г. предложил следующий вариант: I степень тяжести — минимальные потери мочи только при выраженном напряжении; II степень — недержание мочи появляется при умеренных нагрузках (бег, физические упражнения); III степень — у больной имеются выраженные потери мочи при незначительном напряжении (ходьба) или даже в покое.
Другая классификация основывается на количестве используемых прокладок в сутки. Так, при I степени их количество не превышает одной в сутки; при II степени — 2–4; при III степени тяжести — более 4 прокладок в сутки.
Современные методы лечения стрессового недержания мочи разделяются на консервативные и хирургические.
Консервативное лечение включает в себя:
Заместительная гормональная терапия (ЗГТ) применяется при стрессовом недержании мочи у женщин с достоверно выявленным эстроген-дефицитом. По нашим данным, ЗГТ улучшает кровообращение, трофику и сократительную способность мышц тазового дна. Кроме того, она повышает содержание коллагена в соединительной ткани за счет деградации «старого» и синтеза «нового» коллагена, увеличивая при этом прочность и эластичность мышечно-связочного аппарата урогенитального тракта (D. Perruchini et al., 1997).
В настоящее время существует большое количество препаратов для ЗГТ, и ее назначение требует отдельного и тщательного обследования.
Из α-андреномиметиков наиболее часто для лечения стрессового недержания мочи применяется мидодрин (Гутрон) по 2,5 или 5 мг 2 раза в день под контролем артериального давления. Гутрон стимулирует периферические α-адренорецепторы симпатической нервной системы, что приводит к повышению тонуса гладкомышечных волокон сфинктерного аппарата мочевого пузыря и уретры. К сожалению, широкому использованию данного препарата препятствует его побочное действие: влияние его на тонус сосудов и повышение АД.
Для лечения НМПН применяют антихолинэстеразный препарат дистигмина бромид (Убретид). Убретид разрушает холинэстеразу, повышая при этом длительность действия ацетилхолина в нервно-мышечных синапсах. Это вызывает повышение тонуса, в частности мочевого пузыря, мочеточников и скелетно-мышечных волокон сфинктеров мочевыводящих путей. Убретид назначают по 5 мг утром натощак. После 1–2 нед лечения дозу можно увеличить до 10 мг в сутки или снизить до 5 мг в течение 2–3 дней в зависимости от клинического эффекта.
Убретид назначается пациенткам со стрессовым недержанием мочи в случае сочетания ее с гипотонией мочевого пузыря и снижением сократительной способности детрузора, выявленных при уродинамическом исследовании.
В зарубежной литературе появились работы по применению дулоксетина (Симбалты) для терапии стрессового недержания мочи у женщин (B. R. Coolsaet, 2006). Дулоксетин является селективным ингибитором обратного захвата серотонина и норадреналина, повышая при этом сократительную активность поперечно-полосатой мускулатуры сфинктера мочевого пузыря и уретры за счет стимуляции α1-адренергических и 5-гидрокситриптамин-2-рецепторов моторных нейронов полового нерва. Препарат достаточно эффективен для лечения легкой степени недержания мочи; при средней степени тяжести и тяжелой форме стресс-инконтиненции дулоксетин снижает частоту эпизодов недержания мочи у 50% пациенток.
К сожалению, данный препарат довольно часто вызывал диспепсические явления, в большинстве случаев — тошноту, из-за которой от 30 до 40% пациенток вынуждены были прервать курс лечения.
Дополнительным методом лечения НМПН является метод обратной биологической связи, сущность которого состоит в тренировке мышц тазового дна в определенном режиме (тонические и фазовые произвольные сокращения мышц наружного сфинктера уретры и наружного анального сфинктера) под контролем врача. Положительным моментом этого метода является возможность количественного определения изменений тонуса мышц тазового дна с помощью различных приспособлений: баллонов для измерения ректального и влагалищного давления, хондовых электромиографов, концентрических игольчатых электромиографов (K. E. Allen, 2002).
В настоящее время для тренировки мышц тазового дна используются компьютерные установки, которые с помощью специальных влагалищных или ректальных датчиков улавливают изменения тонуса работающих мышц и отображают эти изменения на мониторе в виде графических изображений. При этом пациентка может наблюдать за правильностью и эффективностью своей работы.
Метод обратной биологической связи применяется отдельно или в сочетании с медикаментозной терапией и дает наилучшие результаты у женщин молодого возраста с легкой степенью недержания мочи (B. Mouz, H. Hampel, S. H. Porkes et al., 2005).
Электрическая стимуляция используется в тех случаях, когда упражнения неэффективны или пациентка не в состоянии их делать по различным причинам. Клинический смысл электростимуляции также заключается в тренировке и укреплении мышц тазового дна, только роль побуждающего сигнала к сокращению играют токи различной частоты и интенсивности. Данные об эффективности этого метода варьируют и требуют дальнейшего изучения (N. Galloway et al., 1999; D. Bailie et al., 2000).
Таким образом, консервативное лечение является эффективным при легкой степени стрессового недержания мочи и при отсутствии значительных нарушений анатомического положения органов малого таза.
Пациенткам со средней и тяжелой степенью стресс-инконтиненции консервативная терапия может быть рекомендована для подготовки женщины к оперативному лечению, а также в случае твердого отказа пациентки от операции или при невозможности ее проведения в связи с сопутствующей экстрагенитальной патологией.
Хирургический метод на сегодняшний день является наиболее эффективным для лечения стрессового недержания мочи.
На сегодняшний момент разработано и модифицировано более 200 различных методов хирургической коррекции стресс-инконтиненции, которые разделены на четыре основные группы:
Выбор того или иного метода хирургического лечения должен осуществляться с учетом типа и степени тяжести НМПН, а также с учетом наличия и степени цистоцеле. Но наиболее распространенным методом лечения стрессового недержания мочи являются различные варианты слинговых операций (TVT, TVT-obturator или TVT-secur).
Эффективность современных слинговых операций, по данным разных авторов, колеблется от 80 до 90%. Однако, несмотря на высокую эффективность хирургических вмешательств, частота рецидивов недержания мочи остается высокой — от 6 до 30%.
Кроме того, выполнение вышеупомянутых видов оперативного лечения стрессового недержания мочи может сопровождаться целым рядом серьезных осложнений, таких как: ранение мочевого пузыря, уретры, кишечника, сосудов малого таза; обструкция мочевых путей; инфекции мочевых путей; остеомиелит лонных костей; образование спаек в полости малого таза (С. В. Буянова, 2002).
Существуют и методики малоинвазивных методов лечения НМПН, одним из которых является инъекционная парауретральная имплантация объемообразующих препаратов.
Лечение НМПН инъекционным методом имеет более чем 100-летнюю историю, и изначально заложенное представление о механизме его действия практически не претерпело существенных изменений. Парауретральное введение специальных средств подчинено одной цели — компрессии уретры для повышения закрывающего внутриуретрального давления (Е. Л. Вишневский и соавт., 2005).
Эффективность данной процедуры во многом зависит от применяемого материала. В качестве объемообразующих препаратов использовались различные биологические материалы (аутогенный свободный жир, свиной и бычий кожный коллаген), а также синтетические полимеры (парафин, силикон, политетраэтилен, тефлон) (B. C. Murless, 1938; R. Quackels, 1955; H. Sachse, 1963). Эффективность данного метода лечения НМПН, по данным разных авторов, достигала 70–80%. Однако первоначально достигнутый клинический эффект со временем угасал вследствие того, что применяемые препараты были подвержены биодеградации, рассасыванию и миграции в отдаленные органы и ткани и обладали высокой аллергенностью. Кроме того, отметим, что вышеперечисленные препараты — зарубежного производства и отличаются высокой стоимостью.
Таким образом, инъекционная парауретральная имплантация объемообразующих препаратов является на сегодняшний день довольно перспективным методом лечения стрессового недержания мочи, так как характеризуется:
Однако следует помнить, что инъекционная терапия имеет свои четкие показания. Данный метод целесообразно применять:
Императивное недержание мочи чаще всего связывают с развитием гиперактивного мочевого пузыря (ГАМП) и рассматривают как составную часть синдрома императивных нарушений мочеиспускания. Последний включает в себя:
Данные симптомы могут встречаться как изолированно, так и в сочетании друг с другом.
По данным последних популяционных исследований, проведенных в европейских странах (Франции, Германии, Италии, Испании, Швеции, Великобритании) и США, симптомы ургентного мочеиспускания отмечает не менее 17% населения старше 40 лет, из них — 56% женщины и 44% — мужчины. Причем с возрастом частота симптомов возрастает до 30% у лиц старше 65 лет и до 50% — после 70 лет (V. A. Mikassian, H. P. Dralz et al., 2003).
Одной из наиболее частых причин развития данной патологии у женщин являются воспалительные заболевания мочевых путей. По данным разных авторов, от 50 до 70% пациенток, страдающих императивными формами расстройств мочеиспускания, отмечают в анамнезе хронические циститы или уретриты (M. Lisec, 2004).
Вторая по значимости и распространенности причина развития синдрома императивного мочеиспускания — эстрогенная недостаточность. Большинство женщин старше 45 лет указывают на то, что начало заболевания совпадает с наступлением менопаузы. Причем распространенность этого симптомокомплекса зависит от длительности постменопаузы и увеличивается с 15,5% при постменопаузе до 5 лет до 71,4% при длительности постменопаузы более 20 лет, что связывают с нарастанием эстрогенного дефицита и, как следствие этого, ишемией мочевого пузыря и атрофией уротелия (H. Strasser et al., 2000).
Помимо этого, причиной развития синдрома императивного мочеиспускания может стать различная неврологическая патология: ишемия головного мозга, инсульт, рассеянный склероз, паркинсонизм, травмы и опухоли головного и спинного мозга (Blok et al., 1997; K. E. Anderson, 2000). Среди других причин возникновения данного заболевания некоторые авторы выделяют: оперативные вмешательства на органах малого таза, сахарный диабет, малоподвижный образ жизни.
Основным методом диагностики данного заболевания является уродинамическое исследование, в ходе которого возможно выявить гиперактивность детрузора, проявляющуюся непроизвольными его сокращениями во время фазы накопления, а также уменьшение резервуарной функции мочевого пузыря.
Лечение
Лечение императивных форм нарушений мочеиспускания представляет собой сложную, трудоемкую задачу.
Выбор препаратов во многом зависит от причины возникновения ГАМП. Пациенткам, у которых заболевание развивается на фоне эстроген-дефицита, показана ЗГТ (локальная, системная или сочетанная). Полагают, что эстрогены, входящие в состав ЗГТ, вызывают:
Кроме того, эстрогены влияют на активность эфферентных компонентов Т-клеточного звена локального иммунитета, что может являться одним из факторов, препятствующих развитию восходящей урологической инфекции.
В случае эффективности лечения и исчезновения симптомов ЗГТ может продолжаться в соответствии с принятыми в настоящее время сроками (системная — в среднем 5–7 лет, локальная — без ограничения длительности). Большое значение в лечении императивных нарушений мочеиспускания имеет правильный выбор селективного модулятора негормональных рецепторов мочеполового тракта, что возможно только на основании результатов комплексного уродинамического исследования.
Так, при выявлении гиперактивности детрузора назначаются препараты, обладающие М-холинолитическим действием (возможна их комбинация с ЗГТ):
— троспия хлорид (Спазмекс) обладает антимускариновым, антиспазматическим и местным анестезирующим действием;
— оксибутинин хлорид (Дриптан), мощный конкурентный антагонист М2— и М3-мускариновых рецепторов мочевого пузыря;
— толтеродин (Детрузитол), селективный антагонист мускариновых рецепторов;
— солифенацин (Везикар), новый уроселективный М-холиноблокатор.
Троспия хлорид (Спазмекс) относится к группе парасимпатолитиков или антихолинергических средств, является конкурентным антагонистом ацетилхолина на рецепторах постсинаптических мембран, блокирует мускариновое действие ацетилхолина и ингибирует ответ, вызванный постганглионарной парасимпатической активацией блуждающего нерва, так как имеет высокое сродство к М2— и М3-холинорецепторам. Троспия хлорид снижает тонус гладкой мускулатуры мочевого пузыря, оказывает расслабляющее действие на гладкую мускулатуру детрузора мочевого пузыря как за счет антихолинергического эффекта, так и вследствие прямого миотропного антиспастического влияния. Исследования клинической эффективности Спазмекса, проведенные более чем на 10 000 больных, показали, что троспия хлорид достоверно снижает число мочеиспусканий в сутки и эпизодов ургентного недержания мочи.
Спазмекс является гидрофильным соединением и не проникает через гематоэнцефалический барьер, что объясняет минимальное количество побочных эффектов со стороны ЦНС при его приеме и определяет его существенно лучший профиль безопасности относительно аналогов. В ряде сравнительных исследований было показано отсутствие влияния троспия хлорида на структуру сна, в то время как оксибутинин и толтеродин нарушали фазу быстрого сна у принимавших их пациентов. Схема приема Спазмекса — по 15 мг 2–3 раза в сутки, до еды.
Полагают, что антимускариновые препараты и ЗГТ взаимно потенцируют действие друг друга. При таком сочетании стойкое положительное воздействие на сократительную активность детрузора проявляется уже через 3–4 нед лечения и сохраняется после отмены селективных модуляторов негормональных рецепторов мочеполового тракта.
В случае применения толтеродина (Детрузитола) по 2 мг 1–2 раза в день и ЗГТ взаимно потенцируется его двойное действие на мускариновые М2— и М3-рецепторы и блокаду кальциевых каналов. Эстрогены, являясь блокаторами кальциевых каналов, одновременно модулируют и синтез мускариновых рецепторов.
Для лечения пациенток с синдромом императивного мочеиспускания применяются α-адреноблокаторы (Омник — по 0,4 мг утром после приема пищи, Кардура — по 2 мг 1 раз в день ). Препараты этой группы прерывают патогенетическую цепь, связанную с развитием ишемии мочевого пузыря, в самом начале — на уровне адренорецепторов. Блокада α1-адренорецепторов сопровождается стереотипной реакцией детрузора, которая выражается в его расслаблении в фазу наполнения, увеличении резервуарной функции мочевого пузыря. Вследствие этого достигаются существенные позитивные изменения функционального состояния нижнего отдела мочевого тракта в ответ на ограничение влияния симпатической нервной системы, что выражается в исчезновении поллакиурии и нормализации суточного профиля мочеиспускания.
Солифенацин (Везикар) — новый уроселективный препарат для лечения пациентов с синдромом гиперактивного мочевого пузыря. В международных многоцентровых исследованиях (9 тыс. пациентов), доказана высокая эффективность и хорошая переносимость солифенацина (не вызывали сухости во рту у 89% пациентов).
Он эффективен в отношении всех симптомов гиперактивного мочевого пузыря, особенно в отношении наиболее беспокоящих симптомов: императивных позывов (ургентности) и императивного недержания мочи. Везикар снижает частоту ургентного недержания мочи на 71% эффективнее толтеродина.
Данный препарат обладает рядом преимуществ перед аналогичными препаратами, включая возможность гибкого режима дозирования и однократного приема в сутки.
Из немедикаментозных средств для лечения синдрома императивного мочеиспускания нашел применение метод обратной биологической связи (описанный выше). Возможно, положительный эффект данной процедуры в этом случае связан, с одной стороны, с укреплением сфинктеров мочевого пузыря и уретры, с другой — с улучшением кровообращения и устранением гипоксии в органах малого таза.
Смешанная форма недержания мочи — сочетание симптомов различной степени выраженности гиперактивного мочевого пузыря и стрессового недержания мочи. Взгляд урогинекологов на тактику ведения пациентов с данной патологией различен. Так, Д. Ю. Пушкарь (1996) рекомендует оперировать в случаях, когда анатомические изменения являются триггерным моментом в развитии императивного синдрома. L. D. Cordozo, S. L. Stanton (1998), T. R. Ostergard, A. E. Bent (1996) считают, что гиперактивность мочевого пузыря служит противопоказанием к оперативному лечению. В. Д. Петрова и С. В. Буянова (1996) придерживаются консервативно-выжидательной тактики. По данным наших исследований, наилучший результат получен при проведении консервативной терапии, направленной на устранение императивного компонента до операции (в течение 2—3 мес) и послеоперационном периоде. Подробная фармакотерапия и оперативное лечение описаны выше.
Таким образом, недержание мочи — мультифакторное заболевание, которое требует индивидуального подбора терапии, основанного на тщательном обследовании пациентки, с учетом возраста, типа и тяжести заболевания. Чаще всего предпочтение отдается комбинированной терапии.
Е. В. Тихомирова, кандидат медицинских наук
В. Е. Балан, доктор медицинских наук
Е. И. Ермакова, кандидат медицинских наук
НЦАГиП Росмедтехнологий, ММА им. И. М. Сеченова, Москва
Консервативная терапия недержания мочи у женщин
В настоящее время недержание мочи остается одной из самых актуальных и сложных проблем в современной урогинекологии. Согласно данным литературы, недержание мочи отмечают примерно 24% женщин
В настоящее время недержание мочи остается одной из самых актуальных и сложных проблем в современной урогинекологии. Согласно данным литературы, недержание мочи отмечают примерно 24% женщин от 30 до 60 лет и более 50% женщин после 60 лет [1, 4, 9]. По данным Д. Ю. Пушкаря только незначительная часть женщин, страдающих этим заболеванием, обращается за помощью к врачу [9]. Зачастую это связано не только с интимностью данной проблемы и нежеланием обсуждать ее в семье или во врачебном кабинете, но и с некомпетентностью гинекологов и урологов в данном вопросе, а также с общеизвестным ложным суждением о том, будто недержание мочи является «естественным» процессом старения.
Международным комитетом по недержанию мочи данное заболевание определяется как «непроизвольное выделение мочи, являющееся социальной или гигиенической проблемой, при наличии объективных проявлений неконтролируемого мочеиспускания». На сегодняшний день выделяют три основные формы заболевания: стрессовое недержание мочи, ургентное недержание мочи и смешанное (комбинированная форма) недержания мочи.
Ургентное недержание мочи характеризуется наличием императивных позывов к мочеиспусканию и связанных с ними непроизвольных потерь мочи. Важным отличительным признаком ургентного недержания мочи является интактность сфинктеров и нормальная резистентность уретры. Стрессовое недержание характеризуется непроизвольными потерями мочи, связанными с превышением внутрипузырного давления над максимальным уретральным в отсутствие сокращений детрузора. Термин «стрессовое недержание мочи» является общепризнанным, под стрессом же подразумеваются все факторы, приводящие к внезапному повышению внутрибрюшного давления: кашель, смех, чихание, подъем тяжестей, бег, переход из горизонтального положения в вертикальное и т. п.). Часто это состояние именуется недержанием мочи при напряжении (НМПН). Смешанное недержание мочи характеризуется сочетанием симптомов императивной (ургентной) и стрессовой инконтиненции.
Современные методы лечения недержания мочи подразделяются на консервативные и хирургические. Оперативное лечение в большей степени применимо к стрессовому недержанию мочи и направлено на укрепление мышечно-связочного аппарата тазового дна или на восстановление функции внутреннего сфинктера уретры. Однако любое хирургическое вмешательство несет определенную степень риска из-за возникновения ряда серьезных осложнений и нередко является вынужденной мерой, а не методом оптимального выбора.
Консервативное лечение включает в себя: 1) медикаментозную терапию; 2) тренировку мышц тазового дна с помощью метода обратной биологической связи; 3) физиолечение (электрическая стимуляция мышц тазового дна с помощью ректальных, влагалищных, уретральных датчиков) и др. Медикаментозная терапия носит в основном симптоматический характер, в той или иной степени снижая проявления заболевания, но не устраняя его причины. При этом терапевтический эффект зачастую бывает кратковременным и нестойким. При приеме лекарств имеется достаточно высокий риск возникновения побочных эффектов; кроме того, стоимость лекарств достаточно высока, особенно учитывая необходимость их длительного применения. Поэтому специалисты в области урологии и урогинекологии видят выход в применении методов, направленных на использование собственных резервно-компенсаторных возможностей человеческого организма [14].
Большое значение в лечении императивных нарушений мочеиспускания имеет правильный выбор селективного модулятора негормональных рецепторов мочеполового тракта, что возможно только на основании результатов комплексного уродинамического исследования. Для лечения императивных нарушений мочеиспускания используются следующие препараты:
Перечисленные препараты снижают тонус гладкой мускулатуры мочевого пузыря, оказывают расслабляющее действие на гладкую мускулатуру детрузора мочевого пузыря как за счет антихолинергического эффекта, так и вследствие прямого миотропного антиспастического влияния;
Вследствие этого достигаются существенные позитивные изменения функционального состояния нижнего отдела мочевого тракта в ответ на ограничение влияния симпатической нервной системы, что выражается в исчезновении поллакиурии и нормализации суточного профиля мочеиспускания. Кроме того, препараты этой группы улучшают кровоснабжение органов малого таза, прерывая патогенетическую цепь, связанную с развитием ишемии мочевого пузыря, в самом начале — на уровне адренорецепторов.
Предлагаемые препараты для лечения стрессового недержания мочи: a-адреномиметики — мидодрин (Гутрон); антихолиноэстеразные препараты — дистигмина бромид (Убретид) и ингибиторы обратного захвата серотонина и норадреналина — дулоксетин (Симбалта), как показали многочисленные исследования, малоэффективны и не лишены тяжелых побочных эффектов.
Именно к разряду таких методик и относится биологическая обратная связь (БОС), которая, с одной стороны, доступна и безопасна, с другой — патогенетически обоснованна и достаточно эффективна [6, 14]. В основу современной методики лечения недержания мочи с помощью приборов БОС положена система упражнений для мышц тазового дна, разработанная калифорнийским гинекологом Арнольдом Кегелем (1949) и направленная на повышение их тонуса и развитие сильного рефлекторного сокращения в ответ на внезапное повышение внутрибрюшного давления. Основная трудность и недостаток методики Кегеля заключается в том, что от 40 до 60% пациентов не способны изолированно сокращать мышцы тазового дна, особенно если учесть, что эти мышцы являются анатомически скрытыми. Вместо того, чтобы активизировать мышцы тазового дна, пациенты обычно сокращают мышцы-антагонисты — прямую мышцу живота, ягодичные, бедренные мышцы, еще больше повышая при этом внутрибрюшное давление. Очевидно, что такие упражнения оказываются не только неэффективными, но и способствуют усугублению недержания мочи [15]. Задача изолированной тренировки различных групп мышц тазового дна наиболее эффективно может быть решена при применении методов БОС, поскольку в данном случае наглядная информация доводится непосредственно до пациента, что позволяет легко контролировать правильность выполнения упражнений. Клинический смысл этого метода заключается, во-первых, в постоянном взаимодействии больной и врача и, во-вторых, в количественном определении изменений тонуса мышц тазового дна на фоне упражнений с помощью различных приспособлений: баллонов для измерения ректального и влагалищного давления, зондовых и игольчатых электромиографов [2]. В настоящее время для тренировки мышц тазового дна используются современные компьютерные установки, в которых специальные влагалищные или ректальные датчики улавливают изменения тонуса работающих мышц тазового дна, трансформируют их в ЭМГ-сигналы, которые затем усиливаются и отображаются на мониторе в виде графических изображений. При этом пациентка может наблюдать за правильностью и эффективностью своей работы.
В практике зарубежного здравоохранения метод БОС начал с успехом применяться в гастроэнтерологии и урогинекологии с 70-х гг. прошлого века [12]. Позднее были разработаны методики БОС для лечения глазных и нервных болезней, а также для реабилитации пациентов в ортопедической практике [5, 6, 7, 8, 10]. В настоящее время метод биологической обратной связи широко применяется как за рубежом, так и в России. Показаниями для применения БОС-терапии в урогинекологической практике являются: различные виды недержания мочи у взрослых и детей; синдром тазовой релаксации или синдром опущения стенок влагалища; сексуальные дисфункции у женщин (снижение силы оргазма, аноргазмия, вагинизм); профилактика недержания мочи у женщин в послеродовом периоде после патологических и травматических родов [11, 13].
Следует отметить, что одним из немаловажных преимуществ метода БОС является его безопасность. Данный вид терапии не имеет абсолютных противопоказаний. Относительные противопоказания связаны с двумя группами причин, которые в целом укладываются либо в физическую, либо в психологическую невозможность выполнения пациентом поставленной перед ним задачи.
К первой группе можно отнести следующие патологические состояния: заболевания, которые создают принципиальную невозможность достижения положительного эффекта в силу значительных анатомических изменений органов малого таза: злокачественные опухоли, выраженная инфравезикальная обструкция; местные инфекционно-воспалительные заболевания в стадии обострения, препятствующие применению ректальных и вагинальных датчиков: кольпиты, вульвовагиниты и т. д.; тяжелые сопутствующие заболевания в стадии декомпенсации, например сердечно-сосудистые (нестабильная стенокардия, острое нарушение мозгового кровообращения), тереотоксикоз, а также инфекционные (вследствие гипертермии) болезни и травмы.
Во вторую группу относительных противопоказаний можно включить: возраст моложе 4–5 лет, когда пациент не может осознать поставленную перед ним задачу из-за недостаточного развития умственных способностей; старческий возраст, сопровождающийся потерей интеллекта; психические заболевания; отсутствие мотивации и иждивенческая позиция больного, не желающего принимать участие в лечении [11, 14].
Цель исследования: оценить эффективность лечения различных видов недержания мочи у женщин с помощью метода БОС.
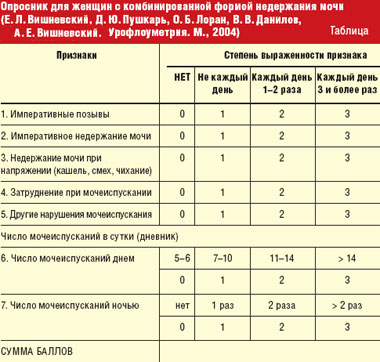
Материалы и методы. С ноября 2004 по май 2005 гг. в отделении гинекологической эндокринологии НЦАГиП РАМН с помощью метода БОС пролечено 65 пациенток, 18 из которых страдали стрессовым недержанием мочи, 25 — ургентным и 22 — комбинированной формой недержания мочи. Возраст пациенток колебался от 36 до 68 лет (средний возраст — 52 года). Перед началом БОС-терапии проводилось анкетирование, комплексное уродинамическое исследование (КУДИ), а также ультразвуковое исследование (УЗИ) с применением трехмерной реконструкции изображения. Пациентки всех трех групп заполняли специальный опросник для женщин с недержанием мочи для определения степени выраженности признака в баллах [3] (табл.).
По данным анкетирования пациентки 1-й группы со стрессовым недержанием мочи имели нормальное число мочеиспусканий в сутки (от 3 до 6). Число мочеиспусканий в сутки у женщин 2-й и 3-й групп до начала лечения колебалось от 9 до 22 раз (в среднем — 15,5), 17 пациенток (36,1%) из них отмечали эпизоды ургентного недержания мочи. По шкале определения степени выраженности симптоматики 9 пациенток из 1-й и 2-й групп (19,1%) имели оценку «14 баллов», 17 женщин (36,2%) — «12 баллов», 14 (29,8%) — «10 баллов» и 7 пациенток (14,9%) — «8 баллов». По результатам уродинамического исследования у женщин 1-й группы первоначально определялись: большой цистометрический объем (от 400 до 600 мл и более); выраженно сниженный тонус детрузора; снижение детрузорного давления и его низкий процентный вклад в пузырное давление во время мочеиспускания; снижение показателей максимального внутриуретрального давления (МВУД) на 30% и более; положительная кашлевая проба на объеме 100–400 мл. Показатели давления обратного сопротивления уретры (URP) колебались от 47 до 65 см. водн. ст., что в 2–2,5 раза меньше нормы. По данным трехмерной эхографии у 13 (72,2%) женщин наблюдались признаки сфинктерной недостаточности; у 12 (66,6%) женщин определялось цистоцеле I степени, у 2 (11,1%) — цистоцеле II степени с признаками гипермобильности уретры. У пациенток 2-й и 3-й групп по результатам КУДИ определялось снижение функционального и максимального цистометрического объемов, а у 27 (57,4%) женщин отмечались признаки нестабильности детрузора. Кроме того, у пациенток 3-й группы отмечались уродинамические признаки стрессового недержания мочи разной степени выраженности. По данным трехмерной эхографии у 41 женщины (87,2%) 2-й и 3-й групп определялось снижение объемных показателей парауретрального кровотока, что свидетельствовало о нарушении трофических процессов в этой области. У 17 пациенток (77,2%) 3-й группы были выявлены признаки сфинктерной недостаточности разной степени выраженности, у 6 (27,2%) — гипермобильность уретры.
Лечение методом БОС проводилось на отечественном аппарате «Амблиокор». Курс лечения состоит из 15 процедур (3 программы обучения). Занятия проводились каждый день или через день, средняя продолжительность каждого составила 30 мин. В основу упражнений, выполняемых пациентками на аппарате, легли тонические и фазовые произвольные сокращения мышц наружного сфинктера уретры (m. pubococcygeus, m. bulbokavernosus) и наружного анального сфинктера (m. levator ani). Под фазовыми понимают кратковременные (не более 1 сек) сокращения с максимальной силовой амплитудой (1-я программа обучения). При тонических сокращениях указанные мышцы необходимо удерживать в напряжении в течение более длительного времени — 15–30 сек (3-я программа). 2-я программа направлена на сочетание коротких фазовых и длительных тонических сокращений мышц тазового дна. 59 пациенток (92%) из всего числа пролеченных прошли два курса лечения на аппарате «Амблиокор» с интервалом в 2–3 мес. При этом к пациенткам предъявлялось настоятельное требование — продолжать тренировки во время перерыва в домашних условиях.
Результаты. Контрольные обследования, включавшие анкетирование, гинекологический осмотр, проведение кашлевого теста, УЗИ с трехмерной реконструкцией, а также комплексное уродинамическое исследование, выполнялись после проведения 2-го курса БОС-терапии. По результатам анкетирования 7 пациенток (38,9%) из 1-й группы после окончания лечения полностью удерживали мочу. Показатели уродинамических исследований также отражали положительную динамику: отмечалось повышение МВУД в среднем на 15%; давление закрытия уретры повышалось в среднем на 10%; показатели давления обратного сопротивления уретры (URP) увеличивались в среднем на 25%. Следует отметить, что данные пациентки первоначально имели легкую степень недержания мочи при напряжении. У 6 женщин (33,3%) из 1-й группы со средней и тяжелой формой заболевания наблюдалось значительное снижение частоты эпизодов недержания мочи, а также уменьшение количества выделяемой мочи при напряжении. И 5 пациенток (27,7%) с тяжелой степенью стресс-инконтиненции отмечали лишь незначительное улучшение. Немаловажным является тот факт, что возраст последних в среднем составлял 61,5 лет (от 57 до 66 лет). Пациенткам 1-й группы, неудовлетворенным результатами БОС-терапии, в дальнейшем было произведено хирургическое лечение (парауретральное введение геля «ДАМ+», TVT).
По данным анкетирования все пациентки 2-й группы имели положительную динамику. Частота мочеиспусканий в сутки после лечения колебалась от 6 до 10 раз. По шкале определения степени выраженности симптоматики 9 пациенток из 2-й группы (18%) имели оценку «2 балла», 10 женщин (40%) — «4 балла» и 6 (24%) — «6 баллов». По результатам уродинамических исследований у 21 пациентки (84%) определялось увеличение функционального и максимального объемов мочеиспускания; нестабильность детрузора не определялась ни у одной женщины; у 7 (28%) пациенток были выявлены подпороговые колебания детрузорного давления. УЗИ с трехмерной реконструкцией показало значительное повышение показателей линейного и объемного кровотока в парауретральных артериях.
В 3-й группе с комбинированной формой недержания мочи наиболее успешные результаты были получены у женщин с преобладающим императивным (ургентным) компонентом над стрессовым (стрессовое недержание отмечалось в легкой форме). Частота мочеиспусканий в 3-й группе после лечения колебалась от 5 до 9 раз в сутки. По шкале определения степени выраженности симптоматики 12 пациенток из 3-й группы (54,5%) имели оценку «2 балла», 8 женщин (36,4%) — «4 балла» и 2 женщины (9%) — «6 баллов». В результате комплексных уродинамических исследований, проведенных после БОС-терапии, у пациенток 3-й группы наблюдалось: увеличение функционального и максимального объемов мочеиспускания; у 6 (27,2%) женщин определялись подпороговые колебания детрузорного давления. У 12 (54,5%) пациенток 3-й группы после лечения признаков стрессового недержания мочи выявлено не было. УЗИ с трехмерной реконструкцией в 90% случаев показало значительное повышение показателей линейного и объемного кровотока в парауретральных артериях; у 9 пациенток отмечалось увеличение толщины рабдосфинктера (в среднем от 2 до 3,5 мм). 8 пациенткам 3-й группы с тяжелой степенью стрессового недержания мочи после нормализации суточного ритма мочеиспусканий (6–8 раз в сутки) в дальнейшем было произведено хирургическое лечение.
Выводы
На основании полученных результатов нами определены показания к применению БОС-терапии в урогинекологической практике: стрессовое недержание мочи легкой степени тяжести; стрессовое недержание мочи средней и высокой степеней тяжести как этап подготовки к оперативному лечению; стрессовое недержание мочи любой степени тяжести при невозможности выполнения хирургического вмешательства из-за сопутствующей экстрагенитальной патологии; императивные (ургентные) формы нарушения мочеиспускания; комбинированная форма недержания мочи.
Таким образом, метод биологической обратной связи является одним из эффективных консервативных методов лечения всех типов недержания мочи. Одним из положительных моментов данного вида терапии является его патогенетическая направленность. Эффект БОС заключается, с одной стороны, в возможности увеличения активности и сократительной способности произвольного уретрального сфинктера, а также в достижении его мышечной гипертрофии путем направленных сознательных тренировок; с другой стороны, как показали результаты трехмерной эхографии, — в улучшении кровообращения и трофических процессов в области малого таза. Кроме того, по данным ряда авторов [6, 12], произвольные сокращения наружного анального и наружного уретрального сфинктеров приводят к рефлекторному торможению сократительной активности детрузора, представляя так называемые анально-детрузорный и уретрально-детрузорный рефлексы, при этом становится понятной высокая эффективность БОС-терапии у больных с императивными нарушениями мочеиспускания. Другими важными преимуществами метода БОС являются: безболезненность и минимальная инвазивность; отсутствие побочных эффектов; возможность сочетания с любыми другими методами лечения (кроме электростимуляции); возможность использования любых других методов лечения в дальнейшем.
Литература
В. Е. Балан, доктор медицинских наук, профессор
Е. И. Ермакова, кандидат медицинских наук
Л. А. Ковалева
НЦАГиП Росмедтехнологий, Москва