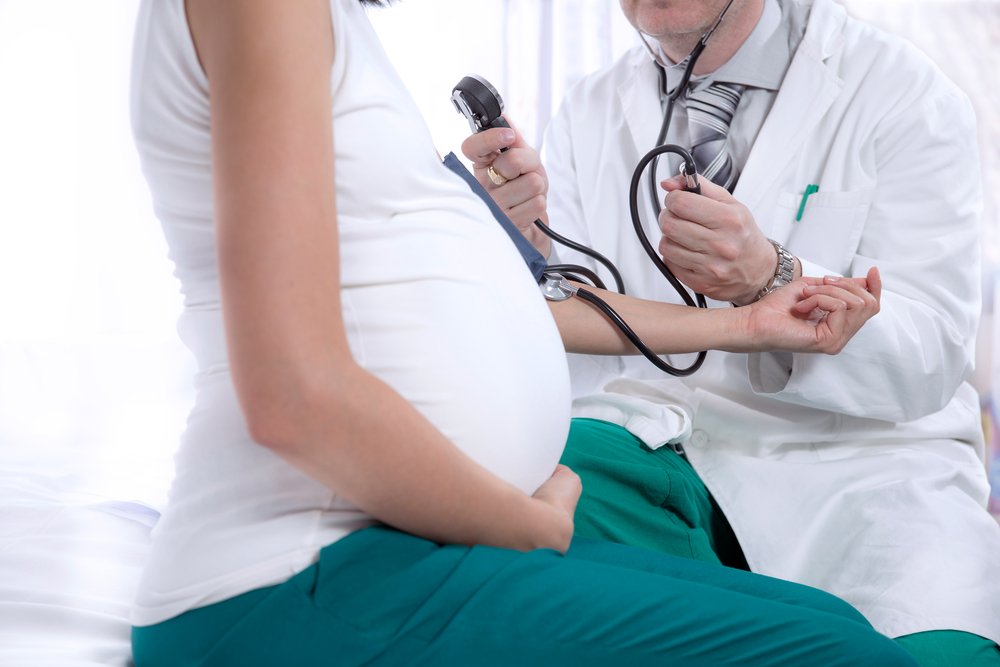
Чем лечить антифосфолипидный синдром во время беременности
Антифосфолипидный синдром и беременность
В 80% случаев антифосфолипидного синдрома (АФС) проявлением заболевания является акушерская патология (повторные эпизоды антенатальной гибели плода, привычное невынашивание беременности). Потеря плода наступает в любые сроки беременности, но несколько чаще во втором и третьем триместре. Для лечения беременных, страдающих антифосфолипидным синдромом, в Юсуповской больнице созданы все условия:
Выработка антител к фосфолипидам ассоциируется и с другими формами акушерской патологии: поздним гестозом, преэклампсией и эклампсией, преждевременными родами, задержкой внутриутробного развития плода. Часто неблагоприятные исходы регистрируются и при беременности, которая наступила на фоне тяжёлой патологии внутренних органов или сопровождается развитием специфических осложнений гестационного процесса.
В Юсуповской больнице ведение беременности при антифосфолипидном синдроме осуществляют ревматологи совместно с акушерами. При анализе взаимосвязи между акушерской патологией и наличием антифосфолипидного синдрома обязательно исключают факторы, которые могут быть потенциальной причиной предыдущих выкидышей:
Только исключив другую патологию, которая может вызвать акушерскую патологию, ревматологи устанавливают диагноз «антифосфолипидный синдром у беременной».
Типы антифосфолипидного синдрома
Ревматологи выделяют первичный и вторичный антифосфолипидный синдром. Наличие вторичного антифосфолипидного синдрома обусловлено аутоиммунными заболеваниями (системной красной волчанкой, узелковым периартериитом), онкологической патологией, воздействием ряда токсичных веществ и лекарственных препаратов. При первичном антифосфолипидном синдроме перечисленные заболевания и состояния отсутствуют.
Катастрофический антифосфолипидный синдром характеризуется внезапно возникающей и быстро развивающейся полиорганной недостаточностью. Он развивается в ответ на оперативные вмешательства или инфекционные заболевания. Катастрофический антифосфолипидный синдром проявляется следующими признаками:
У пациентов может развиться острая почечная и надпочечниковая недостаточность, тромбозов крупных сосудов.
Симптомы и осложнения антифосфолитического синдрома
Основным и наиболее опасным клиническим проявлением антифосфолитического синдрома являются рецидивирующие тромбозы. Чаще всего развиваются венозные тромбозы, которые локализуются в глубоких венах голеней. Это сопряжено с риском развития тромбоэмболии ветвей легочной артерии. Нередки случаи тромбозов вен печени и почек. Могут возникать тромботические поражения подключичной, воротной, нижней полой вен, сосудов головного мозга, вен и артерий сетчатки, различных отделов аорты, крупных сосудов нижних конечностей.
Различают следующие клинические проявления артериального тромбоза:
Опасность тромботических осложнений возрастает с течением беременности и в послеродовом периоде. Антифосфолипидный синдром приводит к неразвивающейся беременности, задержке внутриутробного роста плода, до его гибели плода во втором и третьем триместрах. В первом триместре беременности антифосфолипидные антитела оказывают прямое повреждающее воздействие на плодное яйцо. В последующем беременность прерывается спонтанно.
С ранних сроков беременности повышается функциональная активность тромбоцитов, снижаются гормональная и белковосинтезирующая функции плаценты. При отсутствии соответствующего лечения повышается активность свёртывающей системы крови. Возникают тромбозы в сосудах плаценты, развивается плацентарная недостаточность, хроническая гипоксия и плод может погибнуть вследствие недостатка кислорода.
Причины неблагоприятных исходов беременности при АФС
Неблагоприятные исходы беременности у женщин, страдающих антифосфолипидным синдромом, обусловлены многими факторами. Вследствие локальных тромбозов плаценты, которые возникают при нарушении антикоагулянтной активности трофобластического аннексина V (плацентарного антикоагулянтного протеина), нарушается плацентарное кровоснабжение. Антифосфолипидные антитела напрямую взаимодействуют с цитотрофобластом и синцитиотрофобластом. Цитотрофобласт состоит из интенсивно размножающихся клеток. Синцитиотрофобласт представляет собой высокоплоидную многоядерную структуру, которая образуется из клеток цитотрофобласта. Он служит источником плацентарного соматомаммотропина, хорионического гонадотропина и эстрогенов.
Антифосфолипидные антитела тормозят межклеточное слияние клеток трофобласта, ухудшают проникновение трофобласта и продукцию гормонов плацентой, приводят к дефектам имплантации. Они провоцируют не только самопроизвольные аборты на доэмбриональной и эмбриональной стадии, но также поздние фетальные потери и фетоплацентарную недостаточность. Антифосфолипидные антитела класса IgG, которые находящиеся в кровотоке матери после 15 недель беременности, так же свободно проникают в кровоток плода и оказывают на него прямое повреждающее действие.
Критерии антифосфолитического синдрома
Диагноз антифосфолитического синдрома считается достоверным при сочетании хотя бы одного клинического и, по меньшей мере, одного лабораторного признаков. К клиническим критериям относится сосудистый тромбоз. Ревматологи учитывают наличие в прошлом одного и более эпизодов тромбоза (венозного, артериального, тромбоза мелких сосудов). Тромбоз должен быть подтверждён при помощи инструментальных методов или морфологическими методами исследования. Следующим важным критерием антифосфолитического синдрома является патология беременности:
К лабораторным критериям антифосфолитического синдрома относится наличие антитела к кардиолипину класса IgG и IgM, которые определяются с помощью стандартизированного иммуноферментного метода, и наличие волчаночного антикоагулянта, определяемого стандартизированным методом. Положительные результаты лабораторных тестов должны быть зарегистрированы не менее двух раз с интервалом 6 недель.
Исходя из вышеприведенных критериев, у пациентки с повторяющимися венозными тромбозами, системной красной волчанкой, и двумя абортами на ранних сроках, с дважды положительными результатами определения антител к кардиолипину, антифосфолипидный синдром не вызывает сомнения. Совершенно неправомочен этот диагноз у молодой женщины с первой беременностью и с однократными положительными результатами определения антител к кардиолипину.
Ведение беременности при антифосфолипидном синдроме
В связи с высоким риском репродуктивных потерь на любом сроке гестации тактика ведения беременных с антифосфолипидным синдромом имеет особенности. Риск повторных самопроизвольных выкидышей на сроке до 20 недель беременности при обнаружении в крови беременной женщины антифосфолипидных антигенов варьирует от 53 до 77%. Риск внезапной внутриутробной гибели плода во втором и третьем триместрах находится в диапазоне 22 –46%.
Только в 8-10% случаев беременность на фоне антифосфолипидного синдрома заканчивается рождением живого ребёнка. На фоне лечения препаратами ацетилсалициловой кислоты или гепарина почти все женщины рожают живых малышей. В связи с высоким риском неблагоприятных акушерских исходов при антифосфолипидном синдроме врачи планируют беременности у данных пациенток, тщательного подбирают медикаментозную терапию, осуществляют постоянный контроль состояния матери и плода.
На этапе планирования беременности у пациентки исключают сопутствующие факторы риска развития тромбозов. Спектр профилактических мероприятий следующий:
Врачи рекомендуют женщинам отказаться от курения и использовать компрессионный трикотаж при посттромбофлебитическом синдроме. Пациенткам с вторичным антифосфолипидным синдромом ревматологи Юсуповской больницы проводят коррекцию основного заболевания и индивидуально подбирают препараты для безопасного медикаментозного лечения. Во время беременности не проводят терапию цитостатиками, так как они вызывают аномалии развития плода. Варфарин, который применяют для антикоагулянтной терапии у пациентов с антифосфолитическим синдромом, в связи с возможностью развития кумариновой эмбриопатии при беременности не назначают. Ели наступила незапланированная желанная беременность на фоне приёма варфарина, препарат как можно раньше отменяют, желательно до шестой недели гестации.
Беременным с антифосфолипидным синдромом с момента зачатия и до момента родов назначают низкие дозы ацетилсалициловой кислоты и низкомолекулярные гепарины. Их отменяют за 12-24 часа до родоразрешения. Лечение гепаринами возобновляют спустя 12 часов после родов на срок не менее четырёх недель.
Если у пациентки во время данной беременности возникали тромбозы, то на фоне инъекций низкомолекулярного гепарина индивидуально подбирают дозы варфарина. При неэффективности стандартной схемы лечения применяют внутривенный иммуноглобулин. Лечение больных с акушерской патологией глюкокортикоидами не проводят в связи с отсутствием данных о преимуществах такого вида терапии, а также по причине большой частоты побочных эффектов у матери и плода.
Для того чтобы установить точный диагноз, спланировать беременность записывайтесь на приём к ревматологу по телефону контакт центра. Врачи назначат лечение основного и сопутствующих заболеваний, подберут лекарственные средства, безопасные беременным. При правильном ведении беременности у пациенток, страдающих антифосфолипидным синдромом, вероятность рождения в срок здорового ребёнка возрастает до 100%.
Антифосфолипидный синдром и его значение при беременности
Физические свойства крови важны для адекватного кровоснабжения. При состояниях, сопровождающихся повышенной вязкостью крови, создаются предпосылки для тромбообразования.
Особое значение такие состояния имеют при лечении и профилактике сердечно-сосудистых заболеваний, болезнях крови, заболеваниях центральной нервной системы и др. Беременность также требует контроля процессов свёртывания крови. Однако, при антифосфолипидном синдроме контроля недостаточно. Без активного лечения этой патологии во время беременности возможны различные нарушения, которые могут привести к гипоксии и смерти плода.
Что такое антифосфолипидный синдром
Механизм развития АФС синдрома
АФС синдром часто сопровождает другие аутоиммунные заболевания, такие, как системная красная волчанка.
Симптомы АФС синдрома
Классические проявления АФС синдрома:
Акушерские патологии, связанные с АФС синдромом
АФС синдром, кроме акушерской патологии, может быть причиной повторяющихся инсультов, инфарктов.
Диагностика АФС синдрома
Обследование на АФС синдром включает в себя:
Лечение АФС
Во время беременности варфарин противопоказан, из-за его способности вызывать врождённые патологии плода. У беременных основными препаратами являются гепарин и его производные (фраксипарин, клексан и др), а также в низких дозах аспирин.
Для профилактики спонтанного аборта на ранних сроках рекомендуется немедленно начать применение аспирина и гепарина при задержке менструаций.
Несмотря на лечение, у 29% больных в течение жизни случаются тромботические явления и их осложнения.
Антифосфолипидный синдром при беременности
Антифосфолипидный синдром (АФС) является аутоиммунной патологией, патогенез которой обусловлен образованием антител к фосфолипидам – основным образующим компонентам клеточных мембран. Клиническое состояние проявляется артериальной гипертензией, тромбозами, сердечной недостаточностью. Антифосфолипидный синдром затрудняет зачатие, а при наступлении беременности угрожает серьезными осложнениями для женщины и плода.
Прием акушера-гинеколога (врач высшей категории) 2 500 руб.
Прием врача-гемостазиолога 2 600 руб.
Актуальность проблемы АФС в акушерстве связана с высокими рисками невынашивания, летальностью при гестозе и преэклампсии у беременных на поздних сроках, тяжелыми пороками развития у новорожденных.
Причины патологии
Причины, достоверно приводящие к развитию АФС, на сегодняшний день до конца не изучены, однако точно определены предрасполагающие факторы:
В группе риска лица, перенесшие системную красную волчанку, имеющие в анамнезе ревматоидный артрит, узелковый периартериит, тромбоцитопеническую пурпуру аутоиммунного характера. Иммунологические механизмы формирования синдрома требуют дальнейших исследований.
Классификация заболевания
Выделяют следующие формы АФС, которые различаются по этиологическим факторам и клиническому течению:
АФС может быть обусловлен и другими микроангиопатическими синдромами (волчаночный, гемолитико-уремический синдром).
АФС при беременности
Антифосфолипидный синдром при беременности требует регулярного наблюдения женщины амбулаторно или в госпитальных условиях. АФС в большинстве случаев имеет трагические последствия не только для плода (иногда новорожденного), но и для женщины. Влияние АФС на беременность обусловлено активизацией следующих патологических механизмов:
Антифосфолипидные антитела нарушают имплантационный процесс и свойства эмбриональных клеточных структур. В связи с этим глубина проникновения трофобласта (клеток эмбриона) в эндометрий матки снижается, создаются предпосылки к формированию процесса тромбообразования.
Антитела при синдроме АФС могут сами по себе стать причиной низкого уровня гормона беременности, что становится причиной выкидыша, замершей беременности. В связи с запуском патогенных механизмов наблюдаются такие осложнения, как внутриутробная задержка развития плода и его гибель в более поздний гестационный период, гестоз и преэклампсия, синдром потери плода.
Клинические проявления и осложнения
Заподозрить синдром АФС можно по данным клинико-лабораторных исследований, при невозможности зачатия или самопроизвольном прерывании беременности при ее наступлении. Женщины жалуются на боли в органах малого таза неясной природы, недомогание, выраженность венозно-сосудистого рисунка нижних конечностей.
Учитывая различные теории развития аутоиммунной патологии, симптомы тоже отличаются многообразием. Несмотря на это, антифосфолипидный синдром осложняет наступление и течение беременности, угрожает жизни и здоровью женщины и плода. Выделяют следующие осложнения:
Женщинам с АФС синдромом показано тщательное планирование беременности, пожизненная поддерживающая медикаментозная терапия с коррекцией доз при подготовке и на протяжении всей гестации, продолжение курса лечения после родов.
Подготовка к беременности
Основная цель подготовительных мероприятий – создание благоприятных условий для имплантации эмбриона, снижение рисков невынашивания, внутриутробных патологий и гибели плода. При подготовке оценивают свертывающую способность крови, уровень антифосфолипидных антител и волчаночного антикоагулянта. Обязательно проводят устранение инфекций при их наличии.
Схема лечения антифосфолипидного синдрома при беременности на подготовительном этапе:
Дозировку гепарина и антиагрегантов корректируют до стабилизации показателей анализов крови.
Тактика ведения беременности
Применение гепарина и аспиринсодержащих препаратов продолжают, дозировку корректируют на основании данных лабораторных исследований. Курс лечения дополняют профилактическими дозами иммуноглобулинов. Пациентка нуждается в приеме витамина Д и препаратов кальция для предупреждения развития остеопороза.
Аспирин прекращают принимать на 36-37 неделе беременности, прием низкомолекулярного гепарина продолжают до доношенных сроков, но есть и индивидуальные схемы лечения. При необходимости кесарева сечения прием гепарина прекращают за 24 часа до родов. Если женщина принимала гепаринсодержащие препараты до самых родов, то недопустимо введение эпидуральной анестезии.
После родоразрешения
После родов схему лечения, назначенную во время беременности, продолжают в течение 2-3 месяцев. Прием препаратов возобновляют спустя 5-10 часов после родов при отсутствии кровотечений. Женщинам показан охранительный режим, однако рекомендуется раньше вставать, больше двигаться, носить компрессионный трикотаж для профилактики тромбоза.
При своевременной диагностике и профилактической терапии прогноз жизни при АФС у женщин, в том числе в период беременности, благоприятный. Среди факторов, ухудшающих прогноз, выделяют течение антифосфолипидного синдрома с системной красной волчанкой, стойкой гипертонией, тромбоцитопенией.
В нашей Международной клинике Гемостаза, расположенной в Москве вы найдете опытных специалистов, одних из ведущих в мире по данной проблеме, которые помогут разобраться в причинах вашего заболевания и назначат грамотное лечение синдрома. Записывайтесь на прием при помощи онлайн-формы на сайте или по номеру: +7 (495) 106-91-83.
Антифосфолипидный синдром
Было несколько выкидышей? Во время прошлой беременности диагностировали тяжелую форму преэклампсии? В прошлом развивался артериальный или венозный тромбоз? Чтобы повысить шансы на успешное вынашивание беременности, необходимо исключить АФС.
Что такое АФС?
АФС – аутоиммунное состояние, когда антитела к фосфолипидным комплексам, присутствующим в самых разных органах человека, начинают атаковать ткани собственного организма, поскольку воспринимают их как чужеродные и, как следствие, пытаются противостоять мнимой угрозе.
Несмотря на то что теоретически пострадать может любая система, чаще всего АФС становится причиной тромбозов (как артериальных, так и венозных), в результате чего развиваются такие опасные патологии, как тромбоэмболия, инсульт и инфаркт. Кроме того, синдром провоцирует серьезные осложнения во время беременности.
Сразу следует отметить, что сама по себе продукция антител к фосфолипидам не может стать причиной тромбоза. Необходимо некое событие, которое станет фактором, запускающим активацию иммунных сил организма. Что это может быть? Например, беременность, травма и стрессовое состояние.
Виды АФС
Антифосфолипидный синдром подразделяется на первичный и вторичный. Клинические проявления у обеих форм одинаковые – это тромбозы различной локализации, невынашивание беременности, акушерские осложнения (задержка роста плода, преэклампсия, отслойка плаценты). Разница лишь в наличии или отсутствии фонового заболевания, которое могло стать причиной появления АФС.
Возникает у пациентов без сопутствующей аутоиммунной патологии, онкологических, инфекционных процессов. Другими словами, нет никакой явной причины для выработки антифосфолипидных антител.
«Наслаивается» на уже имеющуюся у пациента сопутствующую патологию:
Критерии антифосфолипидного синдрома
Чтобы поставить диагноз «Определенный антифосфолипидный синдром», необходимо присутствие одновременно хотя бы одного клинического и одного лабораторного критерия:
1. Клинические критерии:
2. Лабораторные критерии:
Важно: лабораторный критерий считается соблюденным, если выявлены позитивные антитела как минимум дважды с интервалом не менее 12 недель между анализами, но не более 5 лет.
Кроме того, диагноз АФС не считается подтвержденным, если между клиническими проявлениями (тромбоз или потеря беременности) и положительным лабораторным тестом прошло более 5 лет.
Вероятный антифосфолипидный синдром
Если у пациента присутствуют антифосфолипидные антитела, но в совокупности критерии определенного АФС не соблюдены, может быть сформулирован диагноз «вероятный АФС». Это бывает, например, при одной или двух потерях плода на сроке до 10 недель и наличии антифосфолипидных антител; при непоследовательных потерях плода (выкидыш, потом роды, потом еще два выкидыша), или если, к примеру, беременность осложнилась преэклампсией или отслойкой плаценты, но роды произошли позднее 34 недели, и так далее.
Также диагноз «вероятный АФС» может быть установлен при неполном соблюдении лабораторных критериев: титр антител не достигает необходимых 40 Ед/мл, или же положительные тесты на антитела выполнены с интервалом менее 12 недель, и так далее.
Симптомы антифосфолипидного симптома
Обеспокоенность врача могут вызвать такие эпизоды в прошлом пациентки, как:
Также в группе риска находятся женщины, у которых в прошлом развивались венозные или артериальные тромбозы во время беременности, на фоне приема оральных контрацептивов или после рождения ребенка.
Диагностика антифосфолипидного синдрома
На консультации гемостазиолога специалист назначает пациентке анализ крови на АФС, позволяющий обнаружить специфические антитела и определить их титр (количество). Дополнительно врач ориентируется на такие проявления синдрома, как выкидыши и преждевременные роды, тромбозы, а также другие критерии.
АФС во время беременности
Чтобы предотвратить развитие опасных осложнений, врач назначает лечение с самого начала беременности.
Если имеются соответствующие показания, специалист может назначить антикоагулянты (препараты, которые уменьшают вязкость крови) и антиагреганты (вещества, которые препятствуют склеиванию эритроцитов и тромбоцитов).
Дополнительно рекомендуется прием витаминов группы B (в том числе фолиевой кислоты) и магния.
Если беременная женщина страдает АФС, у нее развивается прогестероновая недостаточность, поэтому с самого начала беременности врач назначает препараты прогестерона.
Ведение беременности должно осуществляться под контролем опытного врача-гемостазиолога. Необходимо тщательное наблюдение за состоянием будущей мамы и малыша, а также коррекция дозировки препаратов на основании результатов исследований. При отсутствии адекватного лечения вероятность успешного исхода беременности очень мала. Если терапию начали проводить своевременно, шансы заметно возрастают.
Лечение и профилактика АФС
Рассуждая о возможности профилактики антифосфолипидного синдрома, мы вынуждены признать, что предотвратить (в буквальном смысле) его появление невозможно. Нарушения в иммунной системе могут возникать как спонтанно, непредсказуемо, так и после воздействия провоцирующих факторов (хроническое заболевание, инфекция, прием гормональных препаратов). Поэтому работа с пациентами, имеющими антифосфолипидный синдром, сводится к лечению и профилактике тромбозов, а также предупреждению осложнений беременности.
Важно: следует понимать, что никакие современные методы лечения не преследуют цель полностью устранить антифосфолипидные антитела из крови. Процесс их выработки стихийный. Количество антител в крови может спонтанно меняться с течением времени: повышаться или понижаться, вплоть до полного исчезновения, либо появляться вновь после долго отсутствия. Динамика уровня антител мало зависит от применяемых методов лечения.
Цель назначения лекарственных препаратов – предупредить осложнения, вызываемые присутствием патогенных антител в крови. Другими словами, зная о наличии антифосфолипидных антител, мы предпринимаем меры для того, чтобы из воздействие на организм не привело к макро- и микротромбозам.
1. Антикоагулянтная и антиагрегантная терапия.
Пациенты, у которых не было тромботических осложнений в прошлом и нет беременности в настоящее время, никакие разжижающие препараты принимать не должны.
Антикоагулянты и дезагреганты (препараты, снижающие активность свертывающей системы крови) назначаются в следующих ситуациях:
2. Противомалярийные средства
В ряде случаев пациенткам с невынашиванием беременности или акушерскими осложнениями в анамнезе дополнительно назначаются препараты, относящиеся к группе противомалярийных. Они имеют свойство снижать агрессивность антифосфолипидных антител даже при очень высоком их титре в крови. Такие препараты не используются рутинно, но могут быть полезны в случаях, когда назначение только лишь антикоагулянтов и антиагрегантов оказалось неэффективным.
3. Иные методы лечения
В индивидуальном порядке, в комплексе с вышеописанными методами лечения антифосфолипидного синдрома, врач может назначать такие процедуры, как проведение гирудотерапии (например, перед вступлением в протокол ЭКО или при планировании естественной беременности), плазмаферез, курсы введения человеческого иммуноглобулина. Данные методы лечения не доказали свою эффективность в клинических исследованиях, однако могут быть использованы в некоторых ситуациях по усмотрению лечащего врача.
Антифосфолипидный синдром
Общая информация
Краткое описание
Общероссийская общественная организация Ассоциация ревматологов России
Федеральные клинические рекомендации по лечению Антифосфолипидного синдрома
Рекомендации по лечению антифосфолипидного синдрома
Решетняк Т.М.
Код МКБ 10
Д68.8 ( в разделе другие нарушения свертывания крови; коагуляционные дефекты, связанные с наличием «волчаночных антикоагулянтов» О00.0 спонтанные при патологической беременности)
Диагностика
Диагностические критерии
Таблица 1. Диагностические критерии АФС [2]
| Клинические критерии: 1. Сосудистый тромбоз Один или более клинических эпизодов артериального, венозного или тромбоз мелких сосудов в любой ткани или органе. Тромбоз должен быть подтвержден воспроизведением изображения или допплеровским исследованием или морфологически, за исключением поверхностных венозных тромбозов. Морфологическое подтверждение должно быть представлено без наличия значительного воспаления сосудистой стенки. 2. Патология беременности а) один или более случаев внутриутробной гибели морфологически нормального плода после 10 недель гестации (нормальные морфологические признаки плода документированы на УЗИ или непосредственным осмотром плода) или б) один или более случаев преждевременных родов морфологически нормального плода до 34 недель гестации из-за выраженной преэклампсии или эклампсии, или выраженной плацентарной недостаточности или в) три или более последовательных случаев спонтанных абортов до 10 недель гестации ( исключение – анатомические дефекты матки, гормональные нарушения, материнские или отцовские хромосомные нарушения) Лабораторные критерии 1. Антитела к кардиолипину IgG или IgM изотипов, выявляемые в сыворотке в средних или высоких титрах, по крайней мере, 2 раза в течение 12 нед, с помощью стандартизованного иммуноферментного метода. 2. Антитела к b2-гликопротеину I IgG и/или IgM изотип, выявляемые в сыворотке в средних или высоких титрах, по крайней мере, 2 раза в течении 12 нед, с помощью стандартизованного иммуноферментного метода. 3. Волчаночный антикоагулянт в плазме, в двух или более случаях исследования с промежутком не менее 12 недель, определяемый согласно рекомендациям Международного Общества Тромбозов и Гемостаза (исследовательская группа по ВА/фосфолипид-зависимым антителам) а) удлинение времени свертывания плазмы в фосфолипид-зависимых коагулогических тестах: АПТВ, КВС, протромбиновое время, тесты с ядами Рассела, текстариновое время б) отсутствие коррекции удлинения времени свертывания скрининговых тестов в тестах смешивания с донорской плазмой в) укорочение или коррекция удлинения времени свертывания скрининговых тестов при добавлении фосфолипидов д) исключение других коагулопатий, как, например ингибитора VIII фактора свертывания крови или гепарина (удлиняющих фосфолипид-зависимые тесты свертывания крови) |
Определённый профиль аФЛ может быть идентифицирован как высокий или низкий риск для последующих тромбозов
Таблица 2. Высокий и низкий риск наличия различных аФЛ для последующих тромбозов [3]
| Высокий риск Позитивность по волчаночному антикоагулянту (ВА) Позитивность трёх типов антифосфолипидных антител (ВА + антител к кардиолипину (аКЛ) + анти-β2- гликопротеина1 антитела (а- β2-ГП1) Изолированная постоянная позитивность по аКЛ в высоких и средних уровнях a |
| Низкий риск Изолированное периодически повышение каждого из аФЛ в средних и низких уровнях |
a Исследовано только для системной красной волчанки (СКВ)
Рекомендации градуированы согласно системе Американской Коллегии торакальных врачей (American College of Chest Phisicians (ACCP) [6]: сила рекомендаций исходит из соотношения риск/преимущества: класс 1: «сильная» рекомендация = «мы рекомендуем»; класс 2 «слабая» рекомендация = «мы советуем». Качество доказательств градуируется : научные доказательства высокого качества =А; среднего качества =В; низкого или очень низкого качества = С, таким образом имеется 6 возможных классов рекомендаций: 1А ; 1В; 1С; 2А; 2В;2С.
Дифференциальный диагноз
Дифференциальный диагноз АФС зависит от имеющихся клинических проявлений. Имеется ряд генетически детерминированных и приобретенных заболеваний, которые приводят к рецидивирующей потере беременности, тромбоэмболическим осложнениям или одновременно к тем и другим (табл. 3).
Таблица 3. Дифференциальная диагностика антифосфолипидного синдрома
| Заболевания | Клинические проявления |
| Системные васкулиты | |
| Узелковый полиартериит | СЛ, дистальная гангрена конечностей, язвы кожи, некрозы кожи, поражение ЦНС, почек |
| Облитерирующий тромбоангиит (болезнь Бюргера–Винивартера) | Рецидивирующий мигрирующий флебит, дистальная гангрена конечностей, язвы кожи, некроз кожи, инфаркт миокарда, тромбоз сосудов брыжейки, поражение ЦНС |
| Геморрагический васкулит | Геморрагические высыпания на коже, язвы и некроз кожи, поражение почек |
| Височный артериит (болезнь Хортона) | Тромбоз артерий сетчатки, головные боли |
| Неспецифический аортоартериит (болезнь Такаясу) | Синдром дуги аорты, поражение клапанов сердца |
| ТТП (болезнь Мошковица) | Рецидивирующие тромбозы сосудов различного калибра, тромбоцитопения, гемолитическая аутоиммунная анемия |
| Гемолитико-уремический синдром | Рецидивирующие тромбозы сосудов различного калибра, поражение почек, гемолитическая анемия, геморрагии |
| Кожный васкулит | Язвы и некрозы кожи, ливедо-васкулит |
| Ревматические заболевания | |
| Острая ревматическая лихорадка | Формирование пороков сердца, тромбозы сосудов различной локализации (чаще ЦНС и конечностей) по механизму кардиогенной тромбоэмболии |
| СКВ | Тромбозы, гематологические нарушения, ливедо |
| Склеродермия | Ливедо, дистальная гангрена конечностей, язвы кожи |
| Тромбофилии | |
| Наследственные (в результате мутаций свертывающих факторов, плазменных антикоагулянтов) | Рецидивирующие тромбозы сосудов различного калибра и локализации, кожные язвы |
| ДВС-синдром | Тромбоэмболические осложнения, тромбоцитопения, кожные язвы |
| Инфекционные заболевания | |
| Туберкулез, вирусные гепатиты и др. | Тромбоэмболии, поперечный миелит, ливедо |
Дифференциальный диагноз с тромбоэмболическими заболеваниями зависит от вовлеченного сосудистого ложа (венозного, артериального или обоих).
При венозных окклюзиях, если определяется только венозный тромбоз или ТЭЛА, в круг дифференциального диагноза включают:
· приобретенные и генетические тромбофилии;
· дефекты фибринолиза;
· неопластические и миелопролиферативные заболевания;
· нефротический синдром.
Лица с венозными тромбозами моложе 45 лет с наличием родственников I степени родства с тромбозами в молодом возрасте должны исследоваться на генетическе тромбофилии. На сегодня ясно, что исследование аФЛ следует проводить при некоторых эндокринных заболеваниях: болезни Аддисона и гипопитуитаризме (синдроме Шихена). Хотя указание на венозный тромбоз является показателем тромбофилического статуса, в то же время некоторые сопутствующие клинические проявления могут быть признаком системного заболевания с более высоким риском венозного тромбоза. Например, указание в анамнезе на болезненные язвы слизистых во рту и гениталиях у молодых пациентов с венозными тромбозами должно наводить на диагноз болезни Бехчета, при которой подобно АФС поражаются сосуды любого калибра.
При выявлении тромбоза только артериального русла исключаются следующие заболевания:
· атеросклероз;
· эмболии (при мерцательной аритмии, миксоме предсердия, эндокардите, холестероловые эмболы), инфаркт миокарда с тромбозом желудочков сердца;
· декомпрессионные состояния (Кессонова болезнь);
· ТТП/гемолитико-уремический синдром.
Особого внимания требуют молодые пациенты с инсультами, у которых более чем в 18% случаев выявляются аФЛ в крови (Калашникова Л.А.). Некоторые аФЛ-позитивные больные могут иметь клинические проявления, сходные с рассеянным склерозом, которые являются следствием множественных церебральных инфарктов, подтвержденных методами нейровизуализации (МРТ). Подобный тип повреждения ЦНС отмечается при рассеянном склерозе и церебральной аутосомно-доминирующей артериопатии с подкорковыми инфарктами и лейкоэнцефалопатией. Этих пациентов необходимо тщательно расспрашивать о наличии в семьях родственников с инсультами и деменцией в молодом возрасте. При исследовании аутопсий подобных случаев находят множественные глубокие мелкие инфаркты мозга и диффузную лейкоэнцефалопатию. Данный генетический дефект сцеплен с 19-й хромосомой.
При сочетанных тромбозах (артериального и венозного) в круг дифференциального диагноза включаются:
· нарушения в системе фибринолиза (дисфибриногенемия или дефицит активатора плазминогена);
· гомоцистеинемия;
· миелопролиферативные заболевания, полицитемия;
· парадоксальная ночная гемоглобинурия;
· гипервязкость крови, например, при макроглобулинемии Вальдстрема, серповидноклеточная болезнь и т.д.;
· васкулиты;
· парадоксальный эмболизм.
При сочетании рецидивирующих окклюзий микроциркуляторного русла с тромбоцитопенией дифференциальный диагноз проводится между тромботическими микроангиопатиями (табл. 4).
Таблица 4. Основные клинические и лабораторные признаки, связанные с тромбоцитопенией при антифосфолипидном синдроме и тромботическими микроангиопатиями
Примечание: АФС — антифосфолипидный синдром, КАФС — катастрофический АФС, ТТП — тромботическая тромбоцитопеническая пурпура, ДВС — диссеминированное внутрисосудистое свертывание, АЧТВ — активированное частичное тромбопластиновое время, ПДФ — продукты деградации фибриногена, АНФ — антинуклеарный фактор, аФЛ — антифосфолипидные антитела.
*отрицательный тест смешивания (при определении волчаночного антикоагулянта).
# позитивный тест смешивания (при определении волчаночного антикоагулянта).
≠ ТТП может быть ассоциирована с СКВ.
§ ДВС может быть ассоциирован с КАФС.
Дифференциальный диагноз между АФС и тромботическими ангиопатиями часто сложен. Необходимо учитывать, что незначительная тромбоцитопения при АФС может быть связана с активацией тромбоцитов и их потреблением; многие клинические и лабораторные проявления могут быть общими для СКВ и ТТП. ТТП может развиться у больных СКВ и, наоборот, аФЛ могут быть при ТТП, гемолитико-уремическом синдроме и HELLP-синдроме, а ДВС отмечается при КАФС. Исследование аФЛ как скрининговых тестов показано пациентам с тромбоцитопенией неясного генеза, особенно беременным с тромбоцитопенией, когда риск развития геморрагий из-за тромбоцитопении и риск тромбоза из-за аФЛ ухудшает исход, как у плода, так и у матери.
Кожные проявления, среди которых наиболее частое ливедо, может иметь место при различных ревматических заболеваниях. Более того, кожные некрозы, кожные язвы, изменение окраски кожи от бледности до покраснения требует исключения и системных васкулитов, а также вторичных васкулитов на фоне инфекций. Гангренозная пиодермия также часто является кожным проявлением системных ревматических заболеваний, но имеются сообщения случаев.
Патология клапанов сердца требует исключения инфекционного эндокардита, хронической ревматической лихорадки. В таблице 5 и 6 приведены признаки, встречающиеся при этих патологиях. Как видно, имеется ряд схожих признаков. Ревматическая лихорадка (РЛ) и АФС — два заболевания со сходной клинической картиной. Пусковым фактором в обеих патологиях является инфекция. При РЛ доказан инфекционный агент — b-гемолитический стрептококк группы Streptococcus pyogenes. Молекулярная мимикрия между микробом и молекулами ткани сердца объясняет этиологию заболевания РЛ, подобные механизмы имеют место и при АФС. Сроки развития заболевания после инфекции при РЛ и АФС разные. РЛ индуцируется в первые три недели после инфекции, имеется четкая связь с перенесенной стрептококковой инфекцией, тогда как при АФС большинство случаев развивается по механизму «удар и пробег», т.е. развитие заболевание отсрочено во времени. Характер поражения клапанов сердца также различен. При АФС стенозы клапанов развиваются редко и, в отличие от ревматического стеноза, у этих больных, по нашим данным, не отмечалось спаяния комиссур, сужение отверстия обусловливалось большими тромбоэндокардиальными наложениями и деформацией створок.
Таблица 5. Дифференциальный диагноз поражения клапанов сердца при антифосфолипидном синдроме, ревматической лихорадке и инфекционном эндокардите
| Признаки | АФС | Ревматическая лихорадка | Инфекционный эндокардит |
| Лихорадка | +/– | +/– | + |
| Лейкоцитоз | – | – | + |
| СРБ | – | – | + |
| Посев крови | – | – | + |
| аФЛ | + | – | – |
| Эхо-КГ | Диффузное утолщение или локальное средней части створки или основания ее | Ограниченное утолщение клапана с вовлечением верхней части, утолщение хорды и слияние, кальцификация клапана | Ограниченные наложения на предсердной поверхности или аортальной, или предсердно-желудочковой с разрывом клапана |
| Признаки | ОРЛ | АФС |
| Деформация клапанов сердца | + | + |
| Гистология | Ашоф-Талаевские гранулемы | Фиброз (коллаген IV) |
| Лечение | Протезирование клапана | Протезирование клапана |
| Поражение ЦНС (хорея) | + | + |
| Инфекция | + Streptococcus pyogenes | + Streptococcus pyogenes и др. |
| Молекулярная мимикрия | + | + |
| Инфильтрация тканей лимфоцитами | +, включая Т, реагирующие с М-протеином клетки | +, включая Т, реагирующие с b2 ГП1 |
| HLA | DR7+, DR53, DRB1*04, DQA1*03 | DRB4*0103(DR53), DM*0102 |
| Депозиты комплемента | + | + |
| Экспрессия молекул адгезии | VCAM-I | a1-интегрин |
| Антитела | M-протеину и миозину, GlcNA, ламинину, b2 ГП1 | b2 ГП1 к кардиолипину и протромбину, аннексину-V, М-протеину |
Акушерская патология АФС также требует лабораторного подтверждения и исключения других причин потери беременности. Это и генетические тромбофилии, и воспалительная патология половых органов. АФЛ могут выявляться при инфекционных заболеваниях в низких или средних позитивных уровнях, а для исключения связи с инфекцией необходимы повторные исследования аФЛ через 12 недель.
В заключение следует подчеркнуть, что АФС — это антителоиндуцированный тромбоз, основой диагноза которого наряду с клиническими проявлениями является обязательное наличие серологических маркеров. Акушерскую патологию при АФС следует рассматривать как тромботическое осложнение. Однократное исследование аФЛ не позволяет верифицировать или исключить АФС.
Лечение
Рекомендации по ведению больных АФС с тромбозом
2. Рекомендовано больным с определённым АФС и первым венозным тромбозом назначение антагонистов витамина К (АВК) с целевым значением международного нормализованного отношения (МНО) в пределах 2,0-3,0 (уровень доказательства 1В)
Комментарии. В двух клинических исследованиях [9,10] было показано, что высоко-интенсивный уровень (МНО>3,0) гипокоагуляции не превосходит стандартный уровень (МНО 2,0-3,0) в профилактике рецидива тромбоза и ассоциировался с более частыми геморрагическими осложнениями. В одной из работ [11] по сравнению двух режимов высоко-интенсивного и стандартного, было показано что высокая интенсивность гипокоагуляции ассоциировалась с высокой частотой кровотечений, но и парадоксально с более частыми тромбоэмболическими осложнениями, что видимо, связано с частой флюктуацией МНО.
4. Оценка риска кровотечения у больного должна быть выполнена до назначения высокой степени гипокоагуляции или комбинирования антикоагулянтов и антиагрегантов (Уровень доказательства не градуирован)
5. Пациенты без СКВ с одним эпизодом инсульта, не связанного с кардиоэмболическим механизмом, с профилем аФЛ низкого риска тромбоза и наличием обратимых провоцирующих факторов могут отдельно считаться кандидатами для назначения антитромбоцитарных препаратов (Уровень доказательства не градуирован)
6. Больные с достоверным АФС и тромбозами должны длительно (пожизненно) получать антитромботическую терапию (уровень доказательства 1С)
7. Больным с одним случаем венозного тромбоза с профилем аФЛ низкого риска и известными преходящими преципитирующими факторами антикоагулянтная терапия может быть лимитирована в пределах 3-6 месяцев (Уровень доказательства не градуирован)
8. Пациентам с аФЛ, но без СКВ и без предшествующих тромбозов при профиле аФЛ высокого риска рекомендована долгосрочный приём низких доз аспирина, особенно при наличии других факторов риска тромбоза (уровень доказательства 2С)
Комментарии. Первичная профилактика тромбоза должна проводиться у больных СКВ с аФЛ или с классическими кардиоваскулярными факторами риска, хотя эффективность аспирина в этих случаях оспаривается, преимущественно у больных без СКВ [14,15,16,17,18]
10. Всем носителям аФЛ рекомендована тромбопрофилактика в ситуациях высокого риска тромбоза, таких как хирургические вмешательства, длительная иммобилизация и послеродовый период (уровень доказательства 1С)
11. У всех больных с профилем аФЛ высокого риска следует контролировать кардиоваскулярные факторы независимо от наличия предшествующих тромбозов, сопутствующей СКВ, или дополнительных АФС проявлений (уровень доказательства не градуирован)
Комментарии. Больные АФС часто имеют другие дополнительные кардиоваскулярные факторы риска такие как: гипертензия, курение, гиперхолестеринемия, приём оральных контрацептивов [19,20,22,23].В исследовании случай-контроль [24] риск инсульта удваивался у курящих женщин с ВА, по сравнению с некурящими; использование контрацептивов увеличивало риск развития инсультов в 7 раз. В этом исследовании все женщины с инфарктом миокарда были курящими во время его развития.
Клинические рекомендации при акушерской патологии АФС
Акушерская патология одна из крупных аспектов АФС и является критериальным признаком диагностических критерий АФС [1,2,3,25]. Акушерская патология АФС включает материнские тромбозы, рецидивирующие спонтанные аборты до 10 недель гестации, поздние нежелательные исходы беременности (например: внутриутробная гибель плода, преэклампсия, плацентарная недостаточность, задеожка внутриутробного развития плода, преждевременные роды). Даже при проведении оптимальной терапии согласно существующим рекомендациям неблагоприятные исходы у женщин с АФС до сих пор варьируют в пределах 20-30% случаев [27,28].
1. Тромбопрофилактика у бессимптомных аФЛ-позитивных женщин при ведении беременности и послеродовом периоде следует проводить согласно риск-стратифицированного подхода. (уровень доказательства не градуирован)
2. Гидроксихлорохин рекомендуется для первичной тромбопрофилактики у беременных бессимптомных аФЛ-позитивных женщин, особенно на фоне заболеваний соединительной ткани (уровень доказательства не градуирован) (уровень доказательства не градуирован) [29].
3. При возникновении ситуаций высокого риска тромбоза (периоперативный период, длительная иммобилизация) рекомендуются профилактические дозы гепарина для бессимптомных аФЛ-позитивных женщин [30]
Комментарии. Необходимость тромбопрофилактики у женщин с аФЛ при отсутствии тромботических осложнений в анамнезе остаётся спорной среди экспертов. Прекращение курения и снижение индекса массы тела при его высоком уровне является одним из важных условий профилактики тромбоза у этих женщин [3]. Мнение экспертов было единогласным о высоком риске тромбоза в этой группе при приёме оральных контрацептивов. Некоторыми экспертами предложено сочетание их приёма с антикоагулянтами, но протромботический риск может перевешивать положительные моменты контрациптивов. Учитывая риск нежелательных явлений антикоагулянтов, большинство экспертов не согласны с продолжением приёма варфарина в послеродовом периоде у аФЛ-позитивных, но без клинических проявлений больных. В отношении приёма низких доз аспирина также мнение экспертов противоречиво. Это основано на заключениях двух рандомизированных исследований, где одно отметило успешное завершение беременности в этой группе женщин на фоне низких доз аспирина [31], второе – отметило неэффективность его в тромбопрофилактике [32]. Однако большинство работ подтверждают при аФЛ профиле высокого риска тромбоза профилактические дозы гепарина показаны.
6. Катастрофическая микроангиопатия во время беременности или в послеродовом периоде обычно включает эффективную антикоагулянтную терапию и в/в введение глюкокртикоидов (ГК) ± плазмаферез с последующим введением одногруппной свежезамороженной плазмы и в/в введение человеческого иммуноглобулина в зависимости от клинической ситуации.
В послеродовом периоде при резистентных формах имеются единичные сообщения об эффективности генно-инжинерной терапии (ритуксимаб, ингибиторы комплементаб анти-ФНО ингибиторы) [39,40,41].
Клинические рекомендации при катастрофическом антифосфолипидном синдроме (КАФС).
КАФС характеризуется вовлечением в патологический процесс многих органов за короткий период времени. Гистологическая картина проявляется наличием окклюзии мелких сосудов и лабораторными маркёрами в крови являются антифосфолипидные антитела (аФЛ) [42,43]. С точки зрения патофизиологии, КАФС – тромботическая микроангиопатия, характеризующаяся диффузной тромботической микроваскулопатией [44]. И хотя, частота КАФС составляет 1% из всех случаев АФС, они обычно представляют собой жизненно-угрожающие состояния в 30-50% случаев со смертельным исходом [44].
Предварительные классификационные диагностические критерии КАФС с диагностическим алгоритмом были разработаны в 2003г [43]. Для улучшения алгоритма и более точной диагностики КАФС был разработан пошаговый подход алгоритма КАФС [45]. В этот алгоритм был включен предшествующий анамнез наличия АФС или постоянная позитивность по аФЛ, число вовлечённых органов, время исхода, наличие микротромбозов по данным биопсии и другие данные, позволявшие объяснить причину множественных тромбозов.
Исходя из вышеперечисленных выводов, в терапевтическую стратегию КАФС рекомендуется включение идентификации и лечения любых сопутствующих факторов риска тромбоза (в первую очередь инфекций) и в терапии КАФС рекомендована комбинация АК с ГК плюс ПФ и/или в/в человеческий иммуноглобулин. При развитии КАФС на фоне СКВ в/в введение ЦФ [47] может быть рекомендовано при отсутствии противопоказаний и, особенно, при наличии других клинических проявлений СКВ.
Данные Международного регистра КАФС не дал ответы на спорные и неизвестные стороны этого варианта АФС. Первый и возможно наиболее важным неизвестным моментом является почему незначительное число больных с аФЛ развивают полиорганную недостаточность, называемого КАФС. Кроме того, распределение по возрасту, полу, связи с СКВ, профилю аФЛ у больных классическим АФС и КАФС схож [42]. С патофизиологической точки зрения КАФС является тромботическим микроангиопатическим состоянием, характеризующийся диффузной тромботической микроваскулопатией. Подобные патологические находки могут быть представлены и в других состояниях таких как тромботическая тромбоцитопеническая пурпура (ТТП), гемолитико-уремический синдром (ГУС), злокачественной гипертензии, HELLP –синдроме, послеродовой почечной недостаточности и преэкласмпсии. Тромботическая микроангиопатия, сопровождающаяся наличием аФЛ в крови, описывается во всех выше перечисленных состояниях, приводя к концепции «микроангиопатического антифосфолипид-ассоциированного синдрома» [50] и приводя к диагностическим поискам. Однако источник и патогенетический потенциал аФЛ в этих состояниях остаётся неизвестным; предполагается, что аФЛ могут вызывать пертурбацию и повреждение эндотелиальных клеток, что прводит к катастрофически исходом [51]. Ещё одним важным моментом должно быть идентификация АФС пациентов с высоким риском развития КАФС. Выявление и лечение преципитирующих факторов для предотвращения развития катастрофических эпизодов у больных с аФЛ является существенным [52]. Прекращение приёма антикоагулянтов или низкое медународное нормализованное отношение (МНО) было одним из подобных факторов у 8% больных с катастрофическими эпизодами [53], тем не менее доктора лечащие пациентов с АФС должны быть особенно внимательны в клинических ситуациях, когда приём антикоагулянтов следует прекратить, например при хирургических вмешательствах [54]. Дискуссия по этому вопросу продолжается из-за отсутствия рандомизированных контролируемых исследований. Вопросы касаются наиболее приемлемого гепарина (фракционированного или низкомолекулярного гепарина) оптимальное значение МНО после КАФС, начальные дозы ГК и темп их снижения, эффективный протокол проведения ПФ, типы растворов при плазмаобмене, а также дозы и длительность в/в человеческого иммуноглобулина являются объектами будущих исследований [55].
Экспертной комиссией в рамках Международного Конгресса по аФЛ рекомендовано [3] при КАФС:
· Использование нефракционированного или низкомолекулярного гепарина в лечебных дозах как можно быстрее. После острой фазы больные КАФС должны продолжить антикоагулянтную терапию пожизненно для профилактики рецидива тромбоза. При использовании АВК уровень гипокоагуляции остаётся спорным: средне-интенсивный уровень (МНО от 2,0до 3,0) или высоко-интенсивный (выше 3,0). Большинство экспертов склонны к рекомендации высокой степени гипокоагуляции.
· Раннее подключение к терапии ГК, но начальная доза вариабельна.
Комментарии. По мнению всех экспертов жизненно угрожающие состояния (такие как респираторный дисстресс синдром, ГУС) являются показанием для в/в пульс терапии метилпреднизолоном в течении 3-5 дней до стабилизации состояния с последующим переходом на пероральный приём из расчёта 1мг на кг веса
· При отсутствии ответа на вышеперечисленную терапию подключение ПФ с замещением одногруппной свежезамороженной плазмой или плюс в/в человеческий иммуноглобулин (уровень доказательства 2В)
Клинические рекомендации при рефрактерном АФС
Несмотря на проведение антикоагулянтной терапии варфарином с поддержанием средне-интенсивного уровня гипокоагуляции (2,0-3,0) и даже высокого уровня (выше 3,0) у некоторых больных отмечаются рецидивы тромбозов [57]. В рекомендациях сформулированных экспертами 13-го Междунароного Конгресса по аФЛ [8] подобным больным альтернативой длительного приёма варфарина предлагаются низкомолекуляные гепарины. В одном из исследований было показано, что больные получавшие длительно подобную терапию не имели рецидива тромбоза [58]. В тоже время все антикоагулянты, используемые многие годы, имеют ряд побочных действий и далеки от “идеальных” антикоагулянтов. Предполагается, что новые антикоагулянты с селективной точкой приложения на факторы свёртывания будут более эффективными и безопасными по сравнению с гепаринами и варфарином. Эти новые препараты в настоящее время одобренные или, находящиеся в испытании, для лечения и профилактики венозного тромбоэмболизма действуют непосредственно на активный участок тромбина (прямой ингибитор тромбина) – дабигатран этемзилат, и прямые ингибиторы фактора Ха: ривароксабан, апиксабан, эндоксабан и бетриксабан [59]. Проведение рандомизированных контролируемых исследований по лечению АФС этими препаратами экспертами считается целесообразным [57]. Подключение в лечение подобных больных с АФС гидроксихлорохина и статинов считается оправданным [8].
Антифосфолипидный синдром и его значение при беременности
Физические свойства крови важны для адекватного кровоснабжения. При состояниях, сопровождающихся повышенной вязкостью крови, создаются предпосылки для тромбообразования.
Особое значение такие состояния имеют при лечении и профилактике сердечно-сосудистых заболеваний, болезнях крови, заболеваниях центральной нервной системы и др. Беременность также требует контроля процессов свёртывания крови. Однако, при антифосфолипидном синдроме контроля недостаточно. Без активного лечения этой патологии во время беременности возможны различные нарушения, которые могут привести к гипоксии и смерти плода.
Что такое антифосфолипидный синдром
Механизм развития АФС синдрома
АФС синдром часто сопровождает другие аутоиммунные заболевания, такие, как системная красная волчанка.
Симптомы АФС синдрома
Классические проявления АФС синдрома:
Акушерские патологии, связанные с АФС синдромом
АФС синдром, кроме акушерской патологии, может быть причиной повторяющихся инсультов, инфарктов.
Диагностика АФС синдрома
Обследование на АФС синдром включает в себя:
Лечение АФС
Во время беременности варфарин противопоказан, из-за его способности вызывать врождённые патологии плода. У беременных основными препаратами являются гепарин и его производные (фраксипарин, клексан и др), а также в низких дозах аспирин.
Для профилактики спонтанного аборта на ранних сроках рекомендуется немедленно начать применение аспирина и гепарина при задержке менструаций.
Несмотря на лечение, у 29% больных в течение жизни случаются тромботические явления и их осложнения.
Антифосфолипидный синдром: особенности течения у беременных и варианты терапии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В настоящей работе представлен обзор данных о беременности при некоторых ревматических заболеваниях с акцентом на антифосфолипидный синдром (АФС). АФС представляет собой системное аутоиммунное заболевание, связанное с тромбозами сосудов и/или повторными эпизодами гибели плода в условиях стабильно повышенного уровня антифосфолипидных антител. Антифосфолипидные антитела – это гетерогенная группа антител, которые реагируют на фосфолипиды, фосфолипид-связывающие белки и комплексы фосфолипидов с белками. Антифосфолипидные антитела могут оказывать влияние на рост и развитие плода, и это воздействие может проявляться на любой стадии беременности. Проанализированы факторы, влияющие на исход беременности, развитие неонатальной патологии, оценены риски возможных осложнений ревматических заболеваний у данной категории пациентов. Особое внимание уделено вопросам планирования и подготовки к беременности. Тактика ведения беременных с АФС, режим дозирования во многом зависят от предшествующего анамнеза (наличия/отсутствия неплацентарных тромбозов, количества спонтанных абортов, предшествующей терапии). В связи с этим в статье определены клинические группы с различными видами терапии.
Следует отметить, что некоторые обсуждаемые средства медикаментозного лечения не являются одобренными национальными регулирующими органами (Росздравнадзор, FDA и др.) и, как правило, в реальной клинической практике назначаются без официальных показаний («off label»).
Ключевые слова: антифосфолипидный синдром, беременность, профилактика обострений.
Для цитирования: Трофимов Е.А., Трофимова А.С. Антифосфолипидный синдром: особенности течения у беременных и варианты терапии // РМЖ. 2016. № 15. С. 1032–1036.
Для цитирования: Трофимов Е.А., Трофимова А.С. Антифосфолипидный синдром: особенности течения у беременных и варианты терапии. РМЖ. Мать и дитя. 2016;24(15):1032-1036.
The course of antiphospholipid syndrome during pregnancy and its therapy
Trofimov E.A., Trofimova A.S.
I.I. Mechnikov North-West State Medical University, St. Petersburg
The paper reviews the data on the course of the pregnancy in certain rheumatic diseases, in particular, in antiphospholipid syndrome (AFS). AFS is a systemic autoimmune disorder which is characterized by chronic increase in antiphospholipid antibody levels and manifests itself as vascular thrombosis and/or recurrent fetal loss. Antiphospholipid antibodies are a heterogeneous group antibodies reactive against phospholipids, phospholipid-binding proteins, and phospholipid-protein complexes. Antiphospholipid antibodies affect fetal growth and development during each each stage of the pregnancy. The factors which affect pregnancy outcome and neonatal pathology are analyzed. The risks of potential complications of rheumatic diseases in these patients are evaluated. Special attention is given to the planning and preparing for pregnancy. Management of pregnancy in AFS and dosing regimen mainly depend on medical history, i.e., non-placental thrombosis, the number of spontaneous abortions, and prior therapy. Considering this, clinical groups with different therapy were described in the paper. It should be noted that some of the drugs under discussion are not approved by national regulatory authorities (Russian Federal Service for Surveillance on Consumer Rights Protection and Human Wellbeing, Food and Drug Administration etc.) and are generally prescribed for an off-label use in real-world clinical practice.
Key words: antiphospholipid syndrome (AFS), pregnancy, prevention of exacerbations.
For citation: Trofimov E.A., Trofimova A.S. The course of antiphospholipid syndrome during pregnancy and its therapy // RMJ. 2016. № 15. P. 1032–1036.
Статья посвящена особенностям течения антифосфолипидного синдрома у беременных и вариантам терапии
Беременность существенным образом влияет на иммунную систему матери: депрессия клеточного звена иммунитета, повышенная секреция иммуноглобулинов, снижение функции лимфоцитов вследствие экспрессии особых белков PSP (pregnancy-specific proteins). Все эти преобразования направлены на выживание плода. Процессы изменения цитокинового профиля Т-хелперов 2 типа являются доминирующими в поддержании «иммунотолерантности» при беременности и могут влиять на различные аутоиммунные заболевания. Существует ряд феноменов, с помощью которых можно увидеть влияние ревматической патологии на беременность, и наоборот. Процессы эти носят разнонаправленный характер: с одной стороны, может отмечаться как дебют системного аутоиммунного заболевания (САЗ), так и обострение существующей патологии (например, вспышка люпус-нефрита), с другой стороны, описаны многочисленные случаи ремиссии, индуцированной беременностью, у пациенток с ревматоидным артритом. Кроме того, аутоиммунная дисфункция, характерная для САЗ, наличие антифосфолипидных антител (АФА) могут привести к повышению риска выкидыша, гибели плода и преэклампсии. Трансплацентарный транспорт патологических макромолекул, особенно анти-Ro/La или SS-A, SS-B антител, напрямую влияет на плод и повышает вероятность развития неонатальной волчанки. Наконец, высокая иммуновоспалительная активность, поражение внутренних органов в рамках САЗ могут оказать существенное влияние на показатели материнской и фетальной смертности.
Беременность вызывает множество физиологических изменений в организме матери помимо дисфункции иммунной системы. Так, отмечается значительное увеличение объема циркулирующей крови (до 40–45%), что может усугубить течение заболеваний почек или сердечно-сосудистой системы. Скорость клубочковой фильтрации (СКФ) увеличивается примерно на 50% при нормальном течении беременности, поэтому у пациентки с предшествующей протеинурией почти наверняка будет отмечаться некоторое увеличение количества белка в моче. В результате изменений коагуляционного звена гемостаза, активности тромбоцитов, фибринолиза, венозного стаза, компрессии сосудов беременной маткой, вынужденного постельного режима повышается вероятность тромботических осложнений. Отмечаются отек и кровоточивость десен, желудочно-пищеводный рефлюкс, значительные потери костной массы из-за беременности, лактации, а также возможного применения глюкокортикостероидов (ГКС). Таким образом, даже нормальная беременность может усугубить течение САЗ.
Физиологические или патологические изменения, в т. ч. вызванная беременностью гипертензия, могут также имитировать активность САЗ, что представляет собой определенные трудности при проведении дифференциального диагноза. Например, покраснение или гиперпигментацию лица легко спутать с центробежной скуловой сыпью по типу «бабочки». Ладонная эритема у беременных может выглядеть, как кожный васкулит. Физиологический лейкоцитоз, анемия и низкий уровень тромбоцитов вследствие гемодилюции, распространенной у беременных, могут имитировать гематологические проявления САЗ. В результате повышения уровня фибриногена, анемии может отмечаться ускорение скорости оседания эритроцитов, и данный параметр не может быть объективным маркером активности заболевания. Многие женщины предъявляют жалобы на диффузные артралгии, боли в мышцах и костях, особенно во время первой беременности. Гипертензия, протеинурия, почечная недостаточность и отеки, связанные с гестозом, могут имитировать различные заболевания или их обострение, включая волчаночный нефрит, острую склеродермическую нефропатию, рецидив васкулита, некротизирующего гломерулонефрита. HELLP-синдром – вариант преэклампсии, характеризующийся низким количеством тромбоцитов, повышенным уровнем печеночных ферментов, гемолизом, болью в животе, может имитировать системную красную волчанку (СКВ) или обострение системного васкулита. Наконец, эклампсию, которая включает в себя судорожный синдром или нарушение мозгового кровообращения, можно спутать с поражением центральной нервной системы при СКВ или нейроваскулитом.
Антифосфолипидный синдром
В начале 1950-х гг. антифосфолипидный синдром (АФС) был описан как вариант СКВ или волчаночноподобного синдрома. Однако очень скоро было установлено, что связь между гиперпродукцией АФА и тромботическими нарушениями наблюдается в отсутствие достоверных клинических и серологических признаков СКВ или какого-либо другого ведущего заболевания. Для определения этой новой нозологической формы был предложен термин «первичный антифосфолипидный синдром».
Разработка методов радиоиммунологического (1983) и иммуноферментного анализа для определения антител к кардиолипину способствовала расширению исследований, касающихся роли АФА при заболеваниях человека. Оказалось, что эти антитела являются серологическим маркером своеобразного симптомокомплекса, включающего венозные и/или артериальные тромбозы, различные формы акушерской патологии (в первую очередь привычное невынашивание беременности), тромбоцитопению, а также другие разнообразные неврологические, кожные, сердечно-сосудистые, гематологические нарушения. В 1986 г. G. Hughes et al. предложили обозначать этот симптомокомплекс как АФС. В 1994 г. на VI международном симпозиуме, посвященном изучению АФА, было предложено называть АФС синдромом Hughes – по имени английского ревматолога, впервые описавшего его и внесшего наибольший вклад в разработку этой проблемы.
В 2006 г. в Сиднее произошел последний пересмотр критериев этого заболевания. Несколько изменена была трактовка клинических проявлений, в лабораторные критерии добавлены антитела к бета-2 гликопротеину I (АБ2ГП) (табл. 1). На основе австралийских критериев в настоящее время строится практическая диагностика АФС.
Клинический спектр проявлений, которые связывают с АФС, достаточно широк: мигрень, артриты/артралгии, легочная гипертензия, livedo reticularis, язвы ног и др. Хотя большинство из них не были включены в итоговые критерии диагностики АФС от 2006 г., место этих феноменов активно обсуждается в литературе.
Потеря беременности является частым осложнением АФС в акушерской практике, кроме того, обращает на себя внимание тот факт, что преэклампсия и эклампсия часто встречаются при сочетании АФС и СКВ. HELLP-синдром в сочетании с циркуляцией АКЛА протекает тяжелее и часто встречается во II, а не III триместре. Риск развития инфаркта печени у пациентов с HELLP-синдромом, ассоциированным с АКЛА, увеличивается в 30 раз по сравнению с таковым при серонегативном варианте HELLP-синдрома [2]. Кроме того, при АФС часто развиваются другие множественные тромботические осложнения, которые требуют более агрессивного лечения, чем у пациентов с традиционным течением HELLP-синдрома. Сама по себе беременность является фактором риска развития гиперкоагуляции, и при появлении АФС вероятность тромбозов у матери существенно увеличивается. В редких случаях во время беременности может формироваться катастрофический АФС: в проанализированных работах было выявлено 15 случаев, характерной особенностью которых явился тот факт, что почти половина пациенток до этого имела в анамнезе латентно протекающий АФС [3]. Пациентки могут иметь и другие гематологические осложнения АФС, такие как выраженная тромбоцитопения во II и III триместрах беременности.
Наиболее распространенными нежелательными явлениями, связанными с АФС у беременных, являются преждевременные роды и задержка внутриутробного развития. Преждевременные роды наиболее часто встречаются у пациенток, у которых есть сочетание АФС и СКВ, а заболеваемость колеблется от 10 до 40%. В одном исследовании авторы попытались определить причины неблагоприятных неонатальных исходов (преждевременные роды, задержка внутриутробного развития, низкая оценка по шкале Апгар). Такими факторами явились присутствие ВАК, АКЛА, АБ2ГП антител, наличие в анамнезе сосудистых тромбозов перед беременностью. При отсутствии этих факторов (даже при наличии предшествующего отягощенного акушерского анамнеза) отмечался более благоприятный неонатальный исход [4].
В редких случаях у плода или новорожденного формируются тромбозы вследствие трансплацентарного транспорта АФА. В таких случаях речь может идти о наличии неонатального АФС [5]. Риск тромбозов в данной когорте пациентов уменьшается вместе со снижением концентрации материнских АФА, однако в дальнейшем отмечаются затруднение обучаемости, снижение памяти и других когнитивных функций. В настоящее время существуют регистры (European registry to babies born to mothers with antiphospholipid syndromе) по наблюдению за отдаленными нейропсихическими последствиями неонатального АФС [6].
ВАК, по-видимому, является наиболее важным фактором риска неблагоприятного исхода беременности, в т. ч. ее потери. В настоящее время способы определения концентрации ВАК являются нестандартизованными в отличие от тестов, связанных с определением антикардиолипинов и бета-2 гликопротеина I. В настоящее время завершается многоцентровое проспективное наблюдательное исследование PROMISSE, основная цель которого – наблюдение за АФС-позитивными и СКВ-ассоциированными беременными женщинами. Недавний анализ промежуточных данных установил, что только уровень ВАК является единственным лабораторным маркером АФС, связанным с такими неблагоприятными исходами беременности, как интранатальная гибель плода, задержка внутриутробного развития и преждевременные роды [7]. С другой стороны, появляются данные о том, что только совокупность ВАК, АКЛА и АБ2ГП у конкретной пациентки является предиктором интранатальной гибели плода [8]. Эта информация несколько обнадеживает тех пациенток, которые имеют низкий или умеренный титр АКЛА, АБ2ГП. Для своевременной оценки риска тромбозов у пациенток с АФС необходимо проводить тщательный скрининг на наличие маркеров наследственной тромбофилии (гены фибринолиза: PAI-I, PLAT; гены тромбоцитарных рецепторов: ITGA2, ITGB3, Gplba; гены системы свертывания крови: Fl, F2, F5, F7), наличие гипергомоцистеинемии [8–10]. В последнее время появляются данные о взаимосвязи изменения уровня комплемента в сыворотке во время беременности и неблагоприятных исходов. Интерпретация этого феномена представляется весьма затруднительной: при эклампсии и первичном АФС возможно повышение титра, а при СКВ и вторичном АФС – гипокомплементемия. Комплемент является важным прогностическим фактором неблагоприятного исхода беременности и смертности в мышиной модели АФС [11], представляется вероятным, что активация системы комплемента играет такую же негативную роль и в человеческой популяции.
Рекомендации по ведению беременных женщин с АФС
Своевременное становление лечения акушерского АФС относится к 1980–1985 гг., когда пациентки с наличием АКЛА, ВАК и акушерскими неудачами стали получать ГКС (преднизолон) и ацетилсалициловую кислоту (АСК) в небольших дозах. Более того, дозу ГКС постепенно увеличивали вплоть до достижения ВАК или другими маркерами АФС приемлемых уровней. В 1990-х гг. исследования показали, что низкие дозы гепарина в сочетании с малыми дозами АСК оказались столь же эффективными, как ГКС, но с гораздо меньшим количеством побочных эффектов. На сегодняшний момент комбинация антитромбоцитарных препаратов и прямых антикоагулянтов является стандартной: дозировка низкомолекулярного гепарина (НМГ) обычно – 40 мг эноксапарина ежедневно, некоторые специалисты используют 30 мг 2 р./сут, доза для нефракционированного гепарина (НФГ) обычно – 5000 ЕД 2 р./сут [12].
Исследования показывают, что сочетание низких доз гепарина и низких доз АСК более эффективно, чем монотерапия АСК [13], с успешностью около 75% против 40%. Не получено принципиальных отличий между малыми и высокими дозами антикоагулянтов, а также НФГ и НМГ гепарина [14, 15]. Такой вид терапии относится к первой линии и является наиболее эффективным в плане профилактики потери беременности на ранних сроках [16].
Терапия второй линии включает в себя применение внутривенного человеческого иммуноглобулина (ВВИГ). Некоторые эксперты на этом этапе рекомендуют увеличение дозы гепарина до общетерапевтических доз. В единственном контролируемом исследовании с использованием ВВИГ не было получено достоверного улучшения исходов беременности. Однако существует значительное количество неконтролируемых исследований, опубликованных клинических случаев с блестящим эффектом при комбинированном применении ВВИГ, низких доз АСК и НМГ. При дальнейшем повышении уровня АКЛА, ВАК с успехом может применяться плазмаферез. Наиболее перспективными методами лечения АФС в будущем являются ингибирование комплемента [11], а также применение средств генно-инженерной биологической терапии [17].
Лечение средними/высокими дозами ГКС в настоящее время практически не применяется из-за отсутствия доказательств их эффективности и негативного воздействия на организм как матери, так и плода. Применение ГКС оправданно, только если АФС развивается на фоне какого-то заболевания (СКВ, болезни Шегрена и др.). Использование ГКС в этих случаях направлено на лечение не АФС, а основного заболевания.
В послеродовом периоде антикоагулянтная терапия должна быть продолжена на срок от 6 до 8 нед. даже у пациенток без тромбозов в анамнезе.
Тактика ведения беременных с АФС, режим дозирования во многом зависят от предшествующего анамнеза (наличия/отсутствия неплацентарных тромбозов, количества спонтанных абортов, предшествующей терапии). В связи с этим можно выделить следующие подгруппы:
1. Пациентки только с серологическими маркерами АФС (без предшествующей беременности, с одним эпизодом необъяснимого спонтанного аборта до 10 нед. гестации), без тромбозов в анамнезе.
Тактика ведения этой категории женщин заключается в применении малых доз АСК, которая назначается на весь период беременности и в течение 6 мес. после родоразрешения.
При наличии у беременных высокопозитивных АКЛА (более 65 ЕД GPL) целесообразно назначение НМГ. Риск развития тромботических осложнений высок не только во время беременности, но и в послеродовом периоде (в течение 6 мес. после родов). При родоразрешении естественным путем целесообразно возобновление лечения НМГ в послеродовом периоде. В случае проведения кесарева сечения введение НМГ отменяется за 2—3 дня и возобновляется в послеродовом периоде с последующим переходом на прием непрямых антикоагулянтов.
2. Пациентки с АФС без неплацентарных тромбозов в анамнезе и женщины с серологическими маркерами АФС и двумя или более необъяснимыми спонтанными абортами (до 10 нед. гестации) в анамнезе.
Тактика ведения данной категории беременных заключается в сочетанном применении малых доз АСК (50–150 мг/сут) с момента зачатия до родоразрешения и НФГ (эноксапарина и др.) или НФГ (5000–10 000 ЕД каждые 12 ч) с момента документированной беременности и до родов. Через 12 ч после родов необходимо возобновить лечение НМГ, НФГ (или варфарином).
Длительная терапия гепарином у беременных женщин может приводить к развитию остеопороза. Вследствие этого все беременные, получающие гепаринотерапию, обязательно должны принимать препараты кальция (1500 мг/сут) и витамина D3 (не менее 1000 МЕ/сут).
3. Пациентки с АФС и неплацентарными тромбозами в анамнезе (получавшие варфарин до беременности).
Необходимо до 6 нед. беременности отменить варфарин. В последующем беременная принимает АСК в низких дозах в сочетании с НФГ.
4. При неэффективности стандартной терапии в период следующей беременности применяют иммуноглобулин в/в 0,4 г/кг в течение 5 сут каждый месяц беременности.
Антифосфолипидный синдром и проблема невынашивания беременности
Опубликовано 15 марта 2015 пользователем jigga
Антифосфолипидный синдром (АФС) выявляется более чем у 40% женщин с повторным невынашиванием беременности. При этом синдроме организм вырабатывает антитела к собственным фосфолипидам (компонентам клеточных стенок), из-за чего при формировании сосудов плаценты начинают образовываться тромбы. Это приводит к задержке развития плода или даже его гибели, а также к отслойке плаценты и другим осложнениям беременности, например, гестозу. При АФС осложнения беременности и родов возникают в 80% случаев. У 95% женщин, страдающих АФС, без медицинской помощи плод гибнет.
Что вызывает антифосфолипидный синдром?
Фосфолипидные антитела могут начать вырабатываться в организме при таких заболеваниях, как системная красная волчанка (в 70% случаев), системная склеродермия, ревматоидный артрит, злокачественные опухоли, хронические инфекции.
Как диагностируется АФС?
В диагностике АФС применяют несколько лабораторных тестов: Волчаночный антикоагулянт и Антифосфолипидный скрининг. Все эти исследования можно пройти в любом процедурном кабинете КДЛ «ОЛИМП»
Что делать, если АФС обнаружен уже во время беременности?
Женщинам, страдающим АФС, с ранних сроков беременности назначают терапию, улучшающую обмен веществ, с целью профилактики патологии плода. Этот комплекс включает в себя препараты и витамины, нормализующие окислительно-восстановительные и обменные процессы на клеточном уровне организма. Курс терапии рекомендуется проводить три-четыре раза в течение беременности. При этом необходимо тщательно контролировать состояние кровообращения ребенка и плаценты с помощью ультразвуковой допплерометрии.
Можно ли выносить здорового ребенка при АФС?
При условии, что АФС будет своевременно выявлен, а женщина будет выполнять все указания и рекомендации врачей, она вполне может благополучно выносить и родить здорового ребенка.
Как проявляется АФС?
Клиническая картина зависит от многих факторов, в том числе и от размера пораженных сосудов, их функциональности и значимости для жизнедеятельности организма, а также от скорости их закупорки тромбами. Симптомы АФС часто очень походят на проявления самых разных заболеваний — от цирроза печени до болезни Альцгеймера. Однако при антифосфолипидном синдроме на коже нередко можно заметить тонкую сетку сосудов (сетчатое ливедо), которая отчетливее проступает на холоде. Другими признаками АФС являются хронические язвы голени и периферическая гангрена.
Как лечить АФС?
Для того чтобы вылечить АФС, развившийся на фоне системной красной волчанки или другого аутоиммунного заболевания, нужно устранить эту параллельную болезнь. Если это удастся, то в сыворотке крови количество антител к фосфолипидам начнет снижаться. Чем меньше их будет, тем ниже риск возникновения тромбов. С этой целью врачи прописывают глюкокортикоиды и цитостатики. При очень высокой концентрации антител больным назначают плазмоферез (очищение крови).
Антифосфолипидный синдром: клиника, диагностика, лечение
Антифосфолипидный синдром (АФС) относится к числу наиболее актуальных мультидисциплинарных проблем современной медицины и рассматривается как уникальная модель аутоиммунной тромботической васкулопатии. Начало изучению АФС было положено около ста лет н
Антифосфолипидный синдром (АФС) относится к числу наиболее актуальных мультидисциплинарных проблем современной медицины и рассматривается как уникальная модель аутоиммунной тромботической васкулопатии.
Начало изучению АФС было положено около ста лет назад в работах A. Wassermann, посвященных лабораторному методу диагностики сифилиса. При проведении скрининговых исследований стало очевидным, что положительную реакцию Вассермана можно обнаружить у многих людей без клинических признаков сифилитической инфекции. Этот феномен получил наименование «биологическая ложноположительная реакция Вассермана». Вскоре было установлено, что основным антигенным компонентом в реакции Вассермана является отрицательно заряженный фосфолипид, названный кардиолипином. Внедрение радиоиммунологического, а затем и иммуноферментного метода (ИФМ) определения антител к кардиолипинам (аКЛ) способствовало более глубокому пониманию их роли при заболеваниях человека. По современным представлениям, антифосфолипидные антитела (аФЛ) — это гетерогенная популяция аутоантител, вступающих во взаимодействие с отрицательно заряженными, реже нейтральными фосфолипидами и/или фосфолипидсвязывающими сывороточными белками. В зависимости от метода определения, аФЛ условно подразделяются на три группы: выявляемые с помощью ИФМ с использованием кардиолипина, реже других фосфолипидов; антитела, обнаруживаемые с помощью функциональных тестов (волчаночный антикоагулянт); антитела, которые не диагностируются с помощью стандартных методов (антитела к белку С, S, тромбомодулину, гепарансульфату, эндотелию и др.).
Следствием пристального интереса к изучению роли аФЛ и совершенствования методов лабораторной диагностики явилось заключение, что аФЛ являются серологическим маркером своеобразного симптомокомплекса, включающего венозные и/или артериальные тромбозы, различные формы акушерской патологии, тромбоцитопению, а также широкий спектр неврологических, кожных, сердечно-сосудистых нарушений. Начиная с 1986 г. этот симптомокомплекс стал обозначаться как антифосфолипидный синдром (АФС), а в 1994 г. на международном симпозиуме по аФЛ было предложено также использовать термин «синдром Hughes» — по имени английского ревматолога, внесшего наибольший вклад в изучение этой проблемы.
Истинная распространенность АФС в популяции до сих пор неизвестна. Поскольку синтез аФЛ возможен и в норме, низкий уровень антител нередко встречается в крови здоровых людей. По различным данным, частота выявления аКЛ в популяции варьирует от 0 до 14%, в среднем же она составляет 2–4%, при этом высокие титры обнаруживаются достаточно редко — примерно у 0,2% доноров. Несколько чаще аФЛ выявляются у лиц пожилого возраста. При этом клиническое значение аФЛ у «здоровых» лиц (т. е. не имеющих явных симптомов заболевания) не вполне ясно. Часто при повторных анализах уровень повышенных в предшествующих определениях антител нормализуется.
Нарастание частоты встречаемости аФЛ отмечено при некоторых воспалительных, аутоиммунных и инфекционных заболеваниях, злокачественных новообразованиях, на фоне приема лекарственных препаратов (оральные контрацептивы, психотропные средства и проч.). Имеются данные об иммуногенетической предрасположенности к повышенному синтезу аФЛ и более частом их выявлении у родственников больных АФС.
Доказано, что аФЛ не только серологический маркер, но и важный «патогенетический» медиатор, вызывающий развитие основных клинических проявлений АФС. Антифосфолипидные антитела обладают способностью воздействовать на большинство процессов, составляющих основу регуляции гемостаза, нарушение которых приводит к гиперкоагуляции. Клиническое значение аФЛ зависит от того, связано ли их наличие в сыворотке крови с развитием характерной симптоматики. Так, проявления АФС наблюдаются только у 30% больных с положительным волчаночным антикоагулянтом и у 30–50% больных, имеющих умеренный или высокий уровень аКЛ. Заболевание развивается преимущественно в молодом возрасте, при этом АФС может быть диагносцирован у детей и даже у новорожденных. Как и другие аутоиммунные ревматические заболевания, данный симптомокомплекс чаще встречается у женщин, чем у мужчин (соотношение 5:1).
Клинические проявления
Самыми частыми и характерными проявлениями АФС являются венозные и/или артериальные тромбозы и акушерская патология. При АФС могут поражаться сосуды любого калибра и локализации — от капилляров до крупных венозных и артериальных стволов. Поэтому спектр клинических проявлений чрезвычайно разнообразен и зависит от локализации тромбоза. По современным представлениям, основу АФС составляет своеобразная васкулопатия, обусловленная невоспалительным и/или тромботическим поражением сосудов и заканчивающаяся их окклюзией. В рамках АФС описаны патология ЦНС, сердечно-сосудистой системы, нарушение функции почек, печени, эндокринных органов, желудочно-кишечного тракта. С тромбозом сосудов плаценты склонны связывать развитие некоторых форм акушерской патологии (табл.1).
Венозный тромбоз, особенно тромбоз глубоких вен нижних конечностей, — наиболее типичное проявление АФС, в том числе в дебюте заболевания. Тромбы обычно локализуются в глубоких венах нижних конечностей, но могут нередко встречаться в печеночных, портальных, поверхностных и других венах. Характерны повторные эмболии легочных артерий, что может приводить к развитию легочной гипертензии. Описаны случаи развития надпочечниковой недостаточности вследствие тромбоза центральной вены надпочечников. Артериальные тромбозы в целом встречаются примерно в 2 раза реже венозных. Они проявляются ишемией и инфарктами мозга, коронарных артерий, нарушениями периферического кровообращения. Тромбоз внутримозговых артерий — самая частая локализация артериального тромбоза при АФС. К редким проявлениям относится тромбоз крупных артерий, а также восходящего отдела аорты (с развитием синдрома дуги аорты) и брюшной аорты. Особенностью АФС является высокий риск рецидивирования тромбозов. При этом у больных с первым тромбозом в артериальном русле повторные эпизоды также развиваются в артериях. Если же первым тромбозом был венозный, то повторные тромбозы, как правило, отмечаются в венозном русле.
Поражение нервной системы относится к наиболее тяжелым (потенциально смертельным) проявлениям АФС и включает транзиторные ишемические атаки, ишемический инсульт, острую ишемическую энцефалопатию, эписиндром, мигрень, хорею, поперечный миелит, нейросенсорную тугоухость и другие неврологические и психиатрические симптомы. Ведущей причиной поражения ЦНС является ишемия мозга вследствие тромбоза мозговых артерий, однако выделяют ряд неврологических и нейропсихических проявлений, обусловленных другими механизмами. Транзиторные ишемические атаки (ТИА) сопровождаются потерей зрения, парестезиями, двигательной слабостью, головокружением, транзиторной общей амнезией и нередко за много недель и даже месяцев предшествуют инсульту. Рецидивирование ТИА ведет к мультиинфарктной деменции, которая проявляется когнитивными нарушениями, снижением способности к концентрации внимания и памяти и другими неспецифичными для АФС симптомами. Поэтому ее нередко трудно дифференцировать от сенильной деменции, метаболического (или токсического) поражения мозга и болезни Альцгеймера. Иногда ишемия мозга связана с тромбоэмболией, источниками которой служат клапаны и полости сердца или внутренняя сонная артерия. В целом частота ишемического инсульта выше у больных с поражением клапанов сердца (особенно левых отделов).
Головные боли традиционно рассматриваются как одно из наиболее частых клинических проявлений АФС. Характер головных болей варьирует от классических интермиттирующих мигренозных до постоянных, невыносимых болей. Имеется ряд других симптомов (синдром Гийена–Барре, идиопатическая внутричерепная гипертензия, поперечный миелит, паркинсонический гипертонус), развитие которых также ассоциируется с синтезом аФЛ. У больных с АФС нередко наблюдаются вено-окклюзивные заболевания глаз. Одной из форм такой патологии является преходящая потеря зрения (amaurosis fugax). Другое проявление — нейропатия зрительного нерва относится к числу самых частых причин слепоты при АФС.
Поражение сердца представлено широким спектром проявлений, включающих инфаркт миокарда, поражение клапанного аппарата сердца, хроническую ишемическую кардиомиопатию, внутрисердечный тромбоз, артериальную и легочную гипертензию. Как у взрослых, так и у детей тромбоз коронарных артерий является одним из основных локализаций артериальной окклюзии при гиперпродукции аФЛ. Инфаркт миокарда развивается приблизительно у 5% аФЛ-положительных больных, при этом он, как правило, встречается у мужчин моложе 50 лет. Самым частым кардиологическим признаком АФС является поражение клапанов сердца. Оно варьирует от минимальных нарушений, выявляемых только при эхокардиографии (небольшая регургитация, утолщение створок клапанов), до порока сердца (стеноз или недостаточность митрального, реже аортального и трикуспидального клапанов). Несмотря на большое распространение, клинически значимая патология, ведущая к сердечной недостаточности и требующая оперативного лечения, наблюдается редко (у 5% больных). Однако в некоторых случаях может быстро развиваться очень тяжелое поражение клапанов с вегетациями, обусловленными тромботическими наслоениями, неотличимое от инфекционного эндокардита. Выявление вегетаций на клапанах, особенно если они сочетаются с геморрагиями в подногтевое ложе и «барабанными пальцами», создает сложные диагностические проблемы и необходимость проведения дифференциального диагноза с инфекционным эндокардитом. В рамках АФС описано развитие сердечных тромбов, имитирующих миксому.
Почечная патология весьма разнообразна. У большинства пациентов наблюдается только бессимптомная умеренная протеинурия (менее 2 г в сут), без нарушения функции почек, но может развиваться острая почечная недостаточность с выраженной протеинурией (вплоть до нефротического синдрома), активным мочевым осадком и артериальной гипертонией. Поражение почек связано главным образом с внутриклубочковым микротромбозом и определяется как «почечная тромботическая микроангиопатия».
Больные с АФС имеют яркое и специфичное поражение кожи, в первую очередь сетчатое ливедо (встречающееся более чем у 20% больных), посттромбофлебитические язвы, гангрену пальцев рук и ног, множественные геморрагии в ногтевое ложе и другие проявления, обусловленные тромбозом сосудов.
При АФС встречаются поражение печени (синдром Бадда–Киари, узловая регенераторная гиперплазия, портальная гипертензия), желудочно-кишечного тракта (желудочно-кишечные кровотечения, инфаркт селезенки, тромбоз мезентериальных сосудов), опорно-двигательного аппарата (асептические некрозы костей).
К числу характерных проявлений АФС относится акушерская патология, частота которой может достигать 80%. Потеря плода может наступить в любые сроки беременности, но несколько чаще отмечается во II и III триместре. Кроме того, синтез аФЛ ассоциируется и с другими проявлениями, в том числе с поздним гестозом, преэклампсией и эклампсией, задержкой внутриутробного развития плода, преждевременными родами. Описано развитие тромботических осложнений у новорожденных от матерей с АФС, что свидетельствует о возможности трансплацентарной передачи антител.
Для АФС типична тромбоцитопения. Обычно количество тромбоцитов колеблется от 70 до 100 х109/л и не требует специального лечения. Развитие геморрагических осложнений наблюдается редко и, как правило, связано с сопутствующим дефектом специфических факторов свертывания крови, патологией почек или передозировкой антикоагулянтов. Нередко наблюдается Кумбс-положительная гемолитическая анемия (10%), реже встречается синдром Эванса (сочетание тромбоцитопении и гемолитической анемии).
Диагностические критерии
Полиорганность симптоматики и необходимость проведения специальных подтверждающих лабораторных тестов обусловливают в ряде случаев трудности в постановке диагноза АФС. В связи с этим в 1999 г. были предложены предварительные классификационные критерии, в соответствии с которыми диагноз АФС считается достоверным при сочетании, по крайней мере, одного клинического и одного лабораторного признака.
– один и более случаев внутриутробной гибели морфологически нормального плода после 10 нед беременности;
– один и более эпизодов преждевременных родов морфологически нормального плода до 34 нед беременности из-за выраженной преэклампсии, или эклампсии, или выраженной плацентарной недостаточности;
– три и более последовательных случаев спонтанных абортов до 10 нед беременности (при исключении анатомических дефектов матки, гормональных нарушений, материнских и отцовских хромосомных нарушений).
Дифференциальный диагноз
Дифференциальная диагностика АФС проводится с широким кругом заболеваний, протекающих с сосудистыми нарушениями. Следует помнить, что при АФС наблюдается очень большое количество клинических проявлений, которые могут имитировать различные заболевания: инфекционный эндокардит, опухоли сердца, рассеянный склероз, гепатит, нефрит и др. АФС в ряде случаев сочетается с системными васкулитами. Полагают, что АФС должен быть заподозрен при развитии тромботических нарушений (особенно множественных, рецидивирующих, с необычной локализацией), тромбоцитопении, акушерской патологии у лиц молодого и среднего возраста при отсутствии факторов риска возникновения этих патологических состояний. Его следует исключать при необъяснимом тромбозе у новорожденных, в случаях некроза кожи на фоне лечения непрямыми антикоагулянтами и у больных с удлиненным активированным частичным тромбопластиновым временем при скрининговом исследовании.
АФС вначале был описан как вариант системной красной волчанки (СКВ). Однако очень скоро было установлено, что АФС может развиваться и при других аутоиммунных ревматических и неревматических заболеваниях (вторичный АФС). Более того, оказалось, что связь между гиперпродукцией аФЛ и тромботическими нарушениями имеет более универсальный характер и может наблюдаться в отсутствие достоверных клинических и серологических признаков других заболеваний. Это послужило основанием для введения термина «первичный АФС» (ПАФС). Полагают, что примерно половина больных АФС страдают первичной формой заболевания. Однако является ли ПАФС самостоятельной нозологической формой до конца не ясно. Обращает на себя внимание высокая частота развития ПАФС среди мужчин (соотношение мужчин к женщинам составляет 2:1), что отличает ПАФС от других аутоиммунных ревматических заболеваний. Отдельные клинические проявления или их сочетания встречаются у больных с ПАФС с неодинаковой частотой, что, вероятно, связано с гетерогенностью самого синдрома. В настоящий момент условно выделяют три группы больных ПАФС:
Течение АФС, тяжесть и распространенность тромботических осложнений при нем непредсказуемы и в большинстве случаев не коррелируют с изменением уровня аФЛ и активностью заболевания (при вторичном АФС). У некоторых больных АФС может проявляться острой, рецидивирующей коагулопатией, часто в сочетании с васкулопатией, затрагивающей многие жизненно важные органы и системы. Это послужило основанием для выделения так называемого «катастрофического АФС» (КАФС). Для определения данного состояния предлагались названия «острая диссеминированная коагулопатия–васкулопатия» или «разрушительная невоспалительная васкулопатия», что также подчеркивает острый, фульминантный характер этого варианта АФС. Основным провоцирующим фактором КАФС является инфекция. Реже его развитие связано с отменой антикоагулянтов или приемом некоторых лекарственных препаратов. КАФС встречается примерно у 1% больных АФС, но несмотря на проводимую терапию в 50% случаев заканчивается летальным исходом.
Лечение АФС
Профилактика и лечение АФС представляют сложную проблему. Это обусловлено неоднородностью патогенетических механизмов, полиморфизмом клинических проявлений, а также отсутствием достоверных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромботических нарушений. Не существует общепринятых международных стандартов лечения, а предлагаемые рекомендации основаны главным образом на результатах открытых испытаний лекарственных препаратов или ретроспективного анализа исходов заболевания.
Лечение глюкокортикоидами и цитотоксическими препаратами при АФС, как правило, неэффективно, за исключением ситуаций, когда целесообразность их назначения продиктована активностью основного заболевания (например, СКВ).
Ведение больных с АФС (как и с другими тромбофилиями) основывается на назначении антикоагулянтов непрямого действия (варфарин, аценокумарол) и антиагрегантов (в первую очередь низких доз ацетилсалициловой кислоты – АСК). Это связано прежде всего с тем, что для АФС характерен высокий риск повторных тромбозов, значительно превосходящий таковой при идиопатических венозных тромбозах. Полагают, что большинство больных АФС с тромбозами нуждаются в профилактической антиагрегантной и/или антикоагулянтной терапии в течение длительного времени, а иногда и пожизненно. Кроме того, риск первичных и повторных тромбозов при АФС необходимо снижать путем влияния на такие корригируемые факторы риска, как гиперлипидемия (статины: симвастин — симвастол, симло; ловастатин — ровакор, кардиостатин; правастатин — липостат; аторвастатин — авас, липримар; фибраты: безафибрат — холестенорм; фенофибрат — нофибал, грофибрат; ципрофибрат — липанор), артериальная гипертензия (ингибиторы АПФ — капотен, синоприл, диротон, моэкс; b-блокаторы — атенолол, конкор, эгилок, беталок ЗОК, дилатренд; антагонисты кальция — амловас, норваск, нормодипин, лацидипин), гипергомоцистеинемия, малоподвижный образ жизни, курение, прием оральных контрацептивов и др.
У больных с высоким уровнем аФЛ в сыворотке, но без клинических признаков АФС (в том числе у беременных женщин без акушерской патологии в анамнезе) следует ограничиться назначением небольших доз АСК (50–100 мг/сут). Наиболее предпочтительны препараты аспирин кардио, тромбо АСС, обладающие рядом преимуществ (удобная дозировка и наличие оболочки, устойчивой к действию желудочного сока). Такая форма позволяет обеспечивать не только надежный антиагрегантный эффект, но и уменьшить неблагоприятное действие на желудок.
Больные с клиническими признаками АФС (в первую очередь с тромбозами) нуждаются в более агрессивной антикоагулянтной терапии. Лечение антагонистами витамина К (варфарин, фенилин, аценокумарол) несомненно более эффективный, но менее безопасный (по сравнению с АСК) метод профилактики венозных и артериальных тромбозов. Применение антагонистов витамина К требует тщательного клинического и лабораторного контроля. Во-первых, это связано с увеличением риска кровоточивости, а риск развития данного осложнения из-за его тяжести превосходит пользу от профилактики тромбоза. Во-вторых, у части больных рецидивирование тромбоза отмечается после прекращения терапии антикоагулянтами (особенно в течение первых 6 мес после отмены). В-третьих, у больных АФС могут наблюдаться выраженные спонтанные колебания международного нормализованного отношения (МНО), что значительно затрудняет использование этого показателя для мониторинга лечения варфарином. Однако все вышеперечисленное не должно являться препятствием для проведения активной антикоагулянтной терапии у тех больных, которым она жизненно необходима (табл. 2).
Схема лечения варфарином заключается в назначении насыщающей дозы (5–10 мг препарата в день) в течение первых двух дней, а затем в подборе оптимальной дозировки, обеспечивающей поддержание целевого МНО. Всю дозу целесообразно принимать в утренние часы, до определения МНО. У лиц пожилого возраста для достижения того же уровня антикоагуляции следует использовать более низкие дозы варфарина, чем у молодых. Необходимо иметь в виду, что варфарин взаимодействует с рядом лекарственных препаратов, которые при сочетанном назначении как снижают (барбитураты, эстрогены, антациды, противогрибковые и противотуберкулезные препараты), так и усиливают его антикоагулянтное действие (нестероидные противовоспалительные средства, антибиотики, пропранолол, ранитидин и др.). Следует дать определенные рекомендации по поводу диеты, так как богатая витамином К пища (печень, зеленый чай, листовые овощи — брокколи, шпинат, брюссельская и кочанная капуста, репа, салат-латук) способствует развитию резистентности к варфарину. Во время терапии варфарином исключается алкоголь.
При недостаточной эффективности монотерапии варфарином возможно проведение комбинированной терапии непрямыми антикоагулянтами и низкими дозами АСК (и/или дипиридамолом). Такое лечение наиболее оправдано у лиц молодого возраста без факторов риска кровотечений.
В случае избыточной антикоагуляции (МНО>4) при отсутствии кровотечения рекомендуется временно отменить варфарин до возвращения МНО к целевому уровню. В случае гипокоагуляции, сопровождающейся кровотечениями, недостаточно назначения только витамина К (вследствие отсроченного начала действия — через 12–24 ч после введения); рекомендуется свежезамороженная плазма или (что предпочтительнее) концентрат протромбинового комплекса.
Аминохинолиновые препараты (гидроксихлорохин — плаквенил, хлорохин — делагил) могут обеспечивать довольно эффективную профилактику тромбозов (по крайней мере, при вторичном АФС на фоне СКВ). Наряду с противовоспалительным действием, гидроксихлорохин обладает определенным антитромботическим (подавляет агрегацию и адгезию тромбоцитов, уменьшает размер тромба) и гиполипидемическим эффектами.
Центральное место в лечении острых тромботических осложнений при АФС занимают прямые антикоагулянты — гепарин и особенно препараты низкомолекулярного гепарина (фраксипарин, клексан). Тактика их применения не отличается от общепринятой.
При КАФС используется весь арсенал методов интенсивной и противовоспалительной терапии, применяемой при критических состояниях у пациентов с ревматическими заболеваниями. Эффективность лечения в определенной степени зависит от возможности устранить факторы, провоцирующие его развитие (инфекция, активность основного заболевания). Назначение высоких доз глюкокортикоидов при КАФС направлено не на лечение тромботических нарушений, но определяется необходимостью терапии синдрома системного воспалительного ответа (распространенный некроз, дистресс-синдром взрослых, надпочечниковая недостаточность и др.). Обычно проводится пульс-терапия по стандартной схеме (1000 мг метилпреднизолона внутривенно в день в течение 3–5 дней) с последующим назначением глюкокортикоидов (преднизолон, метилпреднизолон) перорально (1–2 мг/кг/сут). Внутривенный иммуноглобулин вводят в дозе 0,4 г/кг в течение 4–5 дней (особенно эффективен он при тромбоцитопении).
КАФС является единственным абсолютным показанием для проведения сеансов плазмафереза, которые следует сочетать с максимальной интенсивной антикоагулянтной терапией, использованием свежезамороженной плазмы и проведением пульс-терапии глюкокортикоидами и цитостатиками. Циклофосфамид (цитоксан, эндоксан) (0,5–1 г/сут) показан при развитии КАФС на фоне обострения СКВ и для предотвращения «синдрома рикошета» после проведения сеансов плазмафереза. Оправдано использование простациклина (5 нг/кг/мин в течение 7 дней), однако ввиду возможности развития «рикошетных» тромбозов лечение должно проводиться с осторожностью.
Назначение глюкокортикоидов женщинам с акушерской патологией в настоящее время не показано, в связи с отсутствием данных о преимуществах такого вида терапии и из-за большой частоты побочных эффектов у матери (синдром Кушинга, диабет, артериальная гипертензия) и плода. Применение глюкокортикоидов оправдано только при вторичном АФС на фоне СКВ, поскольку направлено на лечение основного заболевания. Использование непрямых антикоагулянтов при беременности в принципе противопоказано ввиду их тератогенного действия.
Стандартом профилактики рецидивирующих потерь плода являются малые дозы АСК, которые рекомендуется принимать до, в течение беременности и после рождения ребенка (по крайней мере, в течение 6 мес). Во время беременности малые дозы АСК желательно комбинировать с препаратами низкомолекулярного гепарина. При родоразрешении с помощью кесарева сечения введение низкомолекулярных гепаринов отменяется за 2–3 дня и возобновляется в послеродовом периоде с последующим переходом на прием непрямых антикоагулянтов. Длительная терапия гепарином у беременных женщин может приводить к развитию остеопороза, поэтому для уменьшения потери костной массы необходимо рекомендовать прием карбоната кальция (1500 мг) в сочетании с витамином D. Следует иметь в виду, что лечение низкомолекулярным гепарином реже вызывает остеопороз. Одним из ограничений к применению низкомолекулярных гепаринов является опасность развития эпидуральной гематомы, поэтому, если существует вероятность преждевременного родоразрешения, лечение низкомолекулярными гепаринами прекращается не позднее 36 нед беременности. Применение внутривенного иммуноглобулина (0,4 г/кг в течение 5 дней каждый месяц) не имеет преимуществ перед стандартным лечением АСК и гепарином, и показано только при неэффективности стандартной терапии.
Умеренная тромбоцитопения у больных АФС не требует специального лечения. При вторичном АФС тромбоцитопения хорошо контролируется глюкокортикоидами, аминохинолиновыми препаратами и в некоторых случаях — низкими дозами АСК. Тактика лечения резистентной тромбоцитопении, создающей угрозу кровотечений, включает применение глюкокортикоидов в высоких дозах и внутривенного иммуноглобулина. В случае неэффективности высоких доз глюкокортикоидов методом выбора является спленэктомия.
В последние годы интенсивно разрабатываются новые антитромботические агенты, к которым относят гепариноиды (гепароид лечива, эмеран, сулодексид — вессел дуэ), ингибиторы тромбоцитарных рецепторов (тиклопидин, тагрен, тиклопидин-ратиофарм, клопидогрель, плавикс) и другие препараты. Предварительные клинические данные свидетельствуют о несомненной перспективности этих лекарственных средств.
Все больные АФС должны находиться под длительным диспансерным наблюдением, первоочередной задачей которого является оценка риска рецидивирования тромбозов и их профилактика. Необходим контроль активности основного заболевания (при вторичном АФС), своевременное выявление и лечение сопутствующей патологии, в том числе инфекционных осложнений, а также воздействие на корригируемые факторы риска тромбозов. Установлено, что прогностически неблагоприятными факторами в отношении летальности при АФС являются артериальные тромбозы, высокая частота тромботических осложнений и тромбоцитопения, а из лабораторных маркеров — наличие волчаночного антикоагулянта. Течение АФС, тяжесть и распространенность тромботических осложнений непредсказуемы; универсальные схемы терапии, к сожалению, отсутствуют. Вышеупомянутые факты, а также полиорганность симптоматики требуют объединения врачей различных специальностей для решения проблем, связанных с ведением данной категории больных.
Н. Г. Клюквина, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва