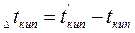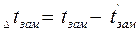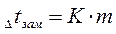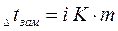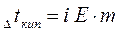Чем можно объяснить что растворение некоторых твердых веществ сопровождается выделением теплоты
Растворение твердых веществ, выделение и поглощение тепла.
Для эффективности растворения важно, чтобы силы сцепления между молекулами растворителя и частицами растворяемого вещества были больше сил взаимного притяжения этих частиц между собой. Вода по сравнению с другими растворителями обладает огромной полярностью (самое высокое значение диэлектрической постоянной). Именно этим свойством обуславливается высокая ионизирующая способность воды и ее разрушительное действие на кристаллические решетки многих полярных соединений
При растворении кристаллических веществ наблюдается поглощение или выделение теплоты. Поглощение теплоты указывает на затрату энергии, объясняется это тем, что на перевод вещества из твердого состояния в жидкое, т. е. на разрушение кристаллической решетки вещества, обязательно расходуется энергия. Например, ионы натрия и хлора до растворения натрия хлорида в воде фиксированы в узлах кристаллической решетки, обладая при этом только вращательными и колебательными движениями. После растворения, ионы получают возможность относительно свободно двигаться внутри раствора, для чего необходимо увеличение их кинетической энергии. Увеличение ее происходит за счет отнятия энергии у растворителя в форме тепла, в результате чего происходит охлаждение раствора. Чем прочнее кристаллическая решетка, тем значительнее охлаждение раствора.
———————————————————————————————————————————
Во втором абзаце говорится о увеличении кинетической энергии, и из этого следует что вещество охлаждается. Но как если кинетическая энергия в любом случае перейдет в другой вид энергии, то есть тепло?
Тепловые явления при растворении. Гидратация ионов



Тепловые явления при растворении. Гидратация ионов
Она получила дальнейшее развитие при изучении Kistyakovsky. Людмила Фирмаль
Особую осторожность следует проявлять при растворении серной кислоты, так как из-за повышенной температуры часть воды может превратиться в пар, а кислота может выделиться из емкости под ее воздействием. pressure. To избегайте этого, влейте серную кислоту в воду тонкой струйкой, постоянно помешивая (и наоборот! это не. Например, если тонкостенный стакан аммиачной селитры, который помещают на влажную тарелку, растворить в воде, то охлаждение будет интенсивным, и стекло может даже замерзнуть(рис.88).
Почему при растворении веществ наблюдается обратное явление? На этот вопрос можно ответить, опираясь на положения атомно-молекулярной теории(I, с. 27). При растворении твердые частицы распределяются между молекулами solvent. In в этом случае необходимая энергия поглощается извне и происходит охлаждение. Исходя из этого, процесс растворения следует отнести к физическим явлениям. Рис.87.
Нагревание во время растворения 88.Охлаждение, когда некоторые вещества растворяются в воде. Некоторые вещества в воде. Почему растворение некоторых веществ вызывает нагревание? Выделение тепла (I, 10) является признаком химической реакции. Поэтому при растворении также осуществляется химическая реакция. Например, молекулы серной кислоты вступают в реакцию с молекулами воды, образуя соединения в составе H2S04•Н20 (моногидрат серной кислоты) и H2S04•2Н20 (дигидрат серной кислоты).
Молекулы серной кислоты связываются с 1 или 2 молекулами воды1. Взаимодействие молекул воды с молекулами серной кислоты относится к реакции гидратации (I, 91), и образующееся вещество называется гидратами. Когда твердое вещество растворяется в воде, происходят как физические, так и химические процессы. Если в результате гидратации выделяется больше энергии, чем тратится на разрушение кристалла вещества, то растворение сопровождается нагревом, а в обратном случае-охлаждением. _
Растворение-это физико-химический процесс, а раствор-это физико-химическая система. Такое объяснение сущности процесса растворения и природы раствора впервые было теоретически продемонстрировано великим русским ученым Д. И. Менделеевым•Он разработал теорию гидратации растворов. Кристаллогидрат. Когда раствор испаряется, вещество часто отделяется в виде кристаллов, содержащих химически связанные water.
Сульфаты из сульфата меди (II) выражаются следующим уравнением: Cu SO Людмила Фирмаль
Вода, которая является частью кристалла, называется кристаллической водой. Многие вещества образуют кристаллогидраты. Например, FeS04•7H20-кристаллогидрат сульфата железа (II) (сульфат железа), CaS04•2H20-кристаллогидрат сульфата кальция (гипс), Na2CO3•10H20-кристаллогидрат карбоната натрия(кристаллическая сода).
При изучении процесса гидратации у ученых возникает вопрос: какие частицы, молекулы или ионы вступают в реакцию с водой? И. А. Кабульков предположил, что ионы электролита вступают в реакцию с молекулами воды, то есть происходит гидратация ионов. Это было далее полностью подтверждено. Так, например, было обнаружено, что сульфат меди безводный (II) CuSO4 не содержит цветков. Безводные Cu2 +и S04-ионы также бесцветны.
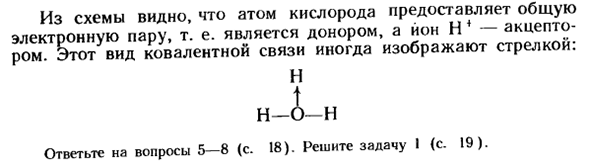
Также за счет диссоциации молекул кислот образуются не свободные ионы водорода, а их гидраты — гидроксониевые ионы: n * + Hr0-H30 + Диссоциацию молекул кислоты можно объяснить образованием дополнительного ковалента bonds. It характеризуется тем, что оба атома не дают общей пары связанных электронов, а только 1 из них.
Атом, дающий общую связную электронную пару, называется донором, а атом, который ее приобретает, — акцептором, и механизм этой реакции-донор-акцептор. Образование ионов гидроксония при диссоциации молекул соляной кислоты схематично показано следующим образом:
Н Н: Б: и Н: ИЦ:+ и: о: и-•••• Или нсl + Н2О — ^ h3o ++ ки ’ Этот рисунок показывает, что атом кислорода обеспечивает общую пару электронов, то есть атом кислорода является донором, а Ион H4-акцептором. отот-это тип ковалентного соединения, обозначенный стрелкой. Н л Н Вопрос 5-8 (стр. 18).Решите задачу I (стр. 19).
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Тепловые эффекты при растворении веществ
Содержание:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 11.05.2019 |
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Как правило, при растворении тепло поглощается или выделяется, а объем раствора изменяется. Это объясняется тем, что при растворении вещества происходит два процесса: разрушение структуры растворяемого вещества и взаимодействие частиц растворителя с частицами растворенного вещества. Оба эти процесса сопровождаются различными изменениями энергии. Энергия требуется для разрушения структуры растворенного вещества, тогда как энергия высвобождается, когда частицы растворителя взаимодействуют с частицами растворенного вещества. В зависимости от соотношения этих тепловых эффектов процесс растворения вещества может быть эндотермическим или экзотермическим. Тепловые эффекты растворения разных веществ различны. Так, когда серная кислота растворяется в воде, выделяется значительное количество тепла, аналогичное явление наблюдается, когда безводный сульфат меди растворяется в воде (экзотермические реакции). Когда нитрат калия или нитрат аммония растворяются в воде, температура раствора резко падает (эндотермические процессы), а когда растворяется хлорид натрия в воде, температура раствора практически не изменяется.
Классификация решений
Растворитель и раствор. Общие свойства истинных решений. Насыщенный, перенасыщенный и ненасыщенный раствор. Методы выражения состава раствора (массовая доля вещества в растворе, молярная концентрация, нормальная концентрация). Физическая теория решений Дж. Вант Хоффа и С. Аррениуса. Химическая теория растворов Д.И.Менделеева. Сольваты, гидраты, кристаллогидраты, кристаллизационная вода. Растворение веществ как физико-химический процесс. Тепловой эффект процесса растворения. Растворимость веществ. Факторы, влияющие на растворимость веществ. Электролиты и неэлектролиты. Теория электролитической диссоциации С. Аррениуса. Степень электролитической диссоциации. Зависимость степени диссоциации от природы электролита, природы растворителя, концентрации и температуры раствора. Кажущаяся степень диссоциации сильных электролитов. Константа электролитической диссоциации. Диссоциация воды. Ионный продукт воды. Водородный показатель. Уравнения ионно-молекулярной реакции. Гидролиз соли. Факторы, влияющие на процесс гидролиза. Степень и константа гидролиза.
Растворение происходит самопроизвольно (DS O и AS 0), поэтому с увеличением температуры их растворимость увеличивается.
Как вы можете объяснить различные значения тепловых эффектов растворения твердых веществ.
Значение AH.idr можно рассчитать, используя известные значения энтальпии других процессов. Итак, растворение ионного соединения может быть представлено в виде двух стадий: разрушения кристаллической решетки на свободные ионы и гидратации ионов. Тогда, согласно закону Гесса, тепловой эффект (энтальпия) растворения DYArasty можно представить в виде алгебраической суммы энергии (энтальпии) разрушения кристаллической решетки AR. и энтальпия гидратации ионов DNahid.
Температура обычно увеличивается с ростом температуры, но есть и обратная зависимость. Влияние температуры зависит от теплового эффекта процесса растворения и от изменения энтропии в этом процессе.
Влияние молекулярной массы полимера на тепловой эффект процесса растворения зависит от физического состояния полимера. Для высокоэластичных полимеров плотность упаковки и, следовательно, энергия межмолекулярных взаимодействий не зависят от молекулярного веса благодаря гибкости макромолекул; следовательно, тепловой эффект растворения одинаков для полимеров с различной длиной цепи. Для стеклообразных полимеров с увеличением молекулярной массы плотность упаковки полимерных цепей уменьшается, полимер становится более рыхлым, энергия межмолекулярного взаимодействия уменьшается, а термический эффект растворения увеличивается.
Мы находим противоположную картину для фторидов щелочноземельных металлов. Например, I MgF = 689 ккал, и хотя теплота гидратации превышает эту величину на 10 ккал, то есть составляет 699 ккал, тем не менее фторид магния нерастворим в воде. Объяснение этого неожиданного поведения состоит в том, что энтропия ионов уменьшается по мере того, как они переходят в раствор. Это, в свою очередь, приводит к снижению теплового эффекта процесса растворения (точнее, его абсолютного значения) примерно на 15 ккал, что определяет практически полную нерастворимость этой соли.
Безводный хлорид алюминия сильно испаряется в воздухе и с шипением растворяется в воде. Объясните причину этих явлений. Рассчитать тепловой эффект процесса растворения хлорида алюминия.
В процессе растворения твердого кристаллического вещества энергия, затрачиваемая на разрушение кристаллической решетки, компенсируется выделением энергии взаимодействия молекул или ионов с растворителем. Количественное соотношение расходуемой и выделяемой энергии определяет тепловой эффект процесса растворения. Например, энергия электростатического взаимодействия ионов натрия и хлора в кристалле хлорида натрия очень высока, и для образования свободных ионов при разрушении одного моля Na 1 потребуется энергия, равная 197 000 калорий. Однако из-за выделения теплоты гидратации ионов наблюдается очень небольшой эффект при растворении хлорида натрия.
Для аналогичных веществ (например, для газов с низкой полярностью) растворимость обычно естественным образом уменьшается с увеличением эндотермичности теплового эффекта процесса растворения.
Для большинства физико-химических расчетов необходимо знать теплоемкость веществ, участвующих в процессе, тепловые эффекты процессов растворения, фазовых превращений и химических реакций. Эти значения могут быть измерены экспериментально. При температурах, близких к комиатным (20-50 ° С), широко используется калориметрический метод.
Растворимость твердых веществ зависит от теплового эффекта процесса растворения. Если он является эндотермическим, то при повышении температуры их растворимость увеличивается в соответствии с принципом Ле-Шателье.
В зависимости от соотношения величины этих тепловых эффектов процесс растворения вещества может быть эндо- и экзотермическим.
Количество тепла, поглощаемое или выделяемое при растворении одного моля вещества в избытке растворителя, называется теплотой растворения этого вещества.
Концентрация решений
Концентрация растворения относится к количеству растворенного вещества, содержащемуся в определенном количестве или в определенном объеме раствора или растворителя.
В химии наиболее часто используются следующие способы выражения концентрации.
Процентная концентрация. Показывает количество граммов растворенного вещества, содержащегося в 100 г раствора. Например, 15% водный раствор соли представляет собой такой раствор, 100 г которого содержит 15 г соли и 85 г воды.
Вывод:
Молярная концентрация (молярность). Показывает количество молей растворенного вещества, содержащегося в 1 литре раствора, обозначенное в моль / л или формуле вещества, заключенной в квадратные скобки. Например, [NaOH] = 2 моль / л представляет собой раствор, содержащий 2 моль (или 80 г) гидроксида натрия в одном литре раствора.
Эквивалент (обозначенный буквой E) представляет собой действительную или условную частицу вещества, которая может заменить, добавить, высвободить или каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительные реакции.
Кислотный эквивалент равен молярной массе кислоты, деленной на ее основность, то есть на число атомов водорода в молекуле кислоты, которая может быть заменена металлом.
Присылайте задания в любое время дня и ночи в ➔ 
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Энергетика процесса растворения.
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко увеличивается число микросостояний системы. Очевидно, при растворении кристаллов происходит их разрушение, что требует затраты энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворенным веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется на разрушение кристаллической решетки.
Важной физико-химической характеристикой растворов является температура кипения и замерзания. Каждое вещество характеризуется определенными температурами кипения и плавления (или кристаллизации). Так, вода при нормальном атмосферном давлении (101,3 кПа) кристаллизуется при 0°С и кипит при 100°С. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора 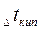
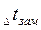
где 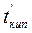
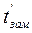
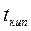
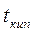
Для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорционально концентрации раствора (закон Рауля):
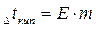
Параметры растворов электролитов, зависящие от концентрации, такие, как давление пара, понижение температуры замерзания, осмотическое давление, повышение температуры кипения, не подчиняются закону Рауля, так как диссоциация электролита приводит к тому, что общее чис о частиц растворенного вещества в растворе возрастает по сравнению с раствором неэлектролита той же концентрации. Для количественного описания изменения некоторых свойств растворов электролитов Вант-Гоффом был введен изотонический коэффициент. Таким образом, для электролитов:
Физический смысл изотонического коэффициента:
3.2 Два вида электролитов: сильные и слабые электролиты. Электролитическая диссоциация в водных растворах. Ионное произведение воды. Водородный показатель.
ТЕПЛОВОЙ ЭФФЕКТ РАСТВОРЕНИЯ
Раствором называют гомогенную систему, состоящую из двух или большего числа компонентов. При переходе вещества в раствор происходит разрыв межмолекулярных и ионных связей кристаллической решетки твердого вещества и переход его в раствор в виде отдельных молекул или ионов, которые равномерно распределяются среди молекул растворителя.
Для разрушения кристаллической решетки вещества необходимо затратить большую энергию. Эта энергия освобождается в результате гидратации (сольватации) ионов и молекул, т. е. химического взаимодействия растворяемого вещества с водой (или вообще с растворителем).
Значит, растворимость вещества зависит от разности величин энергии гидратации (сольватации) и энергии кристаллической решетки вещества.
Общий тепловой эффект растворения зависит от тепловых эффектов:
· а) разрушения кристаллической решетки (процесс всегда идет с затратой энергии ∆Н1>0);
· б) диффузии растворенного вещества в растворителе (затрата энергии ∆Н2>0);
· в) сольватации (гидратации) (выделение теплоты, ∆Н3
Общий тепловой эффект растворения ∆Нp будет равен сумме названных тепловых эффектов
Энергия растворения определяется по формуле 1.1:
веществом (энергия сольватации), кДж/моль;
Если энергия разрушения кристаллической решетки больше энергии сольватации, то процесс растворения будет эндотермическим процессом, поскольку энергия, затраченная на разрушение кристаллической структуры, не будет скомпенсирована энергией, выделяющейся при сольватации.
Если энергия разрушения кристаллической решетки меньше энергии сольватации, то процесс растворения будет экзотермическим процессом, поскольку энергия затраченная на разрушение кристаллической структуры полностью скомпенсирована энергией, выделяющейся при сольватации. Следовательно, в зависимости от соотношения между энергией разрушения кристаллической решетки растворенного вещества и энергией взаимодействия растворенного вещества с растворителем (сольватация) энергия растворения может быть как положительной, так и отрицательной величиной.
Так, при растворении в воде хлорида натрия температура практически не изменяется, при растворении нитрата калия или аммония температура резко снижается, а при растворении гидроксида калия или серной кислоты температура раствора резко повышается.
Растворение твердых веществ в воде чаще бывает процессом эндотермическим, так как во многих случаях при гидратации выделяется теплоты меньше, чем тратится на разрушение кристаллической решетки.
Энергию кристаллической решетки можно рассчитать теоретически. Однако для теоретического расчета энергии сольватации до сих пор нет надежных методов.
Существуют некоторые закономерности, которые связывают растворимость веществ с их составом.
Для солей одного и того же аниона с разными катионами (или наоборот) растворимость будет наименьшей в том случае, когда соль образована ионами одинакового заряда и примерно одинакового размера, т.к. в этом случае энергия ионной кристаллической решетки максимальна.
Растворимость гидроксидов этих элементов, наоборот, увеличивается от магнию к бария, потому что радиусы катионов магния и анионов гидроксида практически одинаковые, а катионы бария по размеру очень отличаются от небольших анионов гидроксила.
Однако бывают исключения, например, для оксалатов и карбонатов кальция, стронция, бария и др.
Энергию растворения можно рассчитать:
1) используя изменение температуры при растворении.
Количество энергии, выделяющейся при нагревании или охлаждении тела рассчитывается по уравнению (1.2):

где ∆Нраств. – энергия растворения вещества, кДж/моль;
∆Т – изменение температуры, град.
Решение:
Для определения энтальпии растворения NH4C1 составляем пропорцию, М (NH4C1)=53,49 г/моль:
8г NH4Cl — 2436,8 Дж
х = 1629,3Дж = 16,3кДж. Следовательно, растворение NH4C1 сопровождается поглощением тепла.
2) используя следствие из закона Гесса: тепловой эффект химической реакции (ΔН 0 х.р.) равен сумме теплот (энтальпий) образования продуктов реакции (ΔH 0 o6р..npoд.) минус сумма теплот (энтальпий) образования исходных веществ (ΔН 0 обр.исх.) с учётом коэффициентов перед формулами этих веществ в уравнении реакции.
Решение: Реакция растворения А1 в соляной кислоте протекает по уравнению 2А1+6НС1(aq)=2AlCl3(aq)+3H2. Поскольку алюминий и водород являются простыми веществами, то для них ΔН 0 =0 кДж/моль, то тепловой эффект реакции растворения равен:
Используя следствие из закона Гесса можно определить возможность протекания реакции растворения. В этом случае необходимо рассчитать энергию Гиббса.
Решение. Для ответа необходимо подсчитать ∆G 0 298 реакции растворения. Возможная реакция растворения CuS в разбавленной H2SO4 протекает по уравнению:
Так как ∆G>0, реакция невозможна, т. е. CuS не будет растворяться в разбавленной H2SO4.
Зная энергию растворения можно рассчитать энергию присоединения кристаллизационной воды (энергию гидратации).
ПРИМЕР 1.4. При растворении 52,06г ВаС12 в 400 моль Н2О выделяется 2,16 кДж теплоты, а при растворении 1 моль ВаС12∙2Н2О в 400 моль Н2О поглощается 18,49 кДж теплоты. Вычислите теплоту гидратации безводного ВаС12,
Решение. Процесс растворения безводного ВаС12 можно представить следующим образом:
а) гидратация безводной соли ВаС12
Для вычисления теплоты гидратации безводного хлорида бария надо определить теплоту растворения ВаС12 для тех же условий, что и для ВаС12∙2Н2О, т. е. для 1 моль ВаС12 (раствор в обоих случаях должен иметь одинаковую концентрацию); M(BaCl2)=208,25 г/моль
х=8,64 кДж/моль. Следовательно, ∆Нраств=-8,64 кДж/моль.
Тогда ∆Нгидр=18,49+8,64 =27,13 кДж/моль.
РАСТВОРИМОСТЬ
Самый распространенный жидкий растворитель – вода. Она обладает наиболее растворяющей и диссоциирующей способностью. Для воды температура растворения ограничивается интервалом 0–100 0 С.
Большинство растворяющихся в воде веществ являются твердыми.
Процесс растворения вещества сопровождается диффузией, т.е. перемещением молекул из областей более концентрированного раствора в области с меньшей его концентрацией. Другими словами, вещество при растворении равномерно распределяется по всей массе растворителя.
Процесс растворения происходит до тех пор, пока концентрация данного вещества в растворе не доходит до определенного значения, при котором наступает состояние равновесия:
твердая фаза раствор
Способность твердого вещества переходить в раствор не беспредельна. При введении в стакан с водой (Т= const) первые порции вещества полностью растворяются, и образуется ненасыщенный раствор. В этом растворе возможно растворение следующих порций до тех пор, пока вещество не перестанет переходить в раствор и часть его останется в виде осадка на дне стакана.
Растворение является двунаправленным процессом: твердое вещество переходит в раствор, а растворенное вещество в свою очередь переходит в твердую фазу. Если количество вещества, переходящего в раствор за единицу времени, равно количеству вещества, выделяющегося за то же время в твердую фазу, то это значит, что произошло насыщение раствора. Образующийся при этом раствор называется насыщенным раствором. Увеличение концентрации раствора замедляет установление равновесия.
Между веществом в насыщенном растворе и веществом в осадке устанавливается состояние гетерогенного равновесия. Частицы растворенного вещества переходят через поверхность раздела их жидкой фазы (раствора) в твердую фазу (осадок) и обратно, поэтому состав насыщенного раствора остается постоянным при некоторой фиксированной температуре. Насыщенные растворы являются стабильными системами, т. е. они могут существовать при данной температуре без изменения концентрации сколь угодно долго.
С изменением температуры изменяется и концентрация насыщенного раствора. При понижении температуры раствор может в определенных условиях некоторое время сохранять данную концентрацию вещества, т. е. концентрация раствора может оказаться выше, чем в насыщенном растворе при данной температуре. Такие растворы называют пересыщенными. Пересыщенные растворы являются нестабильными системами. Достаточно перемешать такой раствор или бросить самый маленький кристаллик растворенного вещества (затравку), чтобы начала выделяться твердая фаза. Этот процесс продолжается до тех пор, пока концентрация вещества не достигнет концентрации насыщенного раствора при данной температуре. Возможность существования пересыщенного раствора объясняется трудностью возникновения центров кристаллизации.
В растворах электролитов непрерывно происходят процессы ионизации и ассоциации. При этом поддерживается равновесие, сохраняется постоянным состав раствора, но процесс электролитической диссоциации не прекращается. Если же в раствор ввести некоторое другое вещество, то его ионы могут вступить в реакцию с первым веществом и образовать новое вещество, которое не вводилось в раствор. Например, в отдельно приготовленных растворах хлорида бария и сульфата натрия устанавливается равновесие:
Оба эти соединения представляют собой соли и относятся к сильным электролитам, т. е. в разбавленных растворах эти вещества находятся преимущественно в виде ионов. Если слить эти два раствора, то ионы SО4 2- встретятся не только с ионами натрия, но и с ионами бария и вступят с ними в реакцию:
Эта реакция происходит, так как сульфат бария является малорастворимым соединением и выпадает в осадок. В растворе останутся катионы натрия и анионы хлора,- но осадка не образуется, потому что хлорид натрия хорошо растворим в воде.
Осаждение в химическом анализе следует проводить так, чтобы образовывалось по возможности меньшее количество мелких кристаллов (зародышей), тогда при постепенном прибавлении осадителя будут нарастать имеющиеся центры кристаллизации, т. е. будут расти крупные кристаллы.
Растворимость вещества – качественная и количественная способность вещества образовывать раствор при смешивании с другим веществом (растворителем).
Растворимость веществ определяется концентрацией насыщенного при данной температуре раствора.
Состав насыщенного раствора может быть выражен любым известным способом (массовая доля, молярная концентрация и др.). Чаще других величин применяют коэффициент растворимости ks — отношение массы безводного растворенного вещества к массе растворителя, например, при 20 0 С коэффициент растворимости равен 0,316 для KNО3, что соответствует 24,012%-ному или 2,759М раствору.
Растворимость часто выражают количеством граммов растворяемого вещества в 100г растворителя.
ПРИМЕР 2.1 Вычислите коэффициент растворимости ВаС12 в воде при 0 0 С, если при этой температуре в 13,1г раствора содержится 3,1г ВаС12.
Решение. Коэффициент растворимости выражают массой вещества (г), которое можно растворить в 100г растворителя при данной температуре. Масса раствора ВаС12 13,1г. Следовательно, в 10г растворителя при 0 0 С содержится 3,1г ВаС12. Коэффициент растворимости ВаС12 при 0 0 С равен:
В случае растворения твердых или жидких веществ в жидкостях растворимость возрастает с повышением температуры, а для газов – убывает. На растворимость газов большое влияние оказывает давление.
По растворимости при Т = const различают:
1) хорошо растворимые вещества (образуют >0,1М насыщенные растворы),
Растворимость вещества зависит от его природы и агрегатного состояния до растворения, а также от природы растворителя и температуры приготовления раствора, а для газов также и от давления.