Чем можно заменить роаккутан
АКНЕ: патогенез и современные методы лечения
Угревую болезнь (акне) относят к числу часто встречающихся в практике врача-дерматолога заболеваний кожи. Дебют заболевания обычно проявляется у девочек в возрасте от 12 до 14 лет, у мальчиков — в 14–15 лет.
Угревую болезнь (акне) относят к числу часто встречающихся в практике врача-дерматолога заболеваний кожи. Дебют заболевания обычно проявляется у девочек в возрасте от 12 до 14 лет, у мальчиков — в 14–15 лет. В этом возрасте возможны два варианта течения заболевания — «физиологические» акне и «клинические» акне, наблюдаемые у 15% пациентов, которые требуют назначения лечения. У 7% пациентов возможно развитие поздних акне, возникающих после 40 лет [1, 3, 5].
Угревая болезнь нередко является одним из осложнений жирной или смешанной форм себореи. У значительной части больных угревая болезнь склонна к хроническому течению, частым рецидивам и нередко оказывается резистентной к проводимой терапии.
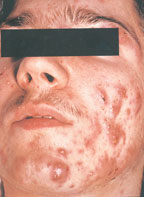
Патоморфологически вульгарные угри представляют собой гнойное воспаление сальной железы и перигландулярной ткани. Принято различать несколько клинических разновидностей этого заболевания. К более легким и относительно благоприятно протекающим формам относят вульгарные или юношеские, папулезные и пустулезные угри. Они легче поддаются лечению и обычно не оставляют после себя грубых рубцовых изменений на коже. Напротив, индуративные, сливные, флегмонозные и конглобатные угри в связи с резистентностью к проводимой терапии, частыми рецидивами и возникновением при этих формах грубых косметических дефектов представляют для врача и больного сложную медицинскую и социально-психологическую проблему [3].
Психоэмоциональные расстройства выявляются у 40–50% пациентов с угревой болезнью, ведущим является нозогенная депрессия невротического уровня, чаще протекающая по астено-тревожному и тревожному типам. Наибольшая частота психоэмоциональных расстройств наблюдается при II–III степени тяжести акне, при этом характерна обратная зависимость выраженности психоэмоциональных расстройств от степени тяжести и длительности болезни [2].
Поэтому важным для практического врача является ранняя диагностика, правильная клиническая оценка, своевременное назначение эффективных и безопасных препаратов в зависимости от клинической формы заболевания, что позволяет избежать состояния дисморфофобии, неудач в лечении и улучшить качество жизни больных.
Патогенез акне является мультифакторным. На сегодняшний день выделяют четыре ведущих фактора в этиологии заболевания: фолликулярный гиперкератоз, увеличение количества Propionibacterium acnes, изменение продукции кожного сала и воспаление.
Начальным этапом формирования заболевания является появление микрокомедонов, которые в дальнейшем колонизируются Propionibacterium acnes. Микрокомедоны являются результатом развития двух процессов — гиперпролиферации кератиноцитов акроворонки волосяного фолликула и избыточной продукции кожного сала, что в сочетании приводит к закупорке фолликула и формированию открытых и закрытых комедонов. Для кератиноцитов характерно увеличение тонофиламентов и десмосом, повышенное количество кератинов К6 и К16 [9].
Propionibacterium acnes являются анаэробными резидентными представителями микрофлоры кожи человека, способными проявлять свои патогенные свойства только в определенных условиях. Propionibacterium acnes участвуют в развитии воспаления в очаге заболевания, способствуя освобождению хемотаксических факторов и цитокинов, а также превращению триглицеридов кожного сала в свободные жирные кислоты.
В механизме развития акне важными являются следующие компоненты патогенеза — относительный недостаток линолевой кислоты, действие андрогенов и свободных жирных кислот. На продукцию кожного сала огромное влияние оказывают андрогены, которые в большом количестве начинают поступать в кожу в пубертатном периоде, определенное значение имеет гормон роста, инсулиноподобный фактор роста и вещества, активирующие образование пероксисом [8].
Мишенями действия половых гормонов в коже являются эпидермис, волосяные фолликулы, сальные железы, фибробласты. На продукцию кожного сала влияют гормоны тестикулярного или овариального (свободный тестостерон) и надпочечникового (дегидроэпиандростерон, андростендион) происхождения. Подобное действие оказывает и предшественник тестостерона, эстрогенов и адренокортикостероидов — прогестерон, обладающий андрогенным и антиэстрогенным воздействием на секрецию сальных желез. Этим объясняется повышение салоотделения и усиление образования акне в предменструальный период.
Важное значение имеет не только повышение уровня андрогенов, но и повышенная чувствительность клеток-мишеней, в частности клеток сальной железы, к андрогенам, циркулирующим в крови.
В патогенезе угрей важная роль отводится дефициту цинка, который регистрируется у 80% больных. На фоне цинкдефицитного состояния возрастает темп экскреции кожного сала, а тяжесть течения болезни коррелирует со степенью снижения цинка в организме больного. Цинк снижает активность 5a-редуктазы, что способствует нормализации соотношения гормонов и ведет к уменьшению салоотделения.
Наружная терапия является первой линией лечения акне у новорожденных, в детском возрасте, при дебюте акне и юношеских угрях. Назначение только наружной терапии показано при легких воспалительных и невоспалительных формах акне, невоспалительных формах акне средней тяжести. Во всех остальных случаях назначается комбинированная терапия с системными препаратами.
Препараты для наружной терапии назначаются длительно, минимальный курс лечения составляет 3 мес, после окончания курса необходимо назначение лекарственных средств с профилактической целью для предотвращения обострения заболевания.
В 2002 г. разработаны рекомендации и алгоритм патогенетического лечения различных форм акне (XX Всемирный конгресс по дерматологии, Париж, 2002), в которых препаратами первого выбора врача при лечении акне являются местные ретиноиды. Топические ретиноиды влияют на процессы ороговения (кератинизацию и десквамацию), снижают салоотделение, усиливают пролиферацию эпителиоцитов кожи и обладают определенным противовоспалительным действием. Наиболее перспективным является адапален (дифферин), обладающий хорошей переносимостью, отсутствием фотосенсибилизирующего действия, высокой эффективностью при комедональных и папуло-пустулезных акне [6]. Адапален применяется после очищения кожи 1 раз в сут на ночь, стойкое клиническое улучшение наблюдается через 3 мес, в поддерживающем режиме препарат наносят 2–3 раза в неделю.
Бензоила пероксид (базирон АС, окси-5, окси-10) после нанесения на кожу приводит к освобождению активных форм кислорода, уменьшению синтеза свободных жирных кислот и образования микрокомедонов. Препарат обладает выраженным влиянием на P. acnes, St. epidermidis, Malassezia furfur и снижает риск развития резистентности при комбинировании с антибиотиками. Выпускается бензоил пероксид в виде геля 2,5 –10% и 5–10% лосьона. Бензоил пероксид наносят на кожу 2–3 раза в день в течение 1–3 мес. Побочными эффектами препарата являются раздражающее действие, особенно при применении высоких концентраций, а также повышение фоточувствительности за счет истончения рогового слоя. Препарат способен обесцвечивать волосы, поэтому рекомендуется его применение при сочетании акне и гипертрихоза. Противопоказанием является повышенная чувствительность к компонентам препарата.
Широко применяется для наружного лечения акне азелаиновая кислота (скинорен), обладающая способностью нормализовать процессы кератинизации фолликула, антимикробным и противовоспалительным действием, способная уменьшать пигментацию кожи [6]. Препарат выпускают в виде 20% крема и 15% геля. Наносят его на всю поверхность лица или другие пораженные участки кожи утром и вечером, лечение продолжают до достижения терапевтического эффекта. Специфических противопоказаний к препарату нет.
Топические антибиотики. Назначение показано при папуло-пустулезных акне легкой и средней тяжести в комбинации с топическими ретиноидами или бензоил пероксидом. Среди антибиотиков для наружного применения на первом месте стоят эритромицин, клиндамицин, фузидиевая кислота. Монотерапия местными антибиотиками не даст желательного эффекта, так как не оказывает достаточного влияния на основные патогенетические факторы, кроме колонизации P. acnes.
Эритромицин выпускается в комбинации с препаратом цинка (зинерит). Лосьон наносят на кожу 2 раза в день в течение 12 нед. Побочное действие — сухость, жжение, дерматит.
Клиндамицин выпускается в виде 1% геля или лосьона, который при нанесении на кожу гидролизуется в выводных протоках сальных желез. Несмотря на минимальное всасывание, препарат может вызывать нарушения со стороны желудочно-кишечного тракта, аллергические реакции. Наносят препарат 1–2 раза в день в течение 3 мес.
Фузидиевая кислота выпускается для наружного применения в виде 2% крема (фуцидин), обладает способностью хорошо проникать через неповрежденную кожу и оказывает выраженное бактерицидное действие [7]. Крем применяют 2 раза в день в течение 7 дней. Не отмечено системного действия препарата и индивидуальной непереносимости.
Местные формы антибиотиков обычно хорошо переносятся, аллергический контактный дерматит развивается редко. Длительное наружное применение антибиотиков может привести к развитию бактериальной резистентности P. acnes.
α-гидроксикислоты (АНА) — яблочная, тартаровая, цитрусовая, молочная, гликолевая — обладают комедолитическим свойством. При концентрации АНА 30–70% (гликолевый пилинг) лечение проводится утром 1 раз в день, в вечернее время назначают ретиноиды. Препараты с концентрацией кислоты 10–15% (эксфолиак, крем 10; эксфолиак, крем 15) назначают пациентам с акне ежедневно в течение 8 нед. При низких концентрациях АНА лекарственные средства назначаются в межрецидивный период и для профилактики осложнений угревой болезни (рубцов и пигментации).
β-гидроксикислоты — салициловая кислота, резорцин — влияют на фолликулярный гиперкератоз, так как являются слабыми кератолитиками и обладают противовоспалительными свойствами. Применяются в различных лекарственных формах, чаще — растворах (салициловая кислота 0,5%–5%, резорцин 1–3%).
Гиалуроновая кислота в сочетании с цинком (куриозин, гель) используется как профилактическое средство после разрешения клинических проявлений акне. Гиалуроновая кислота способствует формированию косметических рубцов. Препарат наносят 2 раза в сут до достижения клинического эффекта. Побочными реакциями являются жжение, чувство стягивания кожи, легкая гиперемия, которые самостоятельно исчезают при продолжении терапии.
Системная терапия акне показана для лечения больных с акне средней или тяжелой формы, особенно в случаях образования рубцов, дисхромий или значительных психосоциальных расстройств. Системная терапия может быть необходима при непереносимости или неэффективности местного лечения.
Наиболее эффективным препаратом для лечения акне среднетяжелой и тяжелой форм является изотретиноин (роаккутан), который при системном применении вызывает длительные ремиссии или излечение у большинства больных. Препарат является ретиноидом, рекомендуемым для системного применения, влияет на процессы дифференцировки и кератинизации клеток эпидермиса, в том числе сальных желез, обладает выраженным себостатическим и противовоспалительным действием. Оптимальная суточная доза изотретиноина составляет 0,5–1,0 мг на 1 кг массы тела больного. Стандартная начальная терапевтическая доза 0,5 мг/кг. Обычные сроки лечения составляют 4–8 мес. После достижения выраженного терапевтического эффекта (чаще к концу 2-го месяца) начальная суточная доза снижается (с 1,0 до 0,5 мг/кг; с 0,5 до 0,2–0,3 мг/кг) и используется до излечения пациента. При флегмонозных и конглобатных угрях снижение суточной дозы целесообразно проводить в более поздние сроки (через 3–4 мес после начала лечения) [3].
Роаккутан обладает тератогенным действием, что ограничивает его применение для женщин детородного возраста. До начала лечения обязательно исключается беременность, пациентки должны использовать эффективные контрацептивные средства за 1 мес до начала лечения, весь период лечения и в течение 1 мес после его прекращения.
Побочные реакции при приеме роаккутана многообразны и касаются различных органов и систем (сухость кожи и слизистых, хейлит, конъюнктивит, носовые кровотечения, ретиноидный дерматит, фотосенсибилизация кожи, мышечная скованность, гиперостоз, повышение активности трансаминаз, липидов крови и др.), кроме тератогенного эффекта остальные побочные реакции являются дозозависимыми. До начала и в процессе лечения необходим тщательный контроль состояния пациента. Пациенты с почечной и печеночной недостаточностью, сахарным диабетом, склонностью к нарушению обмена веществ (гиперлипидемия) не должны получать лечение этим препаратом.
Системные антибиотики. Наиболее часто применяют эритромицин и тетрациклин. Лечение антибиотиками проводят длительно, 6–8 нед и дольше. Назначаются дозы с 1 г в сутки циклами по 5–10 дней без перерывов, но со снижением суточной дозы в каждом последующем цикле на 0,1–0,2 г, доводя постепенно суточную дозу до 0,1–0,2 г [3]. Одновременно с антибиотиками необходимо назначать противогрибковые препараты для профилактики кандидозов и препараты цинка (сульфат или окись цинка 0,02–0,05 — 2–3 раза в день после еды). Противопоказаниями для назначения системных антибиотиков являются индивидуальная непереносимость, беременность и кормление грудью, наличие сопутствующих грибковых поражений кожи и слизистых, тяжелые заболевания печени и почек, лейкопении.
Оральные контрацептивы (диане-35) обладают фармакологическим действием, связанным с блокированием рецепторов андрогенов и уменьшением их эндогенного синтеза. В результате тормозится секреция сальных желез. Диане-35 содержит 2 мг ципротерона ацетата и 35 мкг этинилэстрадиола. Препарат назначают только женщинам, с 5-го дня менструального цикла ежедневно 1 драже в сутки в течение 21 дня, затем — 7-дневный перерыв. Противопоказаниями для назначения препарата являются беременность и лактация, тяжелые заболевания печени, тромбоэмболические процессы, сахарный диабет, нарушения липидного обмена, гипертоническая болезнь.
По степени влияния на основные факторы патогенеза действие препаратов проявляется так, что ретиноиды являются самыми эффективными средствами для контроля гиперкератинизации фолликула и предотвращения развития микрокомедонов. В меньшей степени на этот процесс влияют бензоил пероксид, азелаиновая и салициловая кислота. По влиянию на P. acnes на первом месте стоит бензоил пероксид, затем антибиотики и азелаиновая кислота и в меньшей степени изотретиноин. Уменьшению секреции кожного сала способствуют ретиноиды и гормональные препараты. Менее всего современные лекарственные средства влияют на процесс воспаления в области угревых элементов [8].
Ни один из современных методов лечения угрей не может гарантировать отсутствие рецидивов заболевания в будущем. Поэтому при достижении клинического выздоровления каждому пациенту следует рекомендовать комплекс лечебно-профилактических мероприятий, которые могут быть разделены на рекомендации по уходу за кожей и общие.
Среди общих рекомендаций важными являются санация очагов хронической инфекции, обследование органов желудочно-кишечного тракта и эндокринной системы, общее закаливание организма.
Диета с ограничением шоколада, кофе, углеводов, алкоголя должна рекомендоваться в тех случаях, когда употребление в пищу этих продуктов приводит к усилению жирности кожи лица и обострению заболевания.
Развитие акне не связано с недостаточностью ухода за кожей лица, как это часто считают пациенты, начиная лечение заболевания с посещения косметолога. В то же время выполнение ежедневных очищающих процедур косметического характера показано при любой тяжести заболевания. Рекомендуется ежедневное очищение кожи с использованием различных моющих средств, поддерживающих нейтральный или кислый рН кожи и обладающих антибактериальным действием. Пациент должен знать о необходимости исключения косметических средств, вызывающих закупорку протоков сальных желез (мази, жирные кремы), и скрабов.
Таким образом, располагая широким выбором средств для лечения акне и косметической продукцией для ухода за кожей, склонной к угревой болезни, врач в процессе лечения может переходить от направленного воздействия на одни механизмы патогенеза к препаратам, влияющим на его другие компоненты. При этом самым важным является регулярная коррекция назначенного лечения и длительное динамическое, диспансерное наблюдение за пациентом, даже после достижения клинической ремиссии.
Литература
И. Г. Сергеева, кандидат медицинских наук
Ю. М. Криницына, доктор медицинских наук
Новосибирский государственный университет, Новосибирск
Чем можно заменить роаккутан
Российский университет дружбы народов, Москва, 117198, Российская Федерация
Российский университет дружбы народов, Москва, 117198, Российская Федерация
Акнекутан в терапии акне: новая схема низких доз
Журнал: Клиническая дерматология и венерология. 2014;12(2): 84-90
Баткаев Э. А., Молодова Ю. С. Акнекутан в терапии акне: новая схема низких доз. Клиническая дерматология и венерология. 2014;12(2):84-90.
Batkaev A, Molodova Iu S. Using Aknekutan in acne therapy: a new low-dose scheme. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(2):84-90.
Российский университет дружбы народов, Москва, 117198, Российская Федерация
Российский университет дружбы народов, Москва, 117198, Российская Федерация
Российский университет дружбы народов, Москва, 117198, Российская Федерация
Несмотря на то что существует множество работ, посвященных лечению акне, а в аресенале врачей-дерматологов имеется широкий спектр лекарственных препаратов, активных в отношении акне, проблема лечения данного дерматоза остается актуальной.
По данным литературы, основные сложности при лечении пациентов с угревой болезнью врачи испытывают при оценке тяжести заболевания и выборе метода терапии в каждом конкретном случае. Также усложняют лечение определенные психологические проблемы у пациентов, такие как отсутствие веры в выздоровление, недоверие к врачу, нарушение самооценки. Таким образом, лечение пациентов с акне является трудноразрешимой задачей медицины [9, 15, 21].
Современные подходы к лечению акне включают назначение различных системных и наружных препаратов, влияющих на хорошо изученные к настоящему времени звенья патогенеза: гиперплазию и гиперсекрецию кожного сала, фолликулярный гиперкератоз, размножение Propionibacterium acnes и других микроорганизмов, воспаление в дерме. Выбор методов лечения угревой болезни должен основываться на адекватной клинической оценке степени тяжести угревой болезни, а также типа высыпаний на коже. Следует всегда учитывать состояние эндокринного фона и сопутствующие заболевания [4, 5, 17].
Эпидемиология
Однако в последнее время все чаще встречаются случаи дебюта акне в возрасте старше 25 лет, преимущественно у женщин, страдающих гормональными заболеваниями половой сферы с выраженными проявлениями гиперандрогении [2, 3, 6, 18].
Наличие акне даже в легкой форме на протяжении нескольких лет нередко приводит к образованию вторичных изменений кожи (дисхромий, рубцов, кист), вызывая психологические проблемы у больных. Локализация высыпаний на лице практически у всех пациентов вызывает психоэмоциональные нарушения, преимущественно дисморфофобии и дисморфомании [7, 19].
Многие авторы отмечают, что возникновение вторичных изменений кожи (постакне) обусловлено не тяжестью течения угрей, а длительностью заболевания, что диктует необходимость раннего начала рациональной терапии с дифференциальным подходом к стадии заболевания [11, 13].
Этиология и патогенез
Патогенез акне является мультифакторным. На сегодняшний день выделяют четыре ведущих этиологических фактора: фолликулярный гиперкератоз, увеличение количества P. acnes, изменение продукции кожного сала и воспаление [8].
Для сальных желез характерен голокриновый тип секреции. Их основной функцией является продукция кожного сала в результате полной дезинтеграции железистых клеток.
P. acnes являются анаэробными резидентными представителями микрофлоры кожи человека, способными проявлять свои патогенные свойства только в определенных условиях. P. acnes участвуют в развитии воспаления в очаге заболевания, способствуя освобождению хемотаксических факторов и цитокинов, а также превращению триглицеридов кожного сала в свободные жирные кислоты.
Бактерии P. acnes, которые несут на своей поверхности лиганды Toll-подобных рецепторов (TLR), играют важную роль в патогенезе акне. Известно, что бактерии окружены макрофагами, экспрессирующими на своей поверхности TLR2. Активация не только макрофагов в сальных фолликулах, но и моноцитов крови показала, что P. acnes стимулируют продукцию интерлейкинов (ИЛ) 8 и 12.
Важное значение имеет не только повышение уровня андрогенов, но и повышенная чувствительность клеток-мишеней, в частности клеток сальной железы, к андрогенам, циркулирующим в крови.
Повышенная продукция сала является, по-видимому, основной причиной акне. В этом случае не все липиды производятся с одинаковой скоростью, что приводит к нарушению баланса полярных и нейтральных липидов. В свою очередь, липиды играют значительную роль в трансдукции внутриклеточных сигналов и регуляции различных сигнальных путей. Так, липиды сальных желез стимулируют продукцию себоцитами как провоспалительных, так и противовоспалительных цитокинов за счет активации ядерных факторов транскрипции.
В патогенезе акне важная роль отводится дефициту цинка, который регистрируется у 80% больных. Цинк снижает активность 5α-редуктазы, что способствует нормализации соотношения гормонов и ведет к уменьшению салоотделения. На фоне дефицита цинка возрастает темп экскреции кожного сала, а тяжесть течения болезни коррелирует со степенью снижения содержания цинка в организме больного. Большую роль в развитии акне или обострении процесса играют пищевые факторы, в первую очередь молочные продукты. Молочные продукты содержат стероидные гормоны, а также около 60 других ростовых факторов. Из них наиболее однозначно показана связь с акне инсулиноподобного ростового фактора (IGF-1). Коровье молоко вызывает повышение сахара в крови и, соответственно, инсулина и IGF-1. Показано, что повышение IGF-1 ведет к повышению 5α-дигидротестостерона в крови. Уровень IGF-1 в крови коррелирует с активностью заболевания у подростков.
В развитии акне можно выделить две фазы.
Роль гормонов стресса в патогенезе акне подтверждается многочисленными данными об ухудшении течения болезни во время экзаменационных сессий у студентов. Снижение уровня стресса достигается с помощью адекватной физической нагрузки, специализированной терапии.
Инфицирование сально-волосяных луковиц чаще всего вызывают грамположительные анаэробные дифтериноподобные бактерии, которые производят пропионовую кислоту из кожного сала. Эти бактерии были названы Proprionbacterium Cornybacterium acnes. Стафилококк занимает 2-е место по частоте встречаемости и, обладая коагулирующим свойством, приводит впоследствии к формированию рубцовых изменений на коже. С наличием инфекции связана миграция в сальную железу клеток иммунной системы, которые продуцируют ряд цитокинов. Среди них ИЛ-1а вызывает гиперкератинизацию волосяной воронки, что показано в исследованиях in vivo и in vitro. Несомненно, что гиперкератинизации способствует гипоксия внутри фолликула, нарушающая десквамацию кератиноцитов. Тот же ИЛ-1а вызывает пролиферацию кератиноцитов, выстилающих сальную железу.
В настоящий момент нет единого мнения, в чем состоят различия в патогенезе открытых и закрытых угрей. Есть данные, показывающие генетическую предрасположенность к черным угрям людей с мутацией в гене FGFR2 [19, 21]. При этой мутации также наблюдается повышенная продукция ИЛ-1а.
Гипоталамо-гипофизарно-надпочечниковая регуляция считается ответственной за нейроэндокринный ответ себоцитов на стресс. Наличие кортикотропин-релизинг-гормона (КРГ), а также белка, с ним связывающегося, и рецептора к нему показано как in vivo, так и на клетках линии себоцитов SZ95. КРГ влияет на пролиферацию себоцитов, на баланс различных липидов. Тестостерон подавляет экспрессию рецептора КРГ. Уровень КРГ достоверно повышен в коже, подверженной акне, по сравнению с другими участками кожи.
Cистема проопиомеланокортина также вовлечена в функционирование сальных желез. Альфа-меланоцит-стимулирующий гормон (α-МСГ) активизирует как дифференцировку, так и липогенез. Себоциты человека экспрессируют два рецептора к этому фактору: 1-го и 5-го типов, причем рецептор 5-го типа является маркером дифференцировки и липогенеза себоцитов. Исследования последних лет показали, что β-эндорфин подавляет пролиферацию себоцитов и стимулирует липогенез.
Рецептор 1-го типа к гистамину также обнаружен на клетках линии SZ95 и в клетках волосяных фолликулов. Показано, что антагонисты гистамина снижают уровень сквалена в себоцитах и могут напрямую модулировать функцию жировых клеток.
Недавно появились данные о ключевой роли в патогенезе акне транскрипционного фактора FoxO1. Этот транскрипционный фактор является мишенью действия ретиноидов.
Дефицит FoxO1 приводит к усилению сигнала ростовых факторов с активацией фосфоинозитол-3-киназы и Akt-киназы в процессе ответа на гормоны, а также увеличение ответа на инсулин/IGF-1, что связано с потреблением инсулиногенной пищи (молока, молочных продуктов, высокогликемичных продуктов).
Дефицит FoxO1 усиливает трансактивацию андрогенных рецепторов и модулирует активность ядерных факторов и ключевых генов, вовлеченных в пролиферацию кератиноцитов сально-волосяного фолликула, липогенез себоцитов и экспрессию перифолликулярных воспалительных цитокинов.
Имеющиеся данные о генетической предрасположенности (мутации в гене FGFR2, дефицит FoxO1), а также корреляция тяжести заболевания с инсулиногенной пищей показывает, что первичной причиной акне является повышенная секреция кожного сала, приводящая к закупорке фолликула. Присоединение инфекции является вторичным событием, хотя именно инфекционная стадия приводит к гиперкератозу и формированию патологических элементов.
История развития ретиноидов
Среди современных методов терапии акне системное лечение препаратами с ретиноидами занимает лидирующее положение.
Ретиноиды как группа лекарственных препаратов появились сравнительно недавно, около 40 лет назад.
Внутри самой группы ретиноидов наблюдается существенная гетерогенность как по свойствам, так и по результатам клинического использования.
Ретиноиды участвуют в регуляции транскрипции генов путем активации рецепторов, расположенных в ядре. Ретиноиды (лиганды) связываются с факторами транскрипции (рецепторы ядра), а затем образовавшийся комплекс «лиганд-рецептор» присоединяется к участку промоции соответствующего гена, в результате чего синтезируются вещества, обусловливающие фармакологическое действие (как лечебное, так и побочное).
Ретиноиды способствуют нормализации терминальной дифференцировки клеток, тормозят гиперпролиферацию эпителия выводных протоков сальных желез, образование детрита и облегчают его эвакуацию. За счет этого снижается выработка и нормализуется состав кожного сала, облегчается его выделение.
Кроме того, эти препараты оказывают противовоспалительное и иммунотропное действие в гнойном очаге путем ингибирования медиатора воспаления лейкотриена В4.
Таким образом, при наружном и системном применении ретиноиды оказывают антикомедогенное, себостатическое, противовоспалительное, керато- и иммуномодулирующее действие, активируют процессы регенерации в коже, стимулируют синтез коллагена, увеличивают продукцию мукополисахаридов и гликозаминогликанов.
Изучение механизма действия 14 синтетических аналогов витамина А позволило выявить, что биологическим эффектом обладают ретиналь, ретинол, ретиноевая кислота и их производные. Эти соединения модифицируют пролиферацию, дифференцировку и функциональную активность клеток мезенхимального и эктодермального происхождения.
С 1968 г. синтезировано более 1500 ретиноидов, изучена их способность вызывать биологические ответы в организме животных и человека, однако только несколько десятков из них используется сегодня в мировой лечебной практике.
Третиноин является естественным метаболитом ретинола. При приеме внутрь подавляет дифференцировку и рост клона измененных клеток крови, включая миелолейкозные клетки человека. В 1969 г. A. Kligman сообщил, что третиноин эффективен при акне, и впервые попытался объяснить его механизм действия. При местном применении 0,1% третиноин усиливает пролиферацию клеток в сосочковом слое кожи, снижает адгезию клеток, участвующих в образовании акне, способствует выравниванию поверхности кожи без признаков воспаления. Антикератотическое действие ретиноидов обусловлено уменьшением сцепления роговых клеток, что объясняется изменением состава межклеточного вещества. Ежедневное использование 0,05% крема третиноина для коррекции фотоповреждения довольно быстро приводит к уменьшению глубины морщин, коррелирующему с появлением в эпидермисе мукополисахаридов, однако быстрое первоначальное улучшение носит временный характер.
В начале 80-х годов прошлого столетия в литературе стали появляться сведения о наличии у производного цисретиноевой кислоты (Ro-4-3780) ярко выраженных регуляторных свойств по отношению к сальным железам животных и человека.
Спустя несколько лет этот препарат был введен в клиническую практику под международным названием изотретиноин (13-цис-изомер ретиноевой кислоты). Изучению уникальных свойств препарата, применяемого как местно, так и системно, было посвящено значительное количество работ во всем мире.
Установлено, что изотретиноин, взаимодействуя с ядерными рецепторами, в большей мере, чем другие ретиноиды, влияет на процессы дифференцировки клеток сальных желез, что приводит к выраженному уменьшению их размеров, подавлению активности и резкому снижению показателей экскреции кожного сала. В зависимости от длительности применения препарата развивается его себостатическое действие. Дополнительно изотретиноин оказывает умеренное иммуномодулирующее действие и обладает противовоспалительными свойствами.
Согласно инструкции по применению изотретиноин показан при наличии тяжелых форм акне, а также акне, резистентных к другим видам лечения.
Материал и методы
Критериями включения в исследование были следующие: возраст пациентов (мужчины и женщины) от 18 до 38 лет; папулопустулезная форма акне легкой, средней и тяжелой степени тяжести; продолжительность заболевания от 4 до 15 лет; неэффективность ранее применяемых методов терапии; способность выполнять требования исследования и предоставление письменного информированного согласия пациента.
Критерии исключения: возраст больных до 17 лет; комедональная форма акне; нарушение функции печени; положительный тест на беременность, а также женщины, планирующие беременность в период приема препарата Акнекутан; тяжелые соматические заболевания и наличие психических расстройств.
Под нашим наблюдением находились 70 пациентов с папулопустулезной формой акне различной степени тяжести. Распределение по клиническим формам, оценка степени тяжести дерматоза проводились по рекомендациям Американской академии дерматологии (2000 г.). При папулопустулезной форме акне степень тяжести соответствовала количеству воспалительных элементов:
Пациенты 1-й и 2-й групп получали Акнекутан в виде монотерапии по 0,16-0,32 мг на 1 кг массы тела, а пациенты 3-й группы первые 7-10 дней принимали антибиотики-макролиды с последующим назначением, после уменьшения острого воспалительного процесса, изотретиноина в дозе 0,32 мг на 1 кг массы тела.
У всех пациентов до лечения, а затем ежемесячно, исследовали биохимические показатели крови (аланинаминотрансфераза, аспартатаминотрансфераза, триглицериды, холестерин, щелочная фосфатаза, глюкоза, креатинин), проводили измерение секреции кожного сала на приборе Multiscope Monitor Center (Германия). По показаниям женщинам проводили гормональное исследование с целью исключения гиперандрогении. На каждого пациента составлялась индивидуальная карта, от всех было получено информированное согласие на проводимую терапию, а женщинам проведен тест на беременность и дано предупреждение о возможном тератогенном действии препарата.
Эффективность лечения оценивалась по относительному количеству выздоровевших больных, а также по периоду стойкой ремиссии заболевания после проведенного лечения. Период наблюдения за пациентами после проведенной терапии Акнекутаном составил 36 мес.
Оценка результатов лечения проводилась по следующим критериям:
Результаты исследования
В 1-й группе (n=20) клиническое выздоровление было достигнуто у всех пациентов (100%). На фоне проводимой терапии пациенты отметили регресс проявлений акне уже на 1-м месяце приема изотретиноина. Продолжительность лечения составила в среднем 4 мес. Все пациенты отметили хорошую переносимость проводимой терапии и стойкую ремиссию в течение 36 мес.
В 3-й группе (n=3) клиническое выздоровление наступило у 1 (33%) человека; у 1 (33%) больного отмечалось значительное улучшение, и эффект от терапии у 1 (33%) больного был оценен как улучшение. Все пациенты получали изотретиноин в дозе 0,32 мг на 1 кг массы тела в день в течение 6 мес. Все отметили хорошую переносимость препарата. Двое из троих пациентов через год обратились снова, однако высыпания соответствовали легкой степени тяжести заболевания.
Одной из задач настоящей работы являлся анализ побочных эффектов от приема системного ретиноида. Переносимость низких доз Акнекутана была хорошей. Явления ретиноидного дерматита носили значительно менее выраженный характер по сравнению с лечением по стандартным схемам применения. У всех пациентов на 2-3-й день терапии развились симптомы ретиноидного дерматита (особенно беспокоили явления хейлита, сухость и шелушение кожи лица), примерно у половины пациентов в течении 1-3-го месяцев терапии отмечалась умеренная сухость кожи кистей.
Выводы
Таким образом, полученные данные продемонстрировали эффективность применения низких доз изотретиноина для лечения легкой и среднетяжелых форм акне. У больных тяжелой формой акне применение низких доз Акнекутана было менее эффективным и сопряженным с риском рецидива заболевания, что подтверждает необходимость использования в данном случае стандартных суточных доз препарата, с достижением рекомендованной курсовой дозы изотретиноина 100-120 мг на 1 кг массы тела.
Отмечено уменьшение побочных эффектов при использовании низких доз изотретиноина.
Использование низких доз изотретиноина на примере Акнекутана для лечения больных легкой и среднетяжелой формами акне дает возможность повысить эффективность и сократить сроки лечения, упростить методику лечения, уменьшить медикаментозную и экономическую нагрузку на больных.