Что образуется при диссоциации кислот
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация оснований
Примеры уравнений диссоциации щелочей:
Многокислотные основания диссоциируют ступенчато:
Диссоциация амфотерных оснований (амфолитов)
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Na 3 PO 4 →3Na + + PO 3- 4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Диссоциация кислот
При диссоциации кислот роль катионов играют ионы водорода (H + ), других катионов при диссоциации кислот не образуется:
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляеют кислотный остаток.
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато: сначала отщепляется один ион водорода, затем другой (третий).
Ступенчатая диссоциация двухосновной кислоты:
Ступенчатая диссоциация трехосновной кислоты:
Диссоциация оснований
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными (см. Кислотно-основные реакции).
Диссоциация Zn(OH)2, как основания:
Диссоциация Zn(OH)2, как кислоты:
Диссоциация солей
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Классификация диссоциации солей:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Диссоциация оснований, кислот, солей
Урок 35. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Диссоциация оснований, кислот, солей»
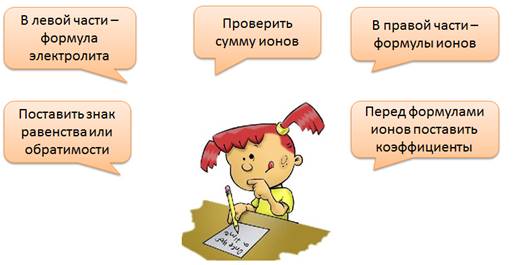
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
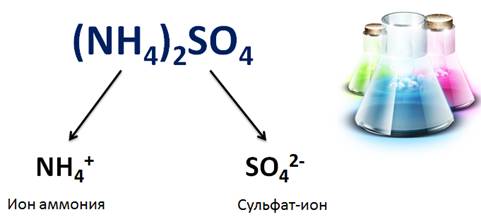
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4 + ), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.