Что полярнее вода или спирт
Разница между полярными и неполярными растворителями
В ключевое отличие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные сое
Содержание:
В ключевое отличие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.
Полярность соединения означает свойство иметь полюса. В химии это разделение зарядов в молекуле, которая имеет атомы или группы атомов с разной электроотрицательностью. Таким образом, это приводит к частичному положительному заряду и частичному отрицательному заряду в одном и том же соединении.
Что такое полярные растворители?
Полярность растворителя возникает из-за связи атомов с разными значениями электроотрицательности с образованием молекулы. Здесь более электроотрицательный атом притягивает пары электронов связи, что в конечном итоге дает менее электроотрицательному атому частичный положительный заряд из-за уменьшения электронной плотности вокруг себя. С другой стороны, более электроотрицательный атом получает частичный отрицательный заряд, поскольку электронная плотность вокруг этого атома увеличивается.
Кроме того, мы можем разделить полярные растворители на две группы: полярные протонные растворители и полярные апротонные растворители. Полярные протонные растворители содержат лабильный H + ионы. Это означает, что молекулы этих растворителей могут отдавать атомы водорода. Однако полярные апротонные растворители не могут отдавать атомы водорода.
Что такое неполярные растворители?
Неполярные растворители могут растворять неполярные соединения за счет сил притяжения, таких как силы Ван-дер-Вааль. Некоторые примеры неполярных растворителей включают пентан, гексан, бензол, толуол и т. Д.
В чем разница между полярными и неполярными растворителями?
В основном мы можем разделить растворители на две категории: полярные растворители и неполярные растворители. Ключевое различие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.Кроме того, еще одно существенное различие между полярными и неполярными растворителями заключается в том, что полярные растворители имеют высокий дипольный момент, в то время как неполярные растворители не имеют дипольного момента. Типичным примером полярного растворителя является вода. Некоторые примеры неполярных растворителей включают пентан, гексан, бензол, толуол и т. Д.
Более того, полярные растворители имеют молекулы с полярными связями (эти связи показывают разделение электрических зарядов из-за различий в электроотрицательности атомов в связи). У неполярных растворителей есть молекулы, содержащие химические связи, состоящие из атомов, имеющих почти одинаковые значения электроотрицательности.
Мы можем разделить растворители в основном на две категории: полярные растворители и неполярные растворители. Ключевое различие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.
Полярные вещества
Поля́рные вещества́ в химии — вещества, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
Дипольный момент обычно возникает вследствие разной электроотрицательности составляющих молекулу атомов, из-за чего связи в молекуле приобретают полярность. Однако, для приобретения дипольного момента требуется не только полярность связей, но и соответственное их расположение в пространстве. Молекулы, имеющие форму, подобную молекулам метана либо двуокиси углерода, являются неполярными.
Полярные растворители наиболее охотно растворяют полярные вещества, а также обладают способностью сольватировать ионы. Примерами полярного растворителя являются вода, спирты и другие вещества.
См. также
Полезное
Смотреть что такое «Полярные вещества» в других словарях:
Полярные сияния* — в средних и высоких широтах ночью можно видеть световое явление, в северном полушарии появляющееся обыкновенно на северной стороне небосклона, которое называют северным сиянием (народное название на сев. России сполох. Aurore boré ale, Nordlicht … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полярные сияния — в средних и высоких широтах ночью можно видеть световое явление, в северном полушарии появляющееся обыкновенно на северной стороне небосклона, которое называют северным сиянием (народное название на сев. России сполох. Aurore boréale, Nordlicht,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полярные струйные течения — Полярное струйное течение, или джет часто наблюдаемое в космосе явление, когда из компактного объекта вдоль его оси вращения выбрасываются потоки вещества. Причиной обычно служат динамические взаимодействия внутри аккреционного диска. Когда… … Википедия
Поверхностно-активные вещества — (a. surfactants; н. grenzflachenaktive Stoffe, oberflachenaktive Stoffe; ф. substances tensio actives; и. surfac tantes), вещества c асимметричной мол. структурой, молекулы к рых имеют дифильное строение, т.e. содержат лиофильные и… … Геологическая энциклопедия
ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА — вещества, способные адсорбироваться на поверхности раздела двух фаз, понижая её поверхностное натяжение. К П. а. в. относятся органич. соединения с асимметричной мол. структурой, молекулы к рых содержат ат. группы, резко различающиеся характером… … Физическая энциклопедия
Поверхностно-активные вещества ПАВ — ► surfactant species Вещества с асимметричной молекулярной структурой, молекулы которых имеют дифильное строение, т. е. содержат лиофильные и лиофобные (обычно гидрофильные полярные группы и гидрофобные радикалы) атомные группы. Дифильная… … Нефтегазовая микроэнциклопедия
Пассивный транспорт — Пассивный транспорт перенос веществ по градиенту концентрации из области высокой концентрации в область низкой, без затрат энергии (например, диффузия, осмос). Диффузия пассивное перемещение вещества из участка большей концентрации к… … Википедия
Собиратель — (a. collector; н. Sammler; ф. collecteur; и. coagulante, sustancia para hidrofobizacion particulas en el proceso de flotacion) органич. соединение, предназначенное для гидрофобизации минеральных частиц, гл. обр. при флотации п. и. C.… … Геологическая энциклопедия
Гемато-энцефалический барьер — Взаимоотношение клеток ткани мозга и капилляра: 1. Эпендима 2. Нейрон 3. Аксон 4. Шванновская клетка 5. Астроцит 6 … Википедия
Активный уголь — активированный уголь, получают из ископаемых или древесных углей удалением смолистых веществ и созданием разветвленной сети пор. Обладает высокоразвитой поверхностью, благодаря этому поглощает (адсорбирует) многие вещества (особенно… … Большая советская энциклопедия
Что полярнее вода или спирт
ХИМИЯ ЕГЭ | Химический кампус | Регина Ли запись закреплена
Полярная молекула или неполярная?
#ХимКампус_статья
Такие вопросы попадаются в тренировочных заданиях по теме «Химическая связь». Важно заметить, что полярная связь не равно полярная молекула! Полярность определяется неравномерным распределением электронной плотности вокруг молекулы.
Если электронная плотность распределена равномерно, то молекула считается неполярной. Если какой-то участок молекулы перетягивает на себя эту электронную плотность, то молекула – полярная (появляется разные полюсы – области частичного заряда).


Полярная молекула имеет асимметричную форму, неподеленную электронную пару или центральный атом, связанный с другими атомами с разными значениями электроотрицательности. Обычно полярная молекула содержит ионные или полярные ковалентные связи. Приведем примеры:
Полярные молекулы часто гидрофильны («любят воду») и растворимы в полярных растворителях. Полярные молекулы часто имеют более высокие температуры плавления, чем неполярные молекулы с аналогичными молярными массами. Это связано с межмолекулярными силами между полярными молекулами, такими как водородная связь!

Неполярные молекулы образуются либо тогда, когда электроны одинаково распределяются между атомами в молекуле, либо когда расположение электронов в молекуле симметрично, так что дипольные заряды компенсируют друг друга. Приведем примеры неполярных молекул:
Неполярные молекулы обладают некоторыми общими свойствами. Они, как правило, нерастворимы в воде при комнатной температуре, гидрофобны («боятся воды») и способны растворять другие неполярные соединения.
Мы помним золотое правило «подобное растворяется в подобном». Это означает, что полярные растворители растворяют полярные вещества, и наоборот. Это объясняет, почему спирт и вода полностью смешиваются (как полярные) и почему масло и вода не смешиваются (неполярные с полярными).
Дополнительную информацию и объяснение на примерах можно почитать в файлике ниже!
Г. Полярность растворителя



Растворимость препарата в данном растворителе в значительной степени зависит от полярности растворителя. По диэлект- рической константе растворители классифицируют на полярные (е >50), полуполярные (е = 20-50) или неполярные (е = 1-20) (табл. 12.5).
Таблица 12.5.Диэлектрическая константа растворителей
| Растворитель | Диэлектрическая константа, е, 20 град.C |
| N-метилформамид | 190 |
| Вода | 80 |
| Раствор сорбитола (70%) | 62 |
| Сироп (64%) | 56 |
| Глицерин | 46 |
| Пропиленгликоль | 32,1 |
| Этанол | 25 |
| Полиэтиленгликоль 400 | 12,4 |
| Хлороформ | 5 |
| Касторовое масло | 4,6 |
| Эфир | 4,3 |
| Оливковое масло | 3,1 |
Полярные растворители растворяют соли или высокополярные (дипольные) молекулы. Неполярные растворители растворяют непо- лярные молекулы. Полуполярные растворители (спирты и кетоны) могут растворять и те и другие в зависимости от их свойств. Таким образом, в фармации существует универсальное правило выбора растворителя: «Подобное растворяется в подобном».
Существует 2 способа увеличения растворимости веществ в полуполярных растворителях:
1. Изменяя рН, чтобы изменять полярность вещества (соль или основание). Увеличение концентрации соли приводит к увеличению
2. Смешивая растворители различных полярностей, чтобы изменять полярность растворителя.
Пример 2
Заменить спирт на глицерин в составе раствора фурацилина 1:1500. Для определения диэлектрической константы растворителя готовят смеси этанола с водой. Затем готовят в данных смесях растворы, остав- ляют на ночь, наблюдая осаждение (табл. 12.6).
Таблица 12.6.Влияние спирта на осаждение фурацилина
| % v/v спирта | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Осаждение | + | + | + | + | + | + | — | — | — | — | — |
Смесь 95 г глицерина и 5 мл воды рекомендована для получения не содержащего спирта раствора фурацилина.
Лекция № 12.
Контрольные вопросы
1. Дайте определение растворам с точки зрения дисперсологической классификации.
2. Какие существуют методы получения воды очищенной?
3. Какие требования предъявляются к качеству воды очищенной?
4. Какие существуют требования к качеству воды для инъекций?
5. Какие существуют методы получения воды для инъекций?
6. Как хранят воду очищенную и воду для инъекций?
Тесты
1. Жидких. 2. Твердых. 3. Газообразных веществ в соответствующем растворителе
2. Истинные растворы низкомолекулярных веществ:
1. Проходят сквозь фильтр.
2. Проходят через диализирующую мембрану.
3. Не изменяют свойства при центрифугировании.
3.Способы получения воды очищенной:
1. Дистилляция. 2. Обратный осмос. 3. Ионный обмен.
4. Дистиллятор состоит из следующих основных блоков:
1. Охладитель (конденсатор). 2. Уравнитель. 3. Наполнитель.
4. Камера испарения (испаритель). 5. Электронагреватели. 6. Датчик уровня.
5. Ежедневно перед началом работы проводят пропаривание дистиллятора и трубопроводов при закрытых вентилях подачи воды в конденсатор в течение:
1. 5 мин. 2. 10 мин. 3. 15 мин. 4. 20 мин. 5. Затем 15-20 мин отбрасывают первые порции воды.
6. В аквадистилляторах для получения апирогенной воды АА-1 имеются сепараторы для:
1. Отделения механических включения.
2. Для удаления из пара капельножидкой фазы.
3. Для удаления микроорганизмов.
1. Воду для инъекций используют свежеприготовленную;
8. Пирогенными веществами называют продукты:
1. Жизнедеятельности микроорганизмов.
2. Распада микроорганизмов.
3. Погибшие микробные клетки.
4. Жизнеспособные микроорганизмы.
9. Пирогенные вещества разрушаются при:
1. Кипячении в течение 6 ч.
Содержание
Решения и сольватация
Когда одно вещество растворенный в другой, решение сформирован. [2] Это противоположно ситуации, когда соединения нерастворимый как песок в воде. В растворе все ингредиенты равномерно распределены на молекулярном уровне и не остается остатков. Смесь растворителя и растворенного вещества состоит из одного фаза со всеми молекулами растворенного вещества, встречающимися как сольваты (растворитель-растворенный комплексы), в отличие от отдельных непрерывных фаз, как в суспензиях, эмульсиях и других типах смесей, не являющихся растворами. Способность одного соединения растворяться в другом известна как растворимость; если это происходит во всех пропорциях, это называется смешивающийся.
Помимо перемешивания, вещества в растворе взаимодействуют друг с другом на молекулярном уровне. Когда что-то растворяется, молекулы растворителя располагаются вокруг молекулы растворенного вещества. Теплопередача участвует и энтропия увеличивается, делая решение более термодинамически стабильнее, чем растворенное вещество и растворитель по отдельности. Такое расположение опосредуется соответствующими химическими свойствами растворителя и растворенного вещества, такими как водородная связь, дипольный момент и поляризуемость. [3] Сольватация не вызывает химической реакции или изменений химической конфигурации растворенного вещества. Однако сольватация напоминает координационный комплекс реакция образования, часто со значительной энергетикой (теплота сольватации и энтропия сольватации) и, таким образом, далека от нейтрального процесса.
Классификация растворителей
Растворители можно условно разделить на две категории: полярный и неполярный. Особый случай Меркурий, решения которой известны как амальгамы; также другие металлические решения существуют жидкие при комнатной температуре. Как правило, диэлектрическая постоянная Количество растворителя позволяет приблизительно определить полярность растворителя. На сильную полярность воды указывает ее высокая диэлектрическая проницаемость 88 (при 0 ° C). [4] Растворители с диэлектрической проницаемостью менее 15 обычно считаются неполярными. [5] Диэлектрическая проницаемость измеряет тенденцию растворителя частично компенсировать напряженность электрического поля заряженная частица погрузился в него. Это сокращение затем сравнивается с напряженность поля заряженной частицы в вакууме. [5] Эвристически диэлектрическую проницаемость растворителя можно рассматривать как его способность снижать эффективность растворенного вещества. внутренний заряд. Как правило, диэлектрическая проницаемость растворителя является приемлемым показателем способности растворителя растворять обычные ионные соединения, например соли.
Другие шкалы полярности
В Грюнвальд – Винштейн мY шкала измеряет полярность с точки зрения влияния растворителя на накопление положительного заряда растворенного вещества во время химической реакции.
Kosowerс Z шкала измеряет полярность с точки зрения влияния растворителя на УФ-максимумы поглощения соли, обычно пиридиний йодид или пиридиний цвиттерион. [6]
Номер донора и шкала акцептора донора измеряет полярность с точки зрения того, как растворитель взаимодействует с определенными веществами, например, сильным Кислота Льюиса или сильная база Льюиса. [7]
В Параметр Хильдебранда квадратный корень из плотность когезионной энергии. Его можно использовать с неполярными соединениями, но он не подходит для сложных химических процессов.
Полярность, дипольный момент, поляризуемость и водородная связь растворителя определяет, какой тип соединения он способен растворяться и с какими другими растворителями или жидкими соединениями он смешивающийся. Обычно полярные растворители лучше всего растворяют полярные соединения, а неполярные растворители лучше всего растворяют неполярные соединения: «подобное растворяется в подобном». Сильно полярные соединения, такие как сахара (например, сахароза) или ионные соединения, такие как неорганический соли (например. столовая соль) растворяются только в очень полярных растворителях, таких как вода, в то время как сильно неполярные соединения, такие как масла или же воск растворяются только в очень неполярных органических растворителях, таких как гексан. Точно так же вода и гексан (или же уксус и растительное масло) не смешивающийся друг с другом и быстро разделятся на два слоя даже после хорошего встряхивания.
Полярность может быть разделена на разные вклады. Например, Параметры Камлета-Тафта диполярность / поляризуемость (π *), водородно-связывающая кислотность (α) и основность водородных связей (β). Их можно рассчитать по сдвигу длин волн 3–6 различных сольватохромных красителей в растворителе, обычно включая Краситель Рейхардта, нитроанилин и диэтилнитроанилин. Другой вариант, параметры Хансена, разделяют плотность энергии когезии на вклады дисперсии, полярности и водородных связей.
Полярный протон и полярный апротический
Многокомпонентный
Многокомпонентные растворители появились после Второй мировой войны в СССР и продолжают использоваться и производиться в постсоветских странах.
Растворители
| Имя | Сочинение |
|---|---|
| Растворитель 645 | толуол 50%, бутилацетат 18%, этилацетат 12%, бутанол 10%, этанол 10%. |
| Растворитель 646 | толуол 50%, этиловый спирт 15%, бутанол 10%, бутил- или амилацетат 10%, этилцеллозольв 8%, ацетон 7% [9] |
| Растворитель 647 | бутилацетат или амилацетат 29,8%, ацетат этила 21,2%, бутанол 7,7%, толуол или пиробензол 41.3% [10] |
| Растворитель 648 | бутил ацетат 50%, этанол 10%, бутанол 20%, толуол 20% [11] |
| Растворитель 649 | этилцеллозольв 30%, бутанол 20%, ксилол 50% |
| Растворитель 650 | этилцеллозольв 20%, бутанол 30%, ксилол 50% [12] |
| Растворитель 651 | белый дух 90%, бутанол 10% |
| Растворитель КР-36 | бутилацетат 20%, бутанол 80% |
| Растворитель П-4 | толуол 62%, ацетон 26%, бутилацетат 12%. |
| Растворитель П-10 | ксилол 85%, ацетон 15%. |
| Растворитель П-12 | толуол 60%, бутилацетат 30%, ксилол 10%. |
| Растворитель П-14 | циклогексанон 50%, толуол 50%. |
| Растворитель П-24 | растворитель 50%, ксилол 35%, ацетон 15%. |
| Растворитель П-40 | толуол 50%, этилцеллозольв 30%, ацетон 20%. |
| Растворитель П-219 | толуол 34%, циклогексанон 33%, ацетон 33%. |
| Растворитель Р-3160 | бутанол 60%, этанол 40%. |
| Растворитель RCC | ксилол 90%, бутилацетат 10%. |
| Растворитель РМЛ | этанол 64%, этилцеллозольв 16%, толуол 10%, бутанол 10%. |
| Растворитель ПМЛ-315 | толуол 25%, ксилол 25%, бутилацетат 18%, этилцеллозольв 17%, бутанол 15%. |
| Растворитель ПК-1 | толуол 60%, бутилацетат 30%, ксилол 10%. |
| Растворитель ПК-2 | уайт-спирит 70%, ксилол 30%. |
| Растворитель RFG | этанол 75%, бутанол 25%. |
| Растворитель РЭ-1 | ксилол 50%, ацетон 20%, бутанол 15%, этанол 15%. |
| Растворитель РЕ-2 | Растворитель 70%, этанол 20%, ацетон 10%. |
| Растворитель РЭ-3 | растворитель 50%, этанол 20%, ацетон 20%, этилцеллозольв 10%. |
| Растворитель РЭ-4 | растворитель 50%, ацетон 30%, этанол 20%. |
| Растворитель ФК-1 (?) | абсолютный спирт (99,8%) 95%, этилацетат 5% |
Разбавители
| Имя | Сочинение |
|---|---|
| Разбавитель РКБ-1 | бутанол 50%, ксилол 50% |
| Разбавитель РКБ-2 | бутанол 95%, ксилол 5% |
| Разбавитель РКБ-3 | ксилол 90%, бутанол 10% |
| Разбавитель М | этанол 65%, бутилацетат 30%, этилацетат 5%. |
| Разбавитель П-7 | циклогексанон 50%, этанол 50%. |
| Разбавитель Р-197 | ксилол 60%, бутилацетат 20%, этилцеллозольв 20%. |
| Разбавитель WFD | толуол 50%, бутилацетат (или амилацетат) 18%, бутанол 10%, этанол 10%, этилацетат 9%, ацетон 3%. |
Физические свойства
Таблица свойств распространенных растворителей
Растворители сгруппированы в неполярный, полярный апротический, и полярный протический растворители, причем каждая группа упорядочена по возрастанию полярности. В характеристики растворители, превышающие водные, выделены жирным шрифтом.
| Растворитель | Химическая формула | Точка кипения [13] (° C) | Диэлектрическая постоянная [14] | Плотность (г / мл) | Дипольный момент (D) |
|---|---|---|---|---|---|
| 36.1 | 1.84 | 0.626 | 0.00 | ||
| Циклопентан | 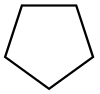 C5ЧАС10 | 49.2 | 1.97 | 0.751 | 0.00 |
| Гексан | 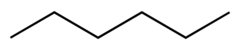 | 69 | 1.88 | 0.655 | 0.00 |
| Циклогексан |  C6ЧАС12 | 80.7 | 2.02 | 0.779 | 0.00 |
| Бензол | 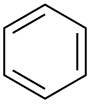 C6ЧАС6 | 80.1 | 2.3 | 0.879 | 0.00 |
| Тетрахлорметан | CCl4 | 76.7 | 2.3 | 1.5867 | 0.00 |
| Толуол | C6ЧАС5-CH3 | 111 | 2.38 | 0.867 | 0.36 |
| 1,4-диоксан |  C4ЧАС8О2 | 101.1 | 2.3 | 1.033 | 0.45 |
| Диэтиловый эфир |  Полярный апротический растворители | 100–103 | 35.87 | 1.1371 | 3.56 |
| Пропиленкарбонат |  Полярный протический растворители | 1.42 | |||
| Муравьиная кислота |  Н-С (= O) ОН | 100.8 | 58 | 1.21 | 1.41 |
| п-Бутанол |  | 64.7 | 33 | 0.791 | 1.70 |
| Уксусная кислота |  CH3-С (= О) ОН | 118 | 6.2 | 1.049 | 1.74 |
| Вода |  H-O-H | 100 | 80 | 1.000 | 1.85 |
В ACS Green Chemistry Institute поддерживает инструмент для выбора растворителей на основе Анализ главных компонентов свойств растворителя. [15]











